Химические свойства азотсодержащих органических соединений
Цель: отработать навыки экспериментальной работы, соблюдая правила техники безопасности при работе в кабинете химии.
Обеспеченность занятия
1. Сборник методических указаний для студентов по выполнению практических занятий и лабораторных работ по учебной дисциплине «Химия».
2. Раствор белка, растворы сульфата меди (II) и щёлочи, азотная кислота, водный раствор аммиака, шерсть, штатив с пробирками, прибор для нагревания, держатель, тигельные щипцы, спички.
Теоретический материал
Пептиды и белки представляют собой высокомолекулярные органические соединения, построенные из остатков α- аминокислот, соединенных между собой пептидными связями.
Ни один из известных нам живых организмов не обходится без белков. Белки служат питательными веществами, они регулируют обмен веществ, исполняя роль ферментов – катализаторов обмена веществ, способствуют переносу кислорода по всему организму и его поглощению, играют важную роль в функционировании нервной системы, являются механической основой мышечного сокращения, участвуют в передаче генетической информации.
Функции белков в природе универсальны.
Белки входят в состав мозга, внутренних органов, костей, кожи, волосяного покрова и т.д. Основным источником α- аминокислот для живого организма служат пищевые белки, которые в результате ферментативного гидролиза в желудочно-кишечном тракте дают α- аминокислоты.
|
|
|
Многие α- аминокислоты синтезируются в организме, а некоторые необходимые для синтеза белков α- аминокислоты не синтезируются в организме и должны поступать извне.
Такие аминокислоты называются незаменимыми.
К ним относятся валин, лейцин, треонин, метионин, триптофан и др. При некоторых заболеваниях человека перечень незаменимых аминокислот расширяется.
Пептиды и белки различают в зависимости от величины молекулярной массы. Условно считают, что пептиды содержат в молекуле до 100 (соответствует молекулярной массе до 10000), а белки - свыше 100 аминокислотных остатков (молекулярная масса от 10000 до нескольких миллионов).
| Первичная структура белка - специфическая аминокислотная последовательность, т.е. порядок чередования α- аминокислотных остатков в полипептидной цепи. | 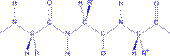
|
Вторичная структура белка - конформация полипептидной цепи, т.е. способ скручивания цепи в пространстве за счет водородных связей между группами NH и CO. Одна из моделей вторичной структуры – спираль.
Третичная структура белка - трехмерная конфигурация закрученной спирали в пространстве, образованная за счет дисульфидных мостиков –S–S– между цистеиновыми остатками и ионных взаимодействий.
|
|
|
Четвертичная структура белка - структура, образующаяся за счет взаимодействия между разными полипептидными цепями. Четвертичная структура характерна лишь для некоторых белков, например гемоглобина.
Химические свойства
1) Денатурация.
Утрата белком природной (нативной) конформации, сопровождающаяся обычно потерей его биологической функции, называется денатурацией. С точки зрения структуры белка – это разрушение вторичной и третичной структур белка, обусловленное воздействием кислот, щелочей, нагревания, радиации и т.д. Первичная структура белка при денатурации сохраняется. Денатурация может быть обратимой (так называемая, ренатурация) и необратимой. Пример необратимой денатурации при тепловом воздействии – свертывание яичного альбумина при варке яиц.
2) Гидролиз белков – разрушение первичной структуры белка под действием кислот, щелочей или ферментов, приводящее к образованию α - аминокислот, из которых он был составлен.
3) Качественные реакции на белки:
a) Биуретовая реакция – фиолетовое окрашивание при действии солей меди (II) в щелочном растворе. Такую реакцию дают все соединения, содержащие пептидную связь.
|
|
|
б) Ксантопротеиновая реакция – появление желтого окрашивания при действии концентрированной азотной кислоты на белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина).
Вопросы для закрепления теоретического материала
1. Что такое денатурация? Укажите условия денатурации белковых молекул.
2. Какие группы атомов и типы связей наиболее характерны для большинства белковых молекул?
3. Как можно доказать наличие белков в продуктах питания , в шерстяных и шёлковых тканях?
4. Какие вещества образуются при гидролизе белков в организме?
5. Чем отличается гидролиз белков от гидролиза полисахаридов?
Задание
1. Повторить теоретический материал по теме практического занятия.
2. Ответить на вопросы для закрепления теоретического материала.
3. Исследовать свойства белков.
4. Оформить отчет.
Инструкция по выполнению
1. Ознакомьтесь с правилами по технике безопасности при работе в химической лаборатории и распишитесь в журнале по ТБ.
2. Выполните опыты.
3. Результаты внесите в таблицу.
Опыт № 1 Свойствабелков
а) В пробирку налейте 2 мл раствора белка и добавьте 2 мл раствора щелочи, а затем несколько капель раствора медного купороса (сульфата меди (II)).
|
|
|
б) В пробирку с 2 мл раствора белка добавьте несколько капель азотной кислоты. Нагрейте содержимое пробирки. Охладите смесь и добавьте к ней по каплям 2–3 мл нашатырного спирта.
в) Подожгите несколько шерстяных нитей. Охарактеризуйте запах горящей шерсти.
г) К 3–4 мл раствора белка в воде добавьте несколько капель раствора медного купороса (сульфата меди (II)).
Образец отчёта
Лабораторная работа № 10 Химические свойства азотсодержащих органических соединений.
Цель: отработать навыки экспериментальной работы, соблюдая правила техники безопасности при работе в кабинете химии.
| Название опыта | Что делаете | Наблюдения и их объяснения |
Вывод делать в соответствии с целью работы
Литература0-1.с 98-101
Практическая работа № 3
Дата добавления: 2018-04-15; просмотров: 436; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
