Вопрос 3. ИЗОТЕРМЫ РЕАЛЬНОГО ГАЗА
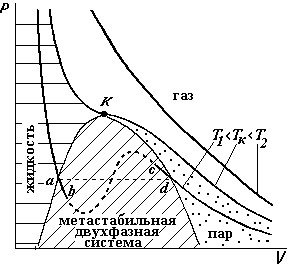 На рисунке приведены три изотермы, вычисленные по уравнению Ван-дер-Ваальса. При высоких температурах (Т2) кривая аналогична гиперболической изотерме идеального газа. При низких температурах (Т1) кривая имеет изгибы abcd, (т.к. это уравнение третьей степени по V). Изотерма Тк имеет один перегиб. Эту температуру называют критической температурой. Экспериментально полученные изотермы для различных газов имеют такой же характер, за исключением участка abcd. При этом в области правее критической изотермы вещество находится в газообразном состоянии. Левее точки d, (заштрихованная колоколообразная область) начинается частичная конденсация газа и образуется неустойчивая двухфазная система газ-жидкость.[3] Левее этой области газ переходит в жидкое состояние. Экспериментально весь участок abcd получить нельзя. При очень тщательном проведении эксперимента можно получить небольшие участки ab (перегретая жидкость) и cd (перегретый пар). Если газ находится при температуре Т > Тк, то никаким сжатием его невозможно перевести в жидкое состояние. Но если газ охладить до Т < Тк, то простым сжатием его можно превратить в жидкость. Поэтому в области левее от Тк,
На рисунке приведены три изотермы, вычисленные по уравнению Ван-дер-Ваальса. При высоких температурах (Т2) кривая аналогична гиперболической изотерме идеального газа. При низких температурах (Т1) кривая имеет изгибы abcd, (т.к. это уравнение третьей степени по V). Изотерма Тк имеет один перегиб. Эту температуру называют критической температурой. Экспериментально полученные изотермы для различных газов имеют такой же характер, за исключением участка abcd. При этом в области правее критической изотермы вещество находится в газообразном состоянии. Левее точки d, (заштрихованная колоколообразная область) начинается частичная конденсация газа и образуется неустойчивая двухфазная система газ-жидкость.[3] Левее этой области газ переходит в жидкое состояние. Экспериментально весь участок abcd получить нельзя. При очень тщательном проведении эксперимента можно получить небольшие участки ab (перегретая жидкость) и cd (перегретый пар). Если газ находится при температуре Т > Тк, то никаким сжатием его невозможно перевести в жидкое состояние. Но если газ охладить до Т < Тк, то простым сжатием его можно превратить в жидкость. Поэтому в области левее от Тк,
выделена область «пар», хотя это такое же газообразное состояние.
КРИТИЧЕСКОЕ СОСТОЯНИЕ
На рисунке на критической изотерме указана точка К – это критическая точка, ей соответствуют критические параметры pk , Vk и Тk.. Так как это точка перегиба, то для нее первая и вторая производные должны быть равны нулю.
|
|
|
|
| запишем уравнение Ван-дер-Ваальса в указанном виде, V º VM – молярный объем | |
|
| из этих уравнений, разделив первое уравнение на второе, найдем выражение для критического объема Vk | |
|
| ||
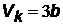


| критические параметры | подставив Vk в (2), получим критическую температуру Тk ; подставив Vk и Тk в (1) и найдем критическое давление рк |
Каждое вещество имеет определенные значения критических параметров. Критическая температура – это такая температура, при которой исчезает разница между жидким и газообразным состоянием. Для гелия Тк @ - 269 оС, для воды Тk.@ 374 Со, pk @ 218 атм. Опыты по определению критических параметров представляют собой большие трудности. Участок вблизи критической точки – это почти горизонтальная прямая, поэтому при значительном изменении объема давление меняется очень мало. Можно провести такой качественный опыт. Заполнить примерно на одну треть стеклянную ампулу с жидким эфиром и запаять ее. При этом четко видна граница жидкости. Если нагревать ампулу, то при температуре около 180 оС граница мгновенно исчезает и содержимое ампулы становится молочно белого цвета, это и есть переход в критическое состояние.
|
|
|
Определение параметров критического состояния имеет большое значение при исследовании веществ. Если для исследуемого вещества выполняется уравнение Ван-дер-Ваальса, то измеряя опытным путем pk , Vk и Тk., можно найти поправки a и b и получить сведения о свойствах молекул – их объеме и взаимодействии. При использовании вириального уравнения, коэффициенты В и С также связаны со свойствами молекул.
Вопрос 4.ВНУТРЕНЯЯ ЭНЕРГИЯ РЕАЛЬНОГО ГАЗА.ЭФФЕКТ ДЖОУЛЯ-ТОМСОНА.
Внутренняя энергия идеального газа представляет собой кинетическую энергию поступательного и вращательного движения его молекул, она зависит только от температуры. В реальных газах существует взаимодействие между молекулами, поэтому внутренняя их энергия – это сумма кинетической и потенциальной энергий. Вычислив работу по расширению реального газа в пустоту, можно найти потенциальную энергию взаимодействия молекул. Будем считать, что газ подчиняется уравнению состояния Ван-дер-Ваальса.
 
| собственное давление молекул газа и работа против сил взаимодействия, V º VM – молярный объем |

| Чем молекулы дальше друг от друга, тем потенциальная энергия их взаимодействия больше. Если принять W¥ = 0, получим W < 0 |
Таким образом, внутренняя энергия реального газа, для которого выполняется уравнение Ван-дер-Ваальса, равна: U=Wкин+ Wпот
|
|
|
Дата добавления: 2018-04-15; просмотров: 292; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

 (1)
(1) (2)
(2)