Вопрос 8.Релятивистский Импульс.
При использовании преобразований Лоренца основной закон динамики m(dp/dt)= F оказывается инвариантным при условии, что импульс частицы записывается в виде:

| Релятивистский импульс частицы |

| основной закон релятивистской динамики |
Тогда основной закон релятивистской динамики формально сохраняет такой же вид, как II закон Ньютона, но между ними имеется принципиальное различие.
 © ©
| Величина m называется релятивистской массой, она зависит от скорости тела и не является инвариантом, т.е. имеет различное значение в разных ИСО. |
m0 – масса тела, называемая также массой покоя, является инвариантом и имеет одно и то же значение в любых ИСО.
 В классической механике ускорение частицы и сила, вызвавшая это ускорение, всегда направлены одинаково. При скорости движения частицы сопоставимой со скоростью света, т.е. в релятивистском случае, направление ускорения и силы совпадают только в двух случаях: 1) когда сила параллельна скорости в каждый момент времени и 2) когда сила перпендикулярна скорости. В общем случае направления ускорения и силы не совпадают (см. рис)
В классической механике ускорение частицы и сила, вызвавшая это ускорение, всегда направлены одинаково. При скорости движения частицы сопоставимой со скоростью света, т.е. в релятивистском случае, направление ускорения и силы совпадают только в двух случаях: 1) когда сила параллельна скорости в каждый момент времени и 2) когда сила перпендикулярна скорости. В общем случае направления ускорения и силы не совпадают (см. рис)
Из СТО следует возможность существования частиц с нулевой массой, но они не могут быть неподвижными, а должны непрерывно двигаться, причем только со скоростью света с – это фотоны и, возможно, нейтрино.
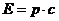
| связь энергии и импульса для частиц с нулевой массой (фотонов) m0 = 0 | |||
| Некоторые формулы из СТО, которые можно вывести из приведенных выше выражений
| ||||
|
| связь кинетической энергии частицы с ее импульсом | |||
|
| связь полной энергии частицы с ее импульсом | |||
|
| связь полной энергии и энергии покоя с импульсом | |||
Вопрос 9.Взаимосвязь массы и энергии в теории относительности.
Введем новые обозначения для энергии, которые чаще всего используются в СТО.
 - полная энергия,
- полная энергия,  - кинетическая энергия. Таким образом, из СТО следует, что любое неподвижное тело обладает запасом энергии, равной
- кинетическая энергия. Таким образом, из СТО следует, что любое неподвижное тело обладает запасом энергии, равной  .
.
В классической механике понятие «энергия покоя» отсутствовало.

| это выражение называется закон Эйнштейна взаимосвязи массы и энергии |
Согласно этому закону, общий запас энергии тела (или системы тел), из каких бы видов энергии он ни состоял (кинетическая, потенциальная, тепловая, электрическая и пр.) связан с массой тела (системы тел) этим соотношением. Все формулы СТО переходят в классические при v<< c.Например, найдем кинетическую энергию тела при малых скоростях.
 при при  << 1 << 1
| приближенное выражение, известное из математики |
Тема 12. МОЛЕКУЛЯРНАЯ ФИЗИКА.
Вопрос 1.Молекулярные системы.
Молекулярная физика изучает строение и свойства вещества, исходя из молекулярно-кинетических представлений, согласно которым все вещества – твердые, жидкие или газообразные - состоят из мельчайших частиц - атомов или молекул, находящихся в непрерывном тепловом движении. Невозможно изучать поведение одной молекулы, применяя к ней законы механики. Поэтому в молекулярной физике используется статистический подход. Всю совокупность молекул в данном объеме рассматривают в целом и характеризуют молекулы средними величинами – средняя энергия молекулы, средняя скорость молекулы, ее средняя длина свободного пробега и др. Эти средние характеристики каждой молекулы не меняются, если газ находится в равновесном состоянии, т.е. при неизменных внешних условиях. Статистический подход позволяет ввести такие характеристики, которых нет у одной молекулы, например, давление газа, температура и др. Статистический подход применим только к системам, состоящим из очень большого числа молекул.
|
|
|
Свойства (но не строение) вещества изучает также термодинамика. В ее основе лежат два начала (закона), полученные на основании опытных данных. I начало термодинамики – это по сути закон сохранения энергии с учетом тепловых явлений. II начало термодинамики определяет направление хода процессов. Термодинамика, как и статистическая физика, применима только к системам, состоящим из очень большого числа частиц.
|
|
|
Вопрос 2.Идеальный газ
Простейшей моделью реальных газов является идеальный газ. С макроскопической точки зрения – это газ, для которого выполняются газовые законы (pV = const, p/T = const, V/T = const). С микроскопической точки зрения – это газ, для которого можно пренебречь: 1) взаимодействием молекул между собой и 2) собственным объемом молекул газа по сравнению с объемом сосуда, в котором находится газ.
Уравнение, связывающее между собой параметры состояния, называется уравнением состояния газа. Одно из простейших уравнений состояния - это
 (
(  ;
;  ;
;  ) уравнение Менделеева – Клапейрона.
) уравнение Менделеева – Клапейрона.
 - уравнение состояния идеального газа в другой форме.
- уравнение состояния идеального газа в другой форме.
Дата добавления: 2018-04-15; просмотров: 327; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!



