Вопрос 3.Вязкость (внутреннее трение)
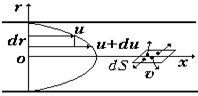 При движении газа в потоке происходит торможение одних слоев газа другими – это называется внутренним трением или вязкостью, а тормозящая сила называется силой внутреннего трения.
При движении газа в потоке происходит торможение одних слоев газа другими – это называется внутренним трением или вязкостью, а тормозящая сила называется силой внутреннего трения.
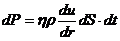 - Ур-ие переноса для импульса направл. движения.
- Ур-ие переноса для импульса направл. движения.
Это уравнение обычно не используют, а учитывая что dP/dt = F, можно получить выражение для силы внутреннего трения, которое называется. 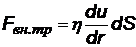 - закон Ньютона для силы внутреннего трения (Здесь:
- закон Ньютона для силы внутреннего трения (Здесь: 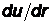 -градиент скорости, показывающий, на сколько меняется скорость направленного движения на единице длины радиального направления, h - коэффициент пропорциональности, называемый коэффициентом динамической вязкостииликоэффициентом внутреннего трения -по смыслу – он равен силе внутреннего трения, действующей на единичную площадку при единичном градиенте скорости.)
-градиент скорости, показывающий, на сколько меняется скорость направленного движения на единице длины радиального направления, h - коэффициент пропорциональности, называемый коэффициентом динамической вязкостииликоэффициентом внутреннего трения -по смыслу – он равен силе внутреннего трения, действующей на единичную площадку при единичном градиенте скорости.)
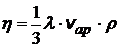 - (кг/м×с) коэффициент вязкости для идеального газа
- (кг/м×с) коэффициент вязкости для идеального газа
Вопрос 4.Теплопроводность
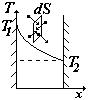 Вследствие непрерывного движения молекул, они ударяются о стенки и между собой и приобретают (или отдают) свою кинетическую энергию. Так как температура газа связана с кинетической энергией поступательного движения молекул -
Вследствие непрерывного движения молекул, они ударяются о стенки и между собой и приобретают (или отдают) свою кинетическую энергию. Так как температура газа связана с кинетической энергией поступательного движения молекул - 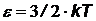 - то в результате между стенками постепенно установится некоторое распределение температуры. Процесс передачи теплоты из одного места пространства в другое за счет теплового движения молекул, называется теплопроводностью. Уравнение переноса в этом случае:
- то в результате между стенками постепенно установится некоторое распределение температуры. Процесс передачи теплоты из одного места пространства в другое за счет теплового движения молекул, называется теплопроводностью. Уравнение переноса в этом случае:
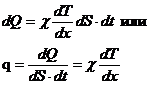
|
Уравнение теплопроводности (уравнение Фурье).
|
|
|
q (Дж/м2 с) – плотность потока теплоты
c - коэффициент теплопроводности (c-греческая буква «хи») По смыслу c - это количество теплоты, прошедшее за единицу времени через единичную площадку при единичном градиенте температуры.
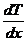 - градиент температуры – в одномерном случае, когда температура меняется только в направлении х –он показывает, на сколько изменяется температура на единице расстояния.
- градиент температуры – в одномерном случае, когда температура меняется только в направлении х –он показывает, на сколько изменяется температура на единице расстояния.
Это уравнение теплопроводности применимо для газов, жидкостей и твердых тел. Для идеального газа из молекулярно-кинетической теории можно получить выражение:
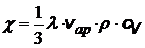
|
Коэффициент теплопроводности для идеального газа
сV - удельная теплоемкость газа при постоянном объеме
Тема 15. ОСНОВНЫЕ ПОНЯТИЯ ТЕРМОДИНАМИКИ
Вопрос 1. Основные понятия. Обратимые и необратимые процессы.
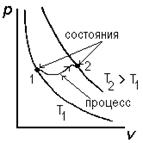 Обратимый процесс -это такой процесс перехода системы из состояния А в состояние В, при котором возможен обратный переход от В к А через те же промежуточные состояния и при этом в окружающих телах не происходит никаких изменений. Система называется изолированной, если она не обменивается энергией с окружающей средой. На графике состояния обозначаются точками, а процессы – линиями.
Обратимый процесс -это такой процесс перехода системы из состояния А в состояние В, при котором возможен обратный переход от В к А через те же промежуточные состояния и при этом в окружающих телах не происходит никаких изменений. Система называется изолированной, если она не обменивается энергией с окружающей средой. На графике состояния обозначаются точками, а процессы – линиями.
|
|
|
Величины, которые зависят только от состояния системы и не зависят от процессов, посредством которых система пришла в данное состояние, называются функциями состояния. Величины, значения которых в данном состоянии зависят от предшествующих процессов, называются функциями процессов - это теплота Q и работа A, их изменение обозначают часто как dQ, dA или 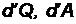 . (d - греческая буква - дельта)
. (d - греческая буква - дельта)
Работа и теплота – это две формы передачи энергии от одних тел к другим. При совершении работы меняется относительное расположение тел или частей тела. Передача энергии в виде теплоты осуществляется при контакте тел – за счет теплового движения молекул.
К внутренней энергииотносят: 1)кинетическую энергию теплового движения молекул (но не кинетическую энергию всей системы в целом), 2)потенциальную энергию взаимодействия молекул между собой, 3)кинетическую и потенциальную энергию колебательного движения атомов в молекуле, 4)энергию связи электронов с ядром в атоме, 5)энергию взаимодействия протонов и нейтронов внутри ядра атома. Эти энергии по величине очень сильно отличаются друг от друга, например, энергия теплового движения молекул при 300 К ~ 0,04 эВ, энергия связи электрона в атоме ~ 20-50 эВ, а энергия взаимодействия нуклонов в ядре ~10 МэВ. Поэтому эти взаимодействия рассматривают по отдельности.
|
|
|
Внутренняя энергия идеального газа – это кинетическая энергия теплового движения его молекул. Она зависит только от температуры газа. Ее изменение имеет одинаковое выражение для любых процессов в идеальных газах и зависит только от начальной и конечной температур газа. 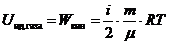 - внутренняя энергия идеального газа.
- внутренняя энергия идеального газа.
Дата добавления: 2018-04-15; просмотров: 222; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
