Тема 18.Вопрос 1.АГРЕГАТНЫЕ СОСТОЯНИЯ ВЕЩЕСТВА
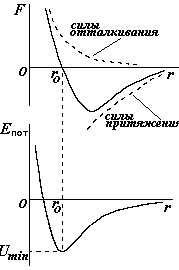 Молекулы представляют собой сложные системы электрически заряженных частиц. Основная масса молекулы и весь ее положительный заряд сосредоточены в ядрах, их размеры порядка 10-15 - 10-14 м, а размер самой молекулы, включая электронную оболочку, примерно 10-10 м. В целом молекула электрически нейтральна. Электрическое поле ее зарядов в основном сосредоточено внутри молекулы и за ее пределами резко убывает. При взаимодействии двух молекул одновременно проявляются и силы притяжения и силы отталкивания, они по-разному зависят от расстояния между молекулами (см рис.- пунктирные линии). Одновременное действие межмолекулярных сил дает зависимость силы F от расстояния r между молекулами, характерную и для двух молекул, и атомов, и ионов (сплошная кривая). На больших расстояния молекулы практически не взаимодействуют, на очень малых расстояния преобладают силы отталкивания. На расстояниях, равных нескольким диаметрам молекул действуют силы притяжения. Расстояние ro между центрами двух молекул, на котором F=0, - это положение равновесия. Так как сила связана с потенциальной энергией F=-dEпот /dr, то интегрирование даст зависимость потенциальной энергии от r (потенциальная кривая). Равновесное положение соответствует минимуму потенциальной энергии -Umin . Для различных молекул вид потенциальной кривой аналогичен, но числовые значения ro и Umin различны и определяются природой данных молекул.
Молекулы представляют собой сложные системы электрически заряженных частиц. Основная масса молекулы и весь ее положительный заряд сосредоточены в ядрах, их размеры порядка 10-15 - 10-14 м, а размер самой молекулы, включая электронную оболочку, примерно 10-10 м. В целом молекула электрически нейтральна. Электрическое поле ее зарядов в основном сосредоточено внутри молекулы и за ее пределами резко убывает. При взаимодействии двух молекул одновременно проявляются и силы притяжения и силы отталкивания, они по-разному зависят от расстояния между молекулами (см рис.- пунктирные линии). Одновременное действие межмолекулярных сил дает зависимость силы F от расстояния r между молекулами, характерную и для двух молекул, и атомов, и ионов (сплошная кривая). На больших расстояния молекулы практически не взаимодействуют, на очень малых расстояния преобладают силы отталкивания. На расстояниях, равных нескольким диаметрам молекул действуют силы притяжения. Расстояние ro между центрами двух молекул, на котором F=0, - это положение равновесия. Так как сила связана с потенциальной энергией F=-dEпот /dr, то интегрирование даст зависимость потенциальной энергии от r (потенциальная кривая). Равновесное положение соответствует минимуму потенциальной энергии -Umin . Для различных молекул вид потенциальной кривой аналогичен, но числовые значения ro и Umin различны и определяются природой данных молекул.
|
|
|
Кроме потенциальной, молекула обладает еще и кинетической энергией. Минимальная потенциальная энергия у каждого сорта молекул своя, а кинетическая энергия зависит от температуры вещества (Екин ~ кТ). В зависимости от соотношения между этими энергиями данное вещество может находиться в том или ином агрегатном состоянии. Например, вода может быть в твердом состоянии (лед), в жидком и в виде пара.
| кТ << Umin | твердое состояние | молекулы образуют кристалл и колеблются около положений равновесия |
| кТ >> Umin | газообразное состояние | тепловое движение препятствует соединению молекул |
| кТ @ Umin | жидкое состояние | молекулы непрерывно обмениваются местами, но расстояние между ними остается примерно одинаковым |
У инертных газов Umin невелики, поэтому они переходят в жидкое состояние при очень низких температурах. У металлов большие величины Umin поэтому они находятся в твердом состоянии вплоть до температуры плавления – это могут быть сотни и тысячи градусов.
Тема 17.Вопрос 1. РЕАЛЬНЫЕ ГАЗЫ
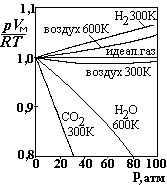
 На рис. представлены кривые для различных газов, показывающие степень отклонения их от идеальности. По вертикальной оси отложена безразмерная величина, pVM/RT, где VM - молярный объем, по горизонтали – давление. При низких давлениях газы можно считать идеальными с достаточной степенью точности. При высоких давлениях наблюдается значительное отклонение от идеальности. Ван-дер-Ваальс (1873 г) внес поправки к уравнению состояния идеального газа, учитывающие взаимодействие молекул между собой и собственный объем молекул, и предложил новое уравнение состояния. Уравнение Ван-дер-Ваальса далеко не всегда выполняется для реальных газов, но оно ценно тем, что по измеренным величинам p, V, T можно оценить размер молекул и силу их взаимодействия.
На рис. представлены кривые для различных газов, показывающие степень отклонения их от идеальности. По вертикальной оси отложена безразмерная величина, pVM/RT, где VM - молярный объем, по горизонтали – давление. При низких давлениях газы можно считать идеальными с достаточной степенью точности. При высоких давлениях наблюдается значительное отклонение от идеальности. Ван-дер-Ваальс (1873 г) внес поправки к уравнению состояния идеального газа, учитывающие взаимодействие молекул между собой и собственный объем молекул, и предложил новое уравнение состояния. Уравнение Ван-дер-Ваальса далеко не всегда выполняется для реальных газов, но оно ценно тем, что по измеренным величинам p, V, T можно оценить размер молекул и силу их взаимодействия.
|
|
|
В настоящее время в качестве уравнения состояния чаще всего используется уравнение, называемое вириальным разложением.
Коэффициенты B,C,D,…- вириальные коэффициенты.
Вопрос 2.состояние реальных газов. уравнение Ван-дер-Ваальса
Из вириального уравнения с одним коэффициентом В можно получить уравнение Ван-дер-Ваальса.
|
| уравнение Ван-дер-Ваальса
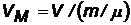 (1/м3) - молярный объем (1/м3) - молярный объем
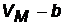 называют кинетическим объемом, это объем, доступный для перемещения молекул называют кинетическим объемом, это объем, доступный для перемещения молекул
| |||

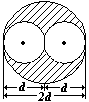
| Поправка на собственный объем молекул. Заштрихованный объем – объем недоступности– он в 4 раза больше объема молекулы («1/2», так как нельзя учитывать
одну и ту же молекулу дважды), d- диаметр молекулы,
| |||
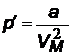
| Поправка к давлению, учитывающая взаимодействие молекул между собой. р¢ называют собственным давлением молекул. Молекулы реального газа из-за взаимодействия как бы сами себя сжимают. | |||

| При такой записи уравнения Ван-дер-Ваальса видно, что давление на стенки в случае реального газа меньше, чем для идеального. Число ударов о стенку пропорционально концентрации молекул в сосуде n. При ударе одной молекулы на нее действует притяжение всех остальных молекул, ослабляя удар. Следовательно, давление ослабляется пропорционально n2 = (N/V)2~ 1/V2 . | |||
Дата добавления: 2018-04-15; просмотров: 212; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

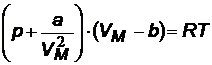
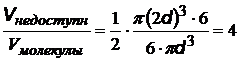 NАв - число Авогадро
NАв - число Авогадро