Решение задач по теме «Окислительно-восстановительные реакции»
Ионные реакции, сопровождающиеся изменением степени окисления атомов в молекулах реагирующих веществ, называются окислительно-восстановительными реакциями. Типичный процесс окисления-восстановления наглядно можно наблюдать в следующем эксперименте.
Если слить подкисленные эквимолярные растворы перманганата калия, имеющего красно-фиолетовую окраску, и нитрита натрия, то через некоторое время реакционная смесь обесцвечивается. Качественный анализ образовавшейся смеси показывает, что в ней содержится ничтожно мало ионов NO2- и МпО4- и значительное количество ионов NO3- и Mn2+ . Очевидно, произошло превращение
NO2- , МпО4- ® NO3- , Mn2+.
В отдельности растворенные перманганат калия и нитрит натрия могут храниться долгое время без изменения, следовательно, наблюдаемая реакция обусловлена двумя взаимосвязанными переходами, в результате которых изменяется степень окисления (валентное состояние) азота и марганца:
NO2- ® NO3- ; МпО4- ® Mn2+.
Первый переход представляет собой реакцию окисления, второй—реакцию восстановления.
Для составления уравнения окислительно-восстановительной реакции, протекающей в водном растворе, удобно использовать метод электронно-ионного баланса. Этот метод рассмотрен ниже на примере составления уравнения реакции между перманганатом калия и нитритом калия в водном растворе.
Сначала составляют уравнение реакций окисления и восстановления. В схеме процесса окисления число атомов азота, входящих в ионы нитрита и нитрата, одно и то же, число атомов кислорода разное. Для уравнивания числа атомов кислорода в левую часть схемы этого перехода записывают молекулу воды (или ионы ОН- для щелочной среды):
|
|
|
NO2- + Н2О ® NO3-
Число атомов N и О в обеих частях этой схемы одинаково, а атомы водорода указаны только в левой части. Для уравнивания числа атомов водорода справа в схему приписывают недостающее их число в виде ионов водорода:
NO2- + Н2О ® NO3- +2Н+.
В данной записи не выполняется равенство суммарных зарядов:
сумма зарядов слева (—1) не равна сумме зарядов справа (+1). С учетом правила сохранения зарядов ионное уравнение этого процесса должно быть записано так:
NO2- + Н2О- 2е- = NO3- +2Н+.
Аналогичные операции проводят при составлении ионного уравнения перехода перманганат-иона в двухвалентный ион марганца:
MnO4- ® Mn2+ + 4H2O,
MnO4- + 8H+® Mn2+ + 4H2O
MnO4- + 8H+ + 5e- = Mn2+ + 4H2O
Разумеется, при составлении уравнений реакции их не следует переписывать несколько раз, а нужно последовательно дополнять недостающими ионами и молекулами и расставлять стехиометрические коэффициенты.
Таким образом получают уравнения двух процессов, одновременно протекающих в растворе:
|
|
|
NO2- + Н2О- 2е- = NO3- +2Н+.
MnO4- + 8H+ + 5e- = Mn2+ + 4H2O
В первой реакции происходит присоединение электронов, это реакция восстановления, а ион MnO4- - окислитель. Во второй реакции происходит отдача электронов, это реакция окисления, а ион NО2- - восстановитель.
В общем уравнении окислительно-восстановительного процесса число принятых окислителем электронов должно равняться числу электронов, отданных восстановителем, поэтому умножают стехиометрические коэффициенты первого уравнения на 2, а второго — на 5 (чтобы получить наименьшее одинаковое число принятых и отданных электронов) и суммируют оба выражения:
5NO2- + 5Н2О- 10е- = 5NO3- +10Н+.
2MnO4- + 16H+ + 10e- = 2Mn2+ + 8H2O
5NO2- + 2MnO4- + 6H+ = 5NO3- +2Mn2+ + 3H2O .
В левой части уравнения находятся ионы водорода, что говорит о необходимости проведения реакции в кислой среде. Если растворы были подкислены серной кислотой, то процесс описывается следующим молекулярным уравнением:
5KNО2 + 2КМпО4 + 3H2SО4 = 5КNO3 + 2MnSO4 + K2SO4 + 3H2О.
При составлении молекулярного уравнения требуется уравнять число катионов, входящих в состав солей.
Метод электронно-ионного баланса используется в основном для подбора стехиометрических коэффициентов в уравнениях окислительно-восстановительных реакций, протекающих в водных растворах. Этот метод имеет то преимущество, что при его применении необязательно знать степени окисления атомов, участвующих в реакции ионов.
|
|
|
Коэффициенты в уравнениях реакций, проходящих в газовом или кристаллическом состоянии, а также в водных растворах, можно подбирать методом электронного баланса. Разберем этот метод на примере составления уравнения реакции разложения хлората калия. Этот процесс протекает по схеме:
КСlO3 —КСl+KC1O4.
В результате этого процесса хлор в состоянии С15+ (в КСlO3) Переходит в Cl- (в КС1) и Cl7+ (в КС1O4). Для нахождения стехиометрических коэффициентов подбирают множители, уравнивающие число отданных и принятых электронов:
Cl 5+ +6е = Cl- 1
Cl5+ - 2e = Cl7+ 3
4Cl5+ =Cl- +3Cl7+
Следовательно, молекулярное уравнение окислительно-восстановительного процесса разложения хлората калия следует записать так:
4КСlO3 = КС1 + ЗКСlO4.
УГЛЕВОДОРОДЫ
Углеводородами называются соединения, состоящие из углерода и водорода. Углеводороды делятся на предельные и непредельные; предельные содержат только простые или ординарные связи между атомами углерода, непредельные содержат также и кратные связи – двойные или тройные. Любая простая связь атома углерода с другим атомом (в том числе и атомом углерода) является δ-связью; для нее характерно перекрывание электронных орбиталей вдоль линии, соединяющей центры взаимодействующих атомов. В образовании δ-связи со стороны атома углерода всегда участвует гибридная sp3-, sp2- или sp-орбиталь. Одна из кратных связей углеродного атома в различных соединениях также является δ-связью, другие связи образованы не гибридными, а р-орбиталями и называются π-связями. π-Связи образуются за счет перекрывания р-орбиталей по обе стороны линии, соединяющей центры атомов; они менее прочны, чем δ-связи, и более подвижны:
|
|
|
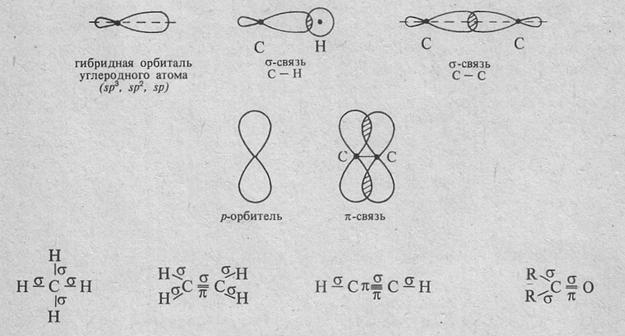
π-Связь в этилене расположена в плоскости, перпендикулярной плоскости расположения δ-связей. В ацетилене имеющиеся две π-связи расположены в двух взаимно перпендикулярных плоскостях:
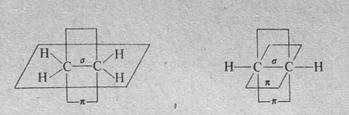
Общая формула предельных углеводородов (алканов, парафинов) СnН2n+2 Они образуют гомологический ряд, который часто называют рядом метана. Он является основой, из которой выводятся все остальные классы органических соединений.
При отнятии одного атома водорода от алкана получается радикал, называемый алкилом и обозначаемый R или Alk, который имеет общую формулу СnН2n+1. Для алканов характерен суффикс-ан, для радикалов – -ил.
Алканы Алкилы
СН4 метан метил СН3—
С2Н6 этан этил С2Н5 —
СзН8 пропан пропил С3Н7 —
С4Н10 бутан бутил С4Н9 —
С5Н12 пентан пентил (амил) С5Н11 —
С6Н14 гексан гексил С6Н13 —
С7Н16 гептан гептил С7Н15—
C8H18 октан октилС8Н17 —
С9Н20 нонан нонил С9Н19—
С10Н22 декан децил С10Н21 —
C11H24 ундекан ундецил С11Н23 —
С12Н26 додекан додецил С12Н25
Автор программы Черемнова Т.В.
Доцент кафедры биологии и методики преподавания биологии
Дата добавления: 2018-04-05; просмотров: 590; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
