Примеры решения задач по теме «Кинетика»
Пример 1.Определить скорость прямой элементарной газовой реакции в начальный момент времени и через некоторое время при изменении концентрации реагентов.
2SO2 + O2 = 2SO3, если [SO2]= 5 моль/л, [O2]= 3 моль/л, k = 6 . Изменение концентрации О2 на 1 моль/л.
Решение: В начальный момент времени скорость прямой реакции была равна:
v = kC2 SO2 CO2 = 6*52*3 = 450 моль/л с
Найдем концентрацию исходных веществ через какое-то время, когда концентрация кислорода изменилась на 1 моль/л, тогда [O2] = 3 - 1 = 2 моль/л. С изменением кислорода меняется концентрация и [SO2] соответственно, составляем пропорцию :
1 моль - на 1 моль/л
2 моля - на х моль/л
тогда 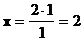 моль/л, следовательно [SO2]= 5 - 2 = 3 моль/л.
моль/л, следовательно [SO2]= 5 - 2 = 3 моль/л.
Тогда скорость по истечении времени станет равна:
v = kC2 SO2 CO2 = 6*32*2 = 108 моль/л с.
Пример 2. Константа равновесия гомогенной системы :
СО(г) + Н2О (г) = СО2 (г) + Н2 (г)
при 8500С равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: [СО]исх=3 моль/л, [Н2О]исх=2 моль/л.
Решение. При равновесии скорости прямой и обратной реакции равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:
vпр= k1 [CO][H2O] ; v = k2[CO2][H2];

В условии задачи даны исходные концентрации, тогда как в выражение КС входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрации [CO2]= х моль/л. Согласно уравнению системы число молей образовавшегося водорода при этом будет также х моль/л. По стольку же молей (х моль/л) СО и Н2О расходуется для образования по х молей СО2 и Н2. Следовательно, равновесные концентрации всех четырех веществ
|
|
|
[CO2]= [H2] =х моль\л ; [CO]= (3 - х) моль/л; [H2O]= (2 - х) моль/л.
Зная константу равновесия, находим значение х, а затем исходные концентрации всех веществ:  ; х2=6-2х-3х+х2; 5х=6; х=1,2 моль/л.
; х2=6-2х-3х+х2; 5х=6; х=1,2 моль/л.
Таким образом, искомые равновесные концентрации:
[CO]=3-1,2=1,8 моль/л; [H2O]=2-1,2= 0,8 моль/л ; [CO2]=1,2 моль/л; [H2]=1,2 моль/л.
Пример 3. Эндотермическая реакция разложения пентохлорида фосфора протекает по уравнению: PCl5(г)«PCl3(г)+Cl2(г) ; DH= +92,59 кДж
Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции - разложения PCl5?
Решение. Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление в котором сместилось равновесие, определяется по принципу Ле Шателье: а) так как реакция разложения PCl5 эндотермическая (DH= +92,59), то для смещения равновесия в сторону прямой реакции нужно повысить температуру; б) так как в данной системе разложение PCl5 ведет к увеличению объема (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещения равновесия в указанном направлении можно достигнуть как увеличением концентрации PCl5, так и уменьшением концентрации PCl3 или Cl2.
|
|
|
Дата добавления: 2018-04-05; просмотров: 365; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
