Содержание текущего и итогового контроля
Текущий контроль.
Формы контроля:: контрольные работы, самостоятельные работы, коллоквиумы.
Содержание контрольных мероприятий:
Вопросы для практических занятий
Занятие 1.Основные химические понятия и законы химии.
1.Дать определение следующим понятиям: атом, простое вещество, сложное вещество, абсолютная атомная масса, относительная атомная масса, атомная единица массы, относительная молекулярная масса, количество вещества, молярная масса, химическая формула, эквивалент, молярная масса эквивалентов.
2.Сформулировать основные законы химии: закон сохранения массы веществ, закон постоянства состава, закон кратных отношений, закон объёмных отношений, закон Авогадро и следствия из него.
3.Решить следующие задачи
1. Рассчитайте количество вещества: а) азота массой 14 г; б) кислорода массой 48 г.
2.Определите массу: а) 0,1 моль NaOH ; б) 2 моль HCl; в) 1 моль H2SO4.
3.Сколько молекул содержится: а) в NaCl массой 5,85 кг; б) в CuO массой 0,8 т; в) в Na2CO3 массой 106 кг.
4.Вычислить объем занимаемый при нормальных условиях : а) 11 г CO2, б) 4 г СН4; в) 71 г Cl2 ; г) 8 г О2.
5.Чему равна масса газов объемом 1 м3 при нормальных условиях: а) N2 ; б) Не; в) SO2.
6.Какую массу имеют: а) 2 моль атомарного кислорода; б) 3 моль атомарного водорода; в) 0,01 моль атомарного хлора.
7.Сравните число атомов, содержащихся в хлоре и азоте массой по 10 г. В каком случае и во сколько раз число атомов больше?
Занятие 2 Простейшие стехиометрические расчеты. Расчеты по химическим формулам, расчеты по химическим уравнениям.
|
|
|
Решить задачи:
1. Металл массой 0,864 г образовал хлорид массой 1,148 г. Определите эквивалентную массу металла.
2.Всегда ли постоянна эквивалентная масса соединения? Приведите примеры.
3.Вычислить массовые доли элементов в серной кислоте?
4.Какую реакцию на лакмус будет показывать раствор, содержащий 30 г азотной кислоты, после добавления к нему гидроксида калия массой 20 г? Какова масса образующейся соли?
5.Какую массу железа можно получить из 2 т железной руды, содержащей 94% (масс) Fe2 O3?
6.Вычислить объём гремучего газа (нормальные условия), образовавшегося при разложении 2 моль воды электрическим током.
7.Какой объём воздуха потребуется для сжигания 1 м3 газа, имеющего следующий состав (по объему) 50% СH4 и 50%C2 H6 ?
8.Укажите какие из указанных газов легче воздуха: СH4, C2 H6 , NO, SO2 , H 2O.
9.Давление в автомобильной шине при 27 0С равно 2*105 Па. Как изменится давление, если температура понизилась до –23 0С?
10.Какой объём ацетилена (условия нормальные) можно получить из при взаимодействии воды с 0,8 кг карбида кальция (CaC2)?
Занятие 3.Строение атома, периодический закон и периодическая система Д.И. Менделеева
|
|
|
1. Современные представления о строении атома. Квантово-механическая модель строения атома.
2.Квантовые числа, принципы заполнения электронных орбиталей, электронные формулы.
3.Формулировка периодического закона. Структура периодической системы, физический смысл порядкового номера элементов. Связь между электронным строением атомов и положением элементов в периодической системе.
4.Периодически изменяющиеся свойства элементов (эффективные радиусы, энергия ионизации, сродство к электрону, электроотрицательность). Непериодически изменяющиеся свойства элементов (удельная теплоемкость простых веществ, частота линий рентгеновского спектра).
5.Выполнить упражнения:
1.Напишите электронные формулы атомов элементов с порядковыми номерами 9 и 28. Распределите электроны этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов? Дайте характеристику указанным элементам.
2.Какие орбитали атома заполняют электронами раньше: 4s или 3d; 5s или 4p? Почему?
Занятие 4. Химическая связь.
1.Определение химической связи
2.Основные виды (ионная, ковалентная, металлическая, водородная) и характеристики химической связи (энергия и длина связи, валентный угол).
|
|
|
3.Ковалентная связь (определение, направленность, насыщаемость, полярность, мера полярности связи, электрический момент диполя, поляризуемость). Метод валентных связей и пространственная структура молекул.
4.Выполнить упражнения:
1.Укажите тип гибридизации электронных орбиталей центрального атома и форму молекул: BF3 , BeCl2 , CF4
2.К каким типам связей (σ- или π-, полярной или неполярной) относятся связи между атомами в указанных молекулах: Br2 ,CO ,BeCl2. ?
3.Полярны или неполярны молекулы: Br2 ,CO, BeCl2, CCl4, MgO, CO2 ?
Занятие 5. Классы неорганических соединений. Классификация неорганических веществ, оксиды, пероксиды, кислоты, основания и соли
1.Классификация неорганических веществ.
2.Номенклатура и классификация оксидов
3.Номенклатура и классификация оснований.
4. Номенклатура и классификация кислот.
5.Номенклатура и классификация солей
6.Важнейшие химические свойства оксидов, оснований, кислот и солей.
7.Выполните упражнения:
1.Назовите кислоты: HBO2; H3BO3; H2MnO4; HMnO4.
2.Напишите формулы кислот: а) хромовой,
б) метахромистой, в) ортофосфорной.
3.Дайте названия ионам: SO42-, S2O72-, PO43-, PbO22-.
|
|
|
4.Назовите соли: Na3AsO4, NaAsO3, NaHCrO4, (CrOH)3(PO4)2.
5.Напишите эмпирические и структурные формулы солей:
а) сульфата железа (III), б) дигидрофосфата калия,
в) сульфата цезия-алюминия.
6.Возможно ли получить Al(OH)3 согласно следующим уравнениям реакций:
Al2O3 + H2O →
Al2(SO4)3 + NaOH →
AlCl3 + H2O →
Al(NO3)3 + 3NaOH →
7.Осуществите следующий цикл превращений:
MgSO4 → Mg(OH)2 → MgO → MgCl2 → MgCO3 → Mg(HCO3)2
Занятие 6.Энергетика химических процессов.
1.Основные понятия (термодинамическая система, фаза, параметры состояния системы, функции состояния, уравнения состояния; процессы изотермические, изобарные, изохорные, самопроизвольные и несамопроизвольные, обратимые и необратимые).
2.Первое начало термодинамики
3.Термохимия. Закон Гесса и следствие из него. Энтальпия. Стандартная энтальпия образования.
4.Второе начало термодинамики. Энтропия. Изменение энтропии при фазовых превращениях и химических реакциях.
5.Энергия Гиббса. Критерий самопроизвольного протекания процессов.
6.Решите задачи:
1. Газообразный этиловый спирт C2H5OH можно получить при взаимодействии этилена С2Н4(Г) и водяных паров. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект.
2. Теплоты образования 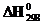 оксида (II) и оксида (IV) азота соответственно равны +90,37 кДж и +33,85 кДж. Определите
оксида (II) и оксида (IV) азота соответственно равны +90,37 кДж и +33,85 кДж. Определите 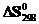 и
и 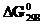 для реакций получения NO и NO2 из простых веществ. Можно ли получить эти оксиды при стандартных условиях? Какой из оксидов образуется при высокой температуре? Почему?
для реакций получения NO и NO2 из простых веществ. Можно ли получить эти оксиды при стандартных условиях? Какой из оксидов образуется при высокой температуре? Почему?
3.При какой температуре наступит равновесие системы 4HCl(г)+O2(г)«2H2O(г)+2Cl2(г); DН= -114,42 кДж? Хлор или кислород в этой системе является более сильным окислителем и при каких температурах?
4.Восстановление Fe3O4 оксидом углерода идет по уравнению Fe3O4(к)+CO(г)=3FeO(к)+CO2(г). Вычислите 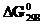 и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях. Чему равно
и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях. Чему равно 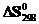 в этом процессе?
в этом процессе?
5.Реакция горения ацетилена идет по уравнению C2H2(г)+5/2O2(г)=2CO2(г)+H2O(ж) . Вычислите 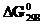 и
и 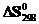 . Объясните уменьшение энтропии в результате этой реакции.
. Объясните уменьшение энтропии в результате этой реакции.
6.Прямая или обратная реакция будет протекать при стандартных условиях в системе 2NO(г)+O2(г)«2NO2(г) Ответ мотивируйте, вычислив 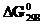 прямой реакции.
прямой реакции.
Занятие 7. Химическое равновесие в гомогенных и гетерогенных системах. Фазовое равновесие. Адсорбционное равновесие.
1.Условие химического равновесия. Константа химического равновесия для гомогенных систем.
2.Смещение химического равновесия. Принцип Ле Шателье.
3.Равновесия в гетерогенных системах.
4.Фазовое равновесие. Правило фаз. Фазовые диаграммы для однокомпонентных систем на примере фазовой диаграммы воды. Диаграммы плавкости.
5.Адсорбционное равновесие. Поверхностная энергия. Адсорбция.
6.Изотерма адсорбции. Поверхностно-активные вещества.
7.Адсорбция на границе раздела твердое тело-газ, адсорбция на границе раздела фаз твердое тело- жидкость.
8.Применение адсорбции. Хроматография.
Занятие 8. Химическая кинетика. Механизмы химических реакций
1.Скорость химической реакции.
2.Зависимость скорости реакции от концентрации реагентов. Порядок и молекулярность химической реакции.
3.Особенность кинетики гетерогенных реакций.
4.Влияние температуры на скорость реакций. Правило Вант-Гоффа. Уравнение Аррениуса.
5.Катализ. Основные понятия. Гомогенный катализ. Гетерогенный катализ. Ферментативный катализ.
5.Механизмы химических реакций. Одностадийные реакции. Сложные реакции. Цепные реакции.
6.Фотохимические реакции. Фотохимические реакции в нижних слоях атмосферы.
7.Решить задачи:
1. Окисление серы и ее диоксида протекает по уравнениях: а) S(К)+O2(Г)=SO2(Г) ; б) 2SO2(Г)+O2(Г)=2SO3(Г). Как изменятся скорости этих реакций, если объемы каждой из систем уменьшить в четыре раза?
2.Напишите выражение для константы равновесия гомогенной системы N2+3H2«2NH3. Как изменится скорость прямой реакции - образования аммиака, если увеличить концентрацию водорода в три раза?
3.Реакция идет по уравнению N2+O2=2NO. Концентрации исходных веществ до начала реакции были [N2]=0,049 моль/л, [O2]=0,01моль/л. Вычислите концентрацию этих веществ в момент когда [NO]=0,005 моль/л.
4.Реакция идет по уравнению N2+3Н2=2NН3. Концентрации участвующих в ней веществ были [N2]=0,80 моль/л , [Н2]=1,5 моль/л , [NН3]=0,10 моль/л . Вычислите концентрацию водорода и аммиака , когда [N2]=0,5 моль/л.
5.Реакция идет по уравнению H2+I2= 2HI. Константа скорости этой реакции при 5080С равна 0,16. Исходные концентрации реагирующих веществ [Н2]=0,04 моль/л , [I2]=0,05 моль/л. Вычислите начальную скорость реакции и скорость ее, когда [Н2]=0,03 моль/л.
6.Вычислите во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру от 120 до 800С. Температурный коэффициент скорости реакции 3.
Занятие 9. Дисперсные системы. Коллоидные растворы.
1.Общие понятия о дисперсных системах и их классификация.
2.Коллоидные растворы. Строение мицеллы гидрофобного золя.
3.Методы получения коллоидных растворов.
4.Оптические свойства коллоидных растворов (эффект Фарадея-Тиндаля, опалесценция).
5.Кинетические свойства коллоидных растворов. (броуновское движение).
6.Электрические свойства коллоидных растворов (электроосмос и электрофорез).
7.Кинетическая и агрегативная устойчивость коллоидных растворов. Коагуляция коллоидов.
8.Коллоидные растворы в природе и технике.
9.Напишите формулу мицеллы золя хлорида серебра, полученной при взаимодействии нитрата серебра с избытком хлорида натрия.
10.Напишите формулу мицеллы золя сульфата бария, полученной при взаимодействии серной кислоты с избытком хлорида бария.
Занятие 10. Общие свойства растворов. Способы выражения концентрации растворов. Решение задач.
1.Основные понятия (растворитель и растворенное вещество, растворимость, кривые растворимости, насыщенные, ненасыщенные и пересыщенные растворы, растворы разбавленные и концентрированные)
2.Способы выражения концентрации растворов (массовая доля, молярная концентрация, молярная концентрация эквивалента, моляльность, молярная доля, титр.)
3.Общие свойства растворов (понижение давления насыщенного пара растворителя, понижение температуры замерзания и повышение температуры кипения, осмотическое давление, экстракция и распределение вещества между двумя несмешивающимися жидкостями).
4.Решить задачи:
1. Для подкормки растений потребовался раствор калийной селитры массой 150 кг с массовой долей селитры 0,5%. Какие массы воды и соли для этого понадобятся?
2. В 1 кг воды растворено 666 г КОН; плотность раствора равна 1,395 г/мл. Найти: а) массовую долю КОН; б) молярность; в) моляльность.
3.Какой объём воды надо прибавить к 100мл 20% (по массе) раствора H 2SO4 (ρ = 1,14 г/мл), чтобы получить 5%-ный раствор?
4.Чему равна нормальность 30%-ного раствора NaOH плотность которого 1,328 г/см3?
5.К 1 л раствора прибавили 5 л воды. Вычислите процентную концентрацию полученного раствора.
6.К 3 л 10%-ного раствора HNO3, плотность которого1,054 г/см3, прибавили 5 л 2%-ного раствора той же кислоты плотностью 1,009 г/см3. Вычислите процентную и молярную концентрации полученного раствора, если считать, что его объем равен 8 л.
Занятия 11,12. Свойства водных растворов неэлектролитов. Теория электролитической диссоциации.
Решить задачи
1.Чему равно осмотическое давление 0,5 М раствора глюкозы С6Н12О6 при 250С?
2.В радиатор автомобиля налили 9 л. воды и прибавили 2 л. метилового спирта СН3ОН (ρ=0,8 г/мл). При какой самой низкой температуре можно после этого оставлять автомобиль на открытом воздухе, не опасаясь, что вода в радиаторе замерзнет? Ккр (Н2О)=1,86.
3.При какой температуре будет кипеть 50%-ый (по массе) раствор сахарозы С12Н22О11? Кэб (Н2О)=0,52.
4.Вычислите процентную концентрацию водного раствора сахара С12Н22О11, зная температуру кристаллизации раствора (-0,930С). Криоскопическая константа воды 1,86 град.
5.Вычислите температуру кристаллизации раствора мочевины (NH2)2CO, содержащего 5 г мочевины в 150 г воды. Криоскопическая константа воды 1,86 град.
6.Раствор содержит 3,04 г камфары С10Н16О в 100 г бензола, кипит при 80,7140С. Температура кипения бензола 80,20С. Вычислите эбуллиоскопическую константу бензола.
7.Вычислите процентную концентрацию водного раствора глицерина С3Н5(ОН)3 зная, что этот раствор кипит при 100,390С. Эбуллиоскопическая константа воды 0,52 град.
8.Вычислите мольную массу неэлектролита, зная что раствор, содержащий 2,25 г этого вещества в 250 г воды, кристаллизуется при -0,2790С. Криоскопическая константа воды 1,86 град.
9.Вычислите температуру кристаллизации 2%- ного раствора этилового спирта С2Н5ОН, зная, что криоскопическая константа воды 1,86 град.
10.Что понимается под электролитической диссоциацией веществ в растворах? Какие вещества относят к электролитам и неэлектролитам? Какие электролиты относятся к слабым, а какие к сильным? Напишите выражение константы диссоциации для уксусной кислоты.
11. Дайте определение: активность ионов в растворе, коэффициент активности, ионная сила раствора.
12. Из данных формул укажите формулы электролитов: С6Н6, С2Н5ОН, Fe2O3, CuCl2, FeSO4, NaOH, CH3COOH, CuO, H2SO4, HCl.
13.Что называется ионным произведением воды? Чему равна концентрация ионов водорода и гидроксид-ионов в кислой, нейтральной и щелочной среде.
14. Вычислить концентрацию ионов ОН¯, если концентрации ионов Н+ (моль/л) равны 1) 10-7; 2) 2·10-3.
15.Вычислить рН раствора Н2SO4, концентрация которой 0,00025 моль/л.
16.Вычислить рН раствора NaOH, концентрация которого 0,00025 моль/л.
17.Какие растворы относятся к буферным растворам?
18.Особенности реакций в растворах электролитов. Произведение растворимости.
19.Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малорастворимых осадков или газов: а) Pb(NO3) + KI; б)NiCl2 + H2 S; в)K2CO3 + HCl г) CuSO4 + NaOH
20.Смешивают попарно растворы: а) NaOH и KCl; б) К2SО3 и НСl; в) CuCl2 и Ca(OH)2; г) HCOONa и H2SO4; д) H2SO4 и НCl. В каких из приведенных случаев реакции практически пойдут до конца? Составьте для этих реакций молекулярные и молекулярно-ионные уравнения.
21.Гидролиз солей. Какие из солей подвергаются гидролизу: а) NaCN; б) K2CO3; в) Zn(NO3)2; г) CuSO4; д) KNO3? Напишите возможные молекулярные и ионно-молекулярные уравнения гидролиза. Укажите, какое значение рН (>7<) имеют растворы этих солей.
Занятие 13. Окислительно-восстановительные реакции Электродный потенциал. Гальванический элемент. Аккумуляторы
Ответить на вопросы
1.Какие реакции называются окислительно-восстановительными? Приведите примеры.
2.Дайте определение следующим понятиям: процесс окисления и процесс восстановления; окислитель и восстановитель.
3.По каким признакам можно отнести то или иное вещество только к окислителям, только к восстановителям или к веществам, проявляющим двойственность свойств?
4.Дайте определение: электродный потенциал, стандартный электродный потенциал, водородный электрод, ряд напряжений металлов, гальванический элемент, электродвижущая сила элемента, аккумулятор.
5.Рассказать об устройстве и принципе действия свинцового и железно-никелевого аккумуляторов, сухого элемента (электрической батарейки)
. 6.Выполнить упражнения:
1. Реакции выражаются схемами:
P + HIO3 + H2O ® H3PO4 + HI
H2S + Cl2 + H2O ® H2SO4 + HCl
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите какое вещество является окислителем, какое - восстановителем; какое вещество окисляется, какое - восстанавливается. Чему равна эквивалентная масса фосфора?
2.Какие из указанных ниже процессов можно осуществить газообразным хлором как окислителем: а)Cr →Cr3+ б) Cr →Cr2O7 в)Fe2+ → Fe3+ г) Br →HBrO
3.Составьте схему работы гальванического элемента, образованного железом и свинцом, погруженными в 0,005 M растворы их солей. Напишите анодный и катодный процессы, токообразующую реакцию. Рассчитайте ЭДС этого элемента и изменение величины энергии Гиббса.
4.Вычислите ЭДС и изменение величины энергии Гиббса для гальванического элемента, образованного магнием и цинком, погруженными в растворы их солей с концентрациями ионов (моль/л): СMg2+ = 10–4, СZn2+ = 10–2. Сравните с ЭДС гальванического элемента, образованного стандартными электродами тех же металлов.
5.Какие процессы происходят у электродов медного концентрационного гальванического элемента, если у одного из электродов СCu2+ = 1 моль/л, а у другого – 10–3 моль/л? В каком направлении движутся электроны во внешней цепи? Ответ дайте, исходя из величины ЭДС и G.
6.Рассчитайте ЭДС гальванического элемента, образованного никелем, погруженным в раствор его соли с концентрацией ионов Ni2+ 10–4 моль/л, и серебром, погруженным в раствор его соли, равна 1,108 В. Определите концентрацию ионов Ag+ в растворе его соли.
7.Гальваническая цепь составлена железом, погруженным в раствор его соли с концентрацией ионов Fe2+, равной 0,001 моль/л, и медью, погруженной в раствор её соли. Какой концентрации должен быть раствор соли меди, чтобы ЭДС цепи стала равной нулю?
8.Какой гальванический элемент называется концентрационным? Составьте схему, напишите электронных уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из серебряных электродов, опущенных: первый в 0,01 н., а второй в 0,1 н. Растворы АgNО3. Вычислите изменение величины энергии Гиббса.
Занятие 14,15. Электролиз. Получение гальванопокрытий.Коррозия металлов. Классификация, механизм электрохимической коррозии. Защита металлов от коррозии.
1.Какой процесс называется электролизом? Анодное окисление и катодное восстановление. Применение электролиза.
2. Законы Фарадея. Основы гальванических методов нанесения металлических покрытий.
3.Коррозия металлов. Основные виды коррозии. Классификация коррозийных процессов.
4.Электрохимическая коррозия металлов. Механизм электрохимической коррозии.
5.Методы защиты металлов от коррозии: легирование металлов, защитные покрытия, электрохимическая защита, изменение свойств коррозионной среды, рациональное конструирование
6.Решить задачи:
1.Какой объем водорода (н.у.) выделится при пропускании электрического тока силой 2А в течение 42 мин через раствор серной кислоты? Напишите соответствующие уравнения реакций.
2. Электролиз раствора К2SО4 проводили при силе тока 5 A в течение 3 ч. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса воды при этом разложилась и чему равен объем газов (н.у.), выделившихся на катоде и аноде?
3. Какой силы ток должен быть использован для того, чтобы выделить из раствора AgNO3 серебро массой 108 г за 6 мин? Составьте схему электролиза этого раствора при использовании графитовых электродов.
4..Поясните, почему при никелировании железных деталей их предварительно покрывают медью, а потом – никелем. Составьте электронные схемы процессов при коррозии никелированной детали, если слой никеля поврежден.
5. Как протекает коррозия в случае повреждения поверхностного слоя оцинкованного и никелированного железа при их контакте с водой? Напишите соответствующие уравнения реакций, поясните ответ рисунком. Определите, в каком случае коррозия протекает быстрее, ответ подтвердите расчетом.
6. Как протекает коррозия в случае повреждения поверхностного слоя оцинкованного и никелированного железа при их контакте с водой? Напишите соответствующие уравнения реакций. Определите, в каком случае коррозия протекает быстрее, ответ подтвердите расчетом.
7. Две железные пластинки, частично покрытые одна оловом, другая медью, находятся во влажном воздухе. Составьте электронные уравнения водного и катодного процессов коррозии этих пластинок. Каков состав продуктов коррозии железа? На какой из этих пластинок быстрее образуется ржавчина? Почему? Ответ подтвердите расчетом.
Занятие 16,17. Особенности, теория химического строения и классификация органических соединений. Углеводороды.
Ответьте на вопросы:
1.Что является объектом исследования органической химии? Чем органические вещества отличаются от неорганических?
2.Назовите основные положения теории химического строения А.М. Бутлерова. Дайте определения следующим понятиям: изомеры, изомерия, гомологи, гомологический ряд, приведите примеры.
3.Приведите классификацию углеводородов.
4.Приведите правила систематической номенклатуры IUPAC для углеводородов. Напишите формулу углеводорода, которому соответствует следующее название: 3,3,5,5-тетераметилгептин-1.
5.Перечислите функциональные группы в порядке увеличения старшинства и соответствующие им классы соединений.
6.Выведите структурные формулы всех возможных изомеров гексана и назовите их по международной и рациональной номенклатуре.
7. Выведите структурные формулы возможных этиленовых углеводородов С4Н8 и назовите их по международной и рациональной номенклатуре.
8. Выведите структурные формулы всех возможных углеводородов С4Н6 (ацетиленовых и диеновых) и назовите их по международной номенклатуре, а ацетиленовые также и по рациональной номенклатуре.
9. Напишите структурные формулы следующих.углеводородов:
а) диметилбутилметан; б) 2-метил-3-этилгексан; в) изопропилэтилен; г) 2-метилбутен-2; д) изобутилацетилен; е) 3-этилпентин-1; ж) дивинил; з) винилацетилен.
10. Назовите по международной номенклатуре:
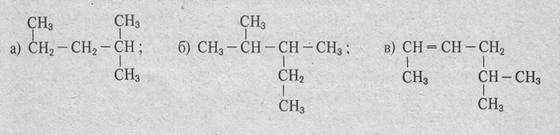
11. Напишите формулы цис-транс-изомеров гексена-2.
12.Напишите формулы следующих соединений: метан, муравьиная кислота, уксусная кислота, ацетон, этилацетат, бутилацетат, глицерин, этиленгликоль, масляная кислота, ацетилен, формальдегид, метанол, этанол, пропанол, стеариновая кислота, стеарат натрия.
13. Составьте уравнения реакций синтеза полиэтилена, полипропилена, фенолформальдегидной смолы.
Занятие 18.Основы аналитической химии
1.Расскажите о классификации аналитических методов.
2.Какие существуют методы количественного анализ?
3.Как классифицируются методы титриметрического (объёмного) анализа?
4.Что такое титр, титрование, молярная концентрация эквивалента, молярная концентрация?
5.Сформулируйте закон эквивалентов?
6. Какие методы анализа относят к физико-химическим и как они классифицируются?
7.Решить задачи:
1.Чему равна масса гидроксида натрия, содержащегося в 100 мл раствора, если на титрование 10,00 мл его раствора потребовалось 8,76 мл раствора соляной кислоты с молярной концентрацией эквивалента 0, 96 моль/л?
2.Чему равна жесткость воды, если на титрование 100мл потребовалось 2,20 мл раствора трилона Б, молярная концентрация которого 0,05 моль/л?
3.Для полной нейтрализации 10,00 мл фосфорной кислоты потребовалось 5,25 мл раствора гидроксида калия с молярной концентрацией 0,10 моль/л. Чему равна молярная концентрация фосфорной кислоты в растворе?
4.На титрование 10,00 мл раствора гидроксида кальция пошло 9,16 мл раствора хлороводородной кислоты с молярной концентрацией эквивалента 10,10моль/л. Какое количество гидроксида кальция содержалось в исследуемом растворе? Какова масса растворенного гидроксида кальция?
5.Студент получил для анализа неизвестную кислоту, которая могла быть уксусной CH 3 COOH, пировиноградной CH 3 COCOOH или пропионовой CH 3 CH 2COOH. Все указанные кислоты одноосновны. Для титрования был приготовлен раствор, содержащий 0,2000 г этой кислоты в 100мл раствора. На титрование 10,00 мл раствора кислоты пошло 2,26 мл раствора гидроксида калия с молярной концентрацией 0,10 моль/л. Какая кислота была дана для анализа?
Промежуточный контроль.
Формы контроля: ответы на вопросы практических занятий, выполнение контрольных работ, ответы на вопросы самоконтроля, выполнение тестовых заданий
Контрольная работа 1. Химическая связь.
Вариант 1
- Какие химические связи имеются в молекулах азота, этилена, ацетилена?
- Какую геометрическую конфигурацию имеют молекулы аммиака, гидрида бериллия, тетрафторида кремния?
- Что называется длиной связи? Как изменяется длина связи в ряду: HF–HCl–HBr–HJ ?
- Какая связь более полярна: а) P–Br или P–Se б) S–O или Se–O
Вариант 2.
1 Какие химические связи имеются в молекулах аммиака, фтора, кислорода?
2 Какую геометрическую конфигурацию имеют молекулы хлороводорода, воды, трифторида бора?
3 Что называется энергией связи? Как изменяется энергия связей при переходе от H2O к H2S, H2Se, H2Te?
4 Какая связь более полярна: а) H–O или H–S б) B–F или Al–F
Контрольная работа 2 «Кинетика»
Вариант 1
1.Как изменится скорость реакции 2 NO(г) + O2(г) ═ 2NO2(г) , кинетическое уравнение которой имеет вид υ ═ k [NO] 2[O2] при увеличении общего давления в системе в два раза?
2. Температурный коэффициент реакции равен трем. Как изменится скорость этой реакции, если температуру её проведения повысить на 40 градусов?
3. Реакция разложения пентахлорида фосфора протекает по уравнению:
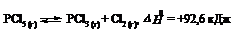
Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции разложения PCl5?
Вариант 2
1.Рассчитайте, как изменится скорость прямой реакции в гомогенной системе
2 SO2 (г) + O2 (г) ⇄ 2 SO3 (г), если уменьшить объем, занимаемый газами, в два раза?
2. Рассчитайте, как и во сколько раз изменится скорость химической реакции 2Cu2O + O2 = 4CuО при повышении температуры на 30° (g = 3).
3. Действием каких факторов процесс CO2(г) +H2O(ж) ↔ H2CO3(ж) +Q может быть смещен вправо?
Контрольная работа 3 «Растворы»
Вариант 1
1.Вычислите молярную и эквивалентную концентрации 20%-ного раствора хлорида кальция, плотность которого 1,178 г/см3.
2.Вычислить молярную концентрацию раствора хлорида магния, если известно, что в растворе объемом 250 мл содержится 4.75 г хлорида магния.
3.Вычислите температуру кристаллизации раствора мочевины (NH2)2CO, содержащего 5 г мочевины в 150 г воды. Криоскопическая константа воды 1,86 град.
4.Определить рН раствора, в котором концентрация гидроксид-ионов (моль/л) составляет 2 10-5 .
5.Запишите уравнение реакций гидролиза и укажите характер среды для следующих солей: Na2S, K3PO4 ,CuSO4 .
6.Чему равно осмотическое давление при 25 0 С водного раствора, содержащего в 250 мл 9,8 г этиленгликоля C 2H2 (OH)2.
Вариант 2
1.Чему равна молярная концентрация эквивалента 30%-ного раствора NaOH плотность которого 1,328 г/см3? К 1 л раствора прибавили 5 л воды. Вычислите массовую долю полученного раствора.
2.Какую массу хлорида магния надо взять для приготовления раствора объемом 250 мл с молярной концентрацией 0,2 моль/л.
3.Вычислите мольную массу неэлектролита, зная что раствор, содержащий 2,25 г этого вещества в 250 г воды, кристаллизуется при -0,2790С. Криоскопическая константа воды 1,86 град.
4.Определить рН раствора, в котором концентрация ионов водорода (моль/л) составляет 3,2 10-5 .
5.Запишите уравнение реакций гидролиза и укажите характер среды для следующих солей: Na2SO3 ,KCl ,FeSO4.
6.Чему равно осмотическое давление при 20 0 С водного раствора, содержащего в 250 мл 4,6 г глицерина C3H3 (OH)3
Содержание контрольных мероприятий:
ВОПРОСЫ ДЛЯ ПОДГОТОВКИ К ЗАЧЁТУ ПО ХИМИИ (1-ый семестр)
1. Основные понятия химии: атом, молекула, химический элемент, виды химических формул, относительная атомная и молекулярная масса, эквивалент, моль, молярная масса, эквивалентная молярная масса, химические реакции и уравнения.
2. Основные количественные законы химии: закон сохранения массы веществ, закон эквивалентов, закон кратных отношений, закон постоянства состава, закон Авогадро и следствия из него.
3. Строение атома: доказательства сложности строения атома, планетарная модель строения атома, атомные спектры, постулаты Бора, двойственная природа электрона, принцип неопределенности, уравнение Шредингера.
4. Атомные орбитали, квантовые числа, принципы заполнения орбиталей (принцип минимальной энергии, принцип запрета Паули, правило Гунда, правило Клечковского), электронные формулы.
5. Периодическая система элементов Д.И. Менделеева и электронное строение атома (формулировка Менделеева, современная формулировка, структура периодической системы, физический смысл порядкового номера элемента, связь между электронным строением атомов и положением элементов в периодической системе.)
6. Периодически и непериодически изменяющиеся свойства элементов: радиусы атомов, энергия ионизации, сродство к электрону, электроотрицательность.
7.Классификации и номенклатура неорганических веществ.
8. Химическая связь: определение и характеристики химической связи, основные виды связей. Метод валентных связей. Обменный и донорно-акцепторный механизм образования ковалентной связи. Свойства ковалентной связи, гибридизация атомных орбиталей. Полярность связей и молекул.
9. Межмолекулярные взаимодействия: ориентационное, индукционное, дисперсионное взаимодействия, силы отталкивания и суммарное взаимодействие. Водородная связь.
10 Основы химической термодинамики: предмет химической термодинамики, основные понятия (система, параметры состояния, термодинамические функции, энергия системы, теплота и работа, термодинамические процессы).
11. Первый закон термодинамики, энтальпия. Тепловой эффект химических реакций. Термохимические уравнения. Энтальпия (теплота) образования и сгорания.
12. Основной закон термохимии и следствия из него. Калорийность пищи. Второй закон термодинамики. Энтропия и ее изменения при различных процессах. Энергия Гиббса и направленность химических реакций.
13.Химическая кинетика: скорость химической реакции, зависимость скорости реакции от различных факторов, порядок и молекулярность реакции, катализ и его виды.
14. Химическое равновесие, константа химического равновесия, смещение равновесия, принцип Ле Шателье.
15.Растворы: способы выражения концентраций растворов, физико-химические свойства разбавленных растворов неэлектролитов (осмос, давление пара над раствором, температуры кипения и замерзания, растворение газов в жидкостях, экстракция). Криоскопия и эбулиоскопия.
ВОПРОСЫ ДЛЯ ПОДГОТОВКИ К ЗАЧЁТУ ПО ХИМИИ (2-ой семестр)
16.Растворы электролитов. Теория электролитической диссоциации, слабые и сильные электролиты, диссоциация воды, ионное произведение воды, водородный показатель.
17.Основные типы химических реакций в растворах: реакция гидролиза, нейтрализации, осаждения и растворения. Кислотно-основные буферные системы.
18.Сильные электролиты. Произведение растворимости.
19. Дисперсные системы. Коллоидные растворы, растворы высокомолекулярных соединений.
20.Редокс-процессы: степень окисления, отличие от валентности; важнейшие окислители и восстановители, типы окислительно- восстановительных реакций, методы составления уравнений окислительно-восстановительных реакций.
21. Электродные потенциалы. Ряд напряжений металлов. Окислительно-восстановительные потенциалы и определение направления окислительно- восстановительных процессов. Гальванические элементы.
22. Электролиз. Законы электролиза. Коррозия металлов и способы защиты металлов от коррозии.
23.Предмет органической химии. Теория строения органических соединений Бутлерова, ее положения; развитие теории строения органических соединений в свете новых электронных представлений начала XX века: квантовая теория, атомные орбитали, электронная конфигурация атома, гибридизация, типы гибридизации.
24.Классификация органических соединений.
25.Полимеры. Методы получения полимеров: полимеризация, поликонденсация. Полимеры термореактивные и термопластичные.
26.Строение полимеров: линейные, разветвленные и сетчатые полимеры. Регулярная и нерегулярная структура полимеров. Кристаллические и аморфные полимеры.
27.Свойства полимеров: химические свойства, механические и электрические. Органические полупроводники и электролиты. Применение полимеров: волокна, пленки, резины, лаки, клеи, пластмассы, композиционные материалы.
28.Основы аналитической химии. Качественный и количественный анализ. Физико-химические методы анализа.
Список литературы
Дата добавления: 2018-04-05; просмотров: 399; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
