Примеры решения задач по теме «Энергетика химических реакций»
Пример 1При взаимодействии кристаллов хлорида фосфора (V) с парами воды образуются жидкий POCl3 и хлористый водород. Реакция сопровождается выделением 111,4 кДж теплоты. Напишите термохимическое уравнение этой реакции.
Решение. Уравнение реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также численное значение тепловых эффектов, называются термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp, равные изменению энтальпии системы DН. Значение DН приводят обычно в правой части уравнения, отделяя его запятой или точкой с запятой. Приняты следующие сокращения обозначения агрегатного состояния веществ: г- газообразное, ж - жидкое, к - кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно.
Если в результате реакций выделяется теплота, то DН < 0. Учитывая сказанное, составляем термохимическое уравнение данной в примере реакции:
PCl5(K) + H2O(Г) = POCl3(Ж) + 2HCl(Г); DНХР = -111,4 кДж
или
PCl5(K) + H2O(Г) = POCl3(Ж) + 2HCl(Г) + 111,4 кДж
| Вещество | Состояние | DН298, кДж/моль | Вещество | Состояние | DН298, кДж/моль |
| CS2 | г | +115,28 | CH3OH | г | -201,17 |
| NO | г | +90,37 | C2H5OH | г | -235,31 |
| C6H6 | г | +82,93 | H2O | г | -241,83 |
| C2H4 | г | +52,28 | H2O | ж | -285,84 |
| H2S | г | -20,15 | NH4Cl | к | -315,39 |
| NH3 | г | -46,19 | CO2 | г | -393,51 |
| CH4 | г | -74,85 | Fe2O3 | к | -822,1 |
| C2H6 | г | -84,67 | Ca(OH)2 | к | -986,5 |
| HCl | г | -92,31 | Al2O3 | к | 1669,8 |
| CO | г | -110,52 |
|
|
|
Пример 2. Исходя из теплоты образования газообразного диоксида углерода (DН0= -393,5 кДж/моль) и термохимического уравнения
С(графит) + 2N2O(Г) = CO2(Г) + 2N2(Г), DН0 =-557,5 кДж/моль (1)
вычислить теплоту образования N2O(Г) .
Решение. Обозначив искомую величину через х, запишем термохимическое уравнение образования N2O(Г) из простых веществ:
N2(Г) + 1/2O2(Г) = N2O(Г) , DH01 = x кДж/моль (2)
Запишем также термохимическое уравнение реакции образования СО2(Г) из простых веществ :
С(графит) + О2(Г) = CO2(Г) , DН02 =-393,5 кДж/моль (3)
Из уравнения (2) и (3) можно получить уравнение (1). Для этого умножим уравнение (2) на два и вычтем найденное уравнение из (3). Имеем :
С(графит) + 2N2O(Г) = CO2(Г) + 2N2(Г), DН0 =(-393,5 - 2х) кДж/моль (4)
Сравнивая уравнение (1) и (4) находим: -393,5 - 2х = -557,5 , откуда х = 82 кДж/моль .
Пример 3.Дано уравнение реакции:
3Fe2O3(к) + H2(г) = 2Fe3O4(к) + H2O(г)
DН , кДж/моль -822,2 0 -1117,1 -241,7
DS , Дж/моль К 87,4 130,5 146,2 188,7
|
|
|
DG, кДж/моль -740,3 0 -1014,2 -228,6
Найти изменение энтальпии, и определить будет ли протекать процесс самопроизвольно при Т= 298, 500, 1000 К.
Решение
1. Определим изменение энтальпии:
DН= НКОН - НИСХ = (2 (-1117,1) + (-241,7)) - (3 (-822,2) + 0) = -9,3 кДж/моль
2. Определим изменение энтропии для определения энергии Гиббса
DS = SКОН - SИСХ = (2×146,2 + 188,7) - ( 3×87,4 +130,5) = 88,4 Дж/моль К
3. Рассчитаем энергию Гиббса для трех температур.
DG298 = DH - TDS = -9,3*103 - 298*88,4 = - 35,64 кДж/моль
DG500 = DH - TDS = -9,3*103 - 500*88,4 = - 53,5 кДж/моль
DG1000 = DH - TDS = -9,3*103 - 1000*88,4 = - 97,7 кДж/моль
Следовательно, энергия Гиббса отрицательная величина, поэтому процесс самопроизвольно протекать будет.
Пример 4Восстановление Fe2O3 водородом протекает по уравнению:
Fe2O3 (к) + 3H2 (г) = 2Fe (к) + 3H2O (г) ; DН = +96,61 кДж. Возможна ли реакция при стандартных условиях, если изменение энтропии DS=0,1387 кДж/моль×К. При какой температуре начнется восстановление Fe2O3?
Решение.
Вычисляем DG реакции DG=DH - DS×T=96,61 - 298×0,1387= +55,28 кДж. Так как DG >0, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру, при которой DG=0: 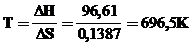 . Следовательно при температуре »696,5 К начнется реакция восстановления Fe2O3 . Иногда эту температуру называют температурой начала реакции.
. Следовательно при температуре »696,5 К начнется реакция восстановления Fe2O3 . Иногда эту температуру называют температурой начала реакции.
|
|
|
Решение задач по теме «Растворы»
Пример 1 Вычислите температуры кристаллизации и кипения 2%-ного водного раствора глюкозы С6Н12О6.
Решение. По закону Рауля понижение температуры кристаллизации и повышение температуры кипения раствора (Dt) по сравнению с температурами кристаллизации и кипения растворителя выражается уравнением 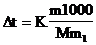
где К - криоскопическая или эбуллиоскопическая константы. Для воды они соответственно равны 1,86 и 0,52 град. m и М - соответственно масса растворенного вещества и его мольная масса; m1 - масса растворителя.
Понижение температуры кристаллизации 2%-ного раствора 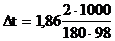 =0,21 град.
=0,21 град.
Вода кристаллизуется при 00С, следовательно, температура кристаллизации раствора 0-0,21=-0,210С.
Повышение температуры кипения 2%-ного раствора глюкозы 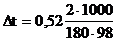 =0,06 град.
=0,06 град.
Вода кипит при 1000С, следовательно, температура кипения этого раствора 100+0,06=100,060С.
Пример 2. Раствор, содержащий 1,22 г бензойной кислоты С6Н5СООН в 100 г сероуглерода, кипит при 46,5290С. Температура кипения сероуглерода 46,30С. Вычислите эбуллиоскопическую константу сероуглерода.
Решение. Повышение температуры кипения Dt=46,529-46,3=0,229 град. Мольная масса кислоты 122 г/моль. По формуле находим:
|
|
|
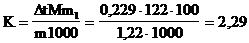 град.
град.
Дата добавления: 2018-04-05; просмотров: 1973; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
