Кондуктометрическое титрование
Цель работы -освоить метод кондуктометрического титрования, провести количественный анализ растворов электролитов
Теоретическая часть
Под прохождением электрического тока через вещество понимают движение (перенос) электрических зарядов от одного полюса к другому под действием внешнего электрического поля. Способность вещества проводит электрический ток называется электропроводностью. Мерой электропроводности является количество электричества, выраженное в кулонах, которое за единицу времени проходит через электролит.
Электропроводность растворов электролитов на практике определяют по значению их сопротивления электрическому току, протекающему между двумя погруженными в раствор электродами. Измерение электропроводности растворов (так называемая кондуктометрия) позволяет решить ряд практических задач.
При кондуктометрическом титровании аналитическим сигналом, позволяющим определить точку эквивалентности, является, электрическая проводимость раствора. Этот метод с успехом применяется для анализа окрашенных и мутных растворов, когда визуальное определение точки эквивалентности затруднено. Кондуктометрическое титрование может быть использовано во всех случаях, когда реакция, происходящая при титровании, сопровождается изменением количества ионов в растворе. Это могут быть реакция нейтрализации, осаждения и комплексообразования. Характер кривых титрования зависит от изменения числа ионов и их подвижности.
|
|
|
Рассмотрим три примера.
1. Определение концентрации сильной кислоты путем кондуктометрического титрования щелочью
НСl+ NaOH = NaCl + Н2О
или в ионной форме:
Н+ + ОН- = Н2О
При титровании электропроводность раствора уменьшается (рисунок 16.1, кривая 1, от точки А до точки эквивалентности В), так как у ионов Na+, заменяющих в процессе титрования ионы H+, точнее H3О+, подвижность значительно меньше, к тому же происходит разбавление раствора. В момент нейтрализации электропроводность раствора достигнет минимума. При дальнейшем прибавлении щелочи в растворе будет увеличиваться общее число ионов, среди которых появляются ионы OH- с большой подвижностью. Вследствие этого электропроводность будет возрастать (рисунок 16.1, кривая 1, от точки В до точки С).
2 Определение концентрации слабой кислоты путем кондуктометрического титрования. Кривая титрования слабой кислоты (СН3СООН) имеет несколько другой вид (рисунок 16.1, кривая 2). В этом случае протекает реакция:
СН3СООН + Na+ + OH- → Na+ + СН3СОО- + H2O
| Рисунок 16.1 - Кривая кондуктометрического титрования 1 -сильной кислоты сильным основанием (или сильного основания сильной кислотой) 2- слабой кислоты сильным основанием (или слабого основания сильной кислотой) |
|
|
|
ǽ С
А 1
С
В
2 В
А
Vэкв VNaOH
После нейтрализации кислоты электропроводность растет еще более сильно, так как в растворе появляются в избытке гидроксид-ионы OH-, обладающие большой подвижностью (рисунок 16.1, кривая 2, от точки В до точки С).
Количество щелочи, которое соответствует наименьшей электропроводности, полностью нейтрализует взятую кислоту. Зная объем взятой для титрования кислоты, а также объем и концентрацию раствора щелочи, затраченной на нейтрализацию, рассчитать концентрацию титруемой кислоты возможно по уравнению
|
|
|
С1V1 = C2V2;
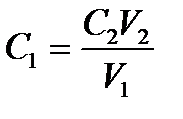
где V1 – объема раствора кислоты, мл; С1 – концентрация титруемого раствора кислоты, моль/л; V2 - объем раствора щелочи, пошедший на титрование кислоты, мл; C2 - концентрация щелочи, моль/л.
3. Определение концентрации ионов серебра (I) в растворе путем кондуктометрического титрования раствором иодида калия. Реакция между нитратом серебра и иодидом калия сопровождается образованием малорастворимого иодида серебра:
AgNO3 + KI = AI + KNO3
В ходе реакции ионы Ag+ выводятся из раствора, но взамен их появляется эквивалентное количество ионов К+. Поскольку подвижности этих ионов различаются мало, в ходе титрования электрическая проводимость раствора до точки эквивалентности остается практически постоянной (рисунок 16.2, от точки А до точки В).
ǽ С
| Рисунок 16.2 - Кривая кондуктометрического титрования нитрата серебра раствором иодида калия |
Vэкв VKI
Практическая часть
Добавление к раствору после достижения точки эквивалентности первой избыточной капли раствора иодида калия приводит к увеличению проводимости (рисунок 16.2, от точки В до точки С).
|
|
|
Включите прибор в сеть, прогрейте его в течение 5 мин.В колбу налейте 50 см3 исследуемого раствора (хлороводородной или уксусной кислоты) и измерьте его исходную электрическую проводимость
Бюретку заполните раствором титранта (0,1н. NaOH), точная концентрация которого известна. В колбу с исследуемым раствором из бюретки порциями по 0,5 см3 введите раствор титранта. После перемешивания измерьте электропроводность раствора. Вновь прилейте новую порцию титранта, перемешайте и измерьте электропроводность. После добавления каждой новой порции титранта повторяйте операцию. Определите ориентировочный эквивалентный объем титранта VЭ.
Титрование повторите, добавляя титрант вблизи точки эквивалентности порциями по 0,1 см3. Определите точный эквивалентный объем VЭ.
Дата добавления: 2018-04-05; просмотров: 881; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
