Потенциометрическое титрование и определение рН
Цель работы –освоить методику потенциометрического титрования, изучить устройство и принцип работы индикаторных и электродов сравнения.
Теоретическая часть
1. Общие принципы потенциометрии
Потенциометрическое определение концентрации ионов водорода 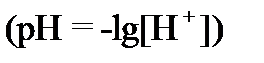 или других ионов (
или других ионов (  и т. д.) основано на измерении Э.Д.С. электрохимической ячейки, составленной из двух электродов, причём, потенциал одного электрода
и т. д.) основано на измерении Э.Д.С. электрохимической ячейки, составленной из двух электродов, причём, потенциал одного электрода  является постоянной величиной, а потенциал второго электрода
является постоянной величиной, а потенциал второго электрода  зависит от концентрации определяемых ионов С в исследуемом растворе. В результате измеряемая Э.Д.С. зависит от концентрации ионов.
зависит от концентрации определяемых ионов С в исследуемом растворе. В результате измеряемая Э.Д.С. зависит от концентрации ионов.
Э. Д. С.  (1)
(1)
 = сonst,
= сonst,
 (2)
(2)
где  стандартный электродный потенциал, величина постоянная, R - постоянная Больцмана (
стандартный электродный потенциал, величина постоянная, R - постоянная Больцмана (  ), F - константа Фарадея (F = 96500 Кл/моль = 26,8 А∙ч/моль), n - число электронов, отдаваемое или принимаемое определённым атомом или ионом.
), F - константа Фарадея (F = 96500 Кл/моль = 26,8 А∙ч/моль), n - число электронов, отдаваемое или принимаемое определённым атомом или ионом.
Если принять  , то уравнение (2) принимает вид:
, то уравнение (2) принимает вид:
 (3)
(3)
Электрод с постоянным электродным потенциалом (  ) называется электродом сравнения. Классическим электродом сравнения считается водородный электрод, который, однако, для широкого практического применения не используется из-за его сложного устройства.
) называется электродом сравнения. Классическим электродом сравнения считается водородный электрод, который, однако, для широкого практического применения не используется из-за его сложного устройства.
|
|
|
В современных иономерах и pH-метрах в качестве электрода сравнения используется хлорсеребряный электрод.
Электроды, потенциал которых зависит от концентрации определяемых ионов, называются индикаторными электродами. При измерениях pH растворов в настоящее время в качестве индикаторного электрода используется стеклянный электрод. При измерении концентрации других ионов (  ,Ca2+ и т.д.) в последнее время чаще всего используются ионселективные мембранные электроды.
,Ca2+ и т.д.) в последнее время чаще всего используются ионселективные мембранные электроды.
2.Принципы работы электродов
Электродом сравнения в иономерах типа ЭВ-74, И-120 и др. служит хлорсеребряный электрод (рисунок 14.1).
 Электродный потенциал хлорсеребряного электрода образуется благодаря следующей реакции:
Электродный потенциал хлорсеребряного электрода образуется благодаря следующей реакции:
 ⇆
⇆  .
.
Поскольку концентрация труднорастворимой соли AgCl в насыщенном по этой соли растворе, постоянна, то электродный потенциал будет зависеть только от концентрации ионов серебра Ag+ :
| Рисунок 14.1 - Устройство хлорсеребряного электрода 1 -изолятор, 2 - серебряная проволока, покрытая труднорастворимой солью AgCl; 3 - насыщенный раствор KCl; 4 - капилляр, связывающий внутренний раствор электрода с исследуемым раствором; 5 - стеклянный корпус электрода. |
 , (4)
, (4) |
|
|
Раствор KCl также является насыщенным, следовательно, концентрация ионов хлора [  ] = const. Величина произведения растворимости ПРAgCl = [Ag+][Cl-] = const, а поскольку [
] = const. Величина произведения растворимости ПРAgCl = [Ag+][Cl-] = const, а поскольку [  ] = const, то и в смеси солей KCl и AgCl концентрация [Ag+] = const. Потенциал электрода при постоянной температуре величина постоянная E = const.
] = const, то и в смеси солей KCl и AgCl концентрация [Ag+] = const. Потенциал электрода при постоянной температуре величина постоянная E = const.
Индикаторным электродом при измерении pH является стеклянный электрод (рисунок 14.2).
Основу материала стеклянной мембраны индикаторного электрода составляет оксид кремния SiO2.  При его взаимодействии с водой на поверхности стеклянного шарика образуется труднорастворимая кремниевая кислота:
При его взаимодействии с водой на поверхности стеклянного шарика образуется труднорастворимая кремниевая кислота:
SiO2 + H2O ↔ H2SiO3 (5)
Будучи слабой кислотой, кремниевая кислота диссоциирует обратимо по первой ступени:
H2SiO3 ↔  + Н+ (6)
+ Н+ (6)
Ион водорода диффундирует в раствор, а кислый анион остается на стеклянной поверхности. Сумма зарядов анионов, закрепленных на внешней поверхности мембраны (шарика), формирует ее электродный потенциал.
Описанные процессы протекают в чистой воде. Если теперь стеклянный электрод погрузить в кислый раствор, то содержащиеся в нем ионы водорода будут участвовать в равновесии (6). В соответствии с принципом Ле-Шателье равновесие сдвинется влево, и концентрация анионов на поверхности мембраны уменьшится. Электродный потенциал сдвинется в более положительную сторону.
|
|
|
При погружении электрода в щелочной раствор ионы ОН- раствора будут связывать ионы Н+, и равновесие (6) сдвинется вправо за счет диссоциации все новых молекул кислоты. На поверхности мембраны будут появляться дополнительные кислые анионы, и потенциал ее сдвинется в более отрицательную сторону. Таким образом, величина потенциала внешней поверхности стеклянного электрода будет изменяться в зависимости от рН исследуемого раствора.
При этом величина потенциала внутренней поверхности стеклянного шарика при всех одинаковых условиях изменяться не будет, так как концентрация раствора внутри герметичного электрода не изменяется.
Разность потенциалов внутренней и внешней поверхностей стеклянной мембраны измеряется с помощью прибора рН-метра. При этом каждому значению разности потенциалов соответствует строго определенное значение рН измеряемого раствора.
Стеклянный электрод можно использовать при значениях pH от 0 до 13. Электрод совершенно нечувствителен к различным примесям в растворе, им можно измерять pH в растворах, содержащих окислители, катионы металлов и т. д. Равновесие между электродом и раствором устанавливается быстро. Недостатком является хрупкость стеклянного шарика.
|
|
|
3.Потенциометрическое титрование
Потенциометрическое титрование является важнейшим практическим приложением измерений ЭДС. При потенциометрическом титровании эквивалентная точка определяется не по изменению цвета индикатора, как при обычном методе титрования, а по изменению скачка потенциала индикаторного электрода. Особенно удобно потенциометрическое титрование, например, при титровании окрашенных или мутных растворов, когда нельзя использовать обычные индикаторы.
Рассмотрим процесс титрования какой-либо сильной кислоты неизвестной концентрации щелочью известной концентрации с целью определения концентрации кислоты.
Титруемый раствор (кислоту) строго определенного объема наливают в стакан, погружают в него оба электрода (хлорсеребрянный и стеклянный). Далее из микробюретки небольшими порциями добавляют раствор щелочи известной концентрации. После каждого прибавления щелочи производят определение рН с помощью потенциометра. Затем строят кривую титрования (рисунок 14.3), которая выражает зависимость рН раствора от количества прибавленного раствора щелочи.
В начале титрования концентрация водородных ионов (а, следовательно, рН среды) изменяется медленно. Однако вблизи эквивалентной точки это изменение
| А |
| 7 |
| Рисунок 14.3 – Кривая титрования т.А – точка эквивалентности |
| А |
| 7 |
| рН |
| Vэкв VNaOH Рисунок 14.3 - Кривая титрования VNaOH |
количеств щелочи. После прохождения эквивалентной точки измерение рН раствора вновь становиться небольшим. Это резкое изменение рН около точки эквивалентности называется скачком титрования (нейтрализации). Как видно из рисунка 14.3, точка А, соответствующая моменту нейтрализации раствора находится посередине вертикального участка кривой, соответствующего скачку титрования. Точка А соответствует искомому эквивалентному объему щелочи.
Далее концентрацию искомой кислоты рассчитываем, согласно закона эквивалентов:
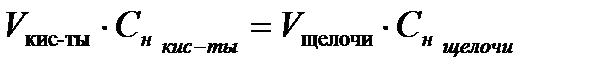 (7)
(7)
Практическая часть
1.Измерение рН раствора на иономере ЭВ-74
Настройка прибора по буферным растворам производится преподавателем. Перед измерением электроды облить дистиллированной водой. Избыток воды удалить с электродов фильтровальной бумагой.
2. Определение концентрации HCl потенциометрическим титрованием.
В стаканчик на 50 мл прилить пипеткой 0,2 мл 2 н. раствора HCl и добавить примерно 20…25 мл дистиллированной воды. Электроды опустить в приготовленный раствор HCl.
Микробюретку ополоснуть дистиллированной водой, затем раствором 0,1 н. NaOH, далее заполнить ее раствором 0,1 н. NaOH и установить таким образом, чтобы раствор NaOH из микробюретки поступал непосредственно в стаканчик с HCl. Далее раствор щелочи порциями по 0,5 мл добавлять к раствору кислоты при включенной магнитной мешалке и титровать до рН – 10…11. Показания рН записывать после добавлении каждой порции NaOH в таблицу 14.1.
По полученным данным строят кривую титрования в координатах рН = f (VNaOH) (см. рисунок 14.3). По кривой титрования находят эквивалентный объем щелочи (VNaOH экв.), а далее рассчитывают точную концентрацию HCl из уравнения:
Сн.(HCl)  VHCl = Сн. (NaOH) · VNaOHэкв
VHCl = Сн. (NaOH) · VNaOHэкв
3. Определение количества уксусной кислоты в растворе
Получите у преподавателя контрольный раствор СН3СООН и приготовьте раствор СН3СООН для потенциометрического титрования. Для этого в стакан для титрования перенесите при помощи пипетки 10 мл раствора СН3СООН, добавьте 10 мл дистиллированной воды. Измерьте рН приготовленного раствора.
Приготовьте бюретку для титрования 0,1 н. раствором щелочи. Проведите титрование раствора СН3СООН раствором щелочи, измеряя значение рН раствора после каждого добавления раствора щелочи по 0,5 мл. Результаты титрования запишите в таблицу 14.1.
Таблица 14.1 - Результаты измерений
| Кислота | VNaOH, пошедший на титрование | ||||||||||||
| рН |
На основании таблицы 14.1 постройте кривые титрования и рассчитать концентрацию раствора исследуемых кислот HCl или СН3СООН.
Вопросы для самоконтроля
1. Каково значение потенциометрического титрования? Приведите примеры использования потенциометрического титрования.
2. Как осуществляется потенциометрическое титрование?
3. Что называется точкой эквивалентности? Что называют кривой титрования?
4. Как определить точку эквивалентности при потенциометрическом титровании?
5. Как рассчитать концентрацию кислоты (соляной, уксусной) в растворе при потенциометрическом титровании?
6. Какие электроды используются при потенциометрическом титровании?
7. Пояснить принцип работы электродов.
8. Почему буферные растворы практически не меняют рН среды?
9. Могут ли концентрации водородных и гидроксильных ионов в водном растворе быть равными нулю?
10. Как изменится рН чистой воды, если к 1 литру воды прибавить 0,001 моль КОН, считая диссоциацию последнего полной?
Лабораторная работа №15
Дата добавления: 2018-04-05; просмотров: 2129; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
