Измерение стационарных потенциалов металлов. Измерение токов коррозии
Цель работы - практически ознакомиться с явлениями, сопровождающими процесс электрохимической коррозии металлов, строением двойного электрического слоя.
Теоретическая часть
Процесс коррозии металла, погруженного в водный раствор соли, сопровождается различными явлениями: разрушением поверхности и появлением ионов металла и других продуктов коррозии в растворе, в ряде случаев - образованием газообразных продуктов, а также наличием электродного потенциала. Измерение величины электродного потенциала является наиболее универсальным и информативным способом сравнительного изучения коррозии различных металлов. Рассмотрим в общих чертах причины, определяющие возникновение потенциала.
На металлической пластинке, погруженной в раствор соли между металлом и раствором возникает "скачек потенциала", причинами которого является переход заряженных частиц из одной фазы в другую с образованием двойного электрического слоя на границе раздела фаз. Возникновение скачка потенциала на границе металл-электролит происходит за счет окисления металла и одновременного восстановления его ионов, находящихся в растворе. Потенциал, возникающий на границе раздела металл-электролит при активности ионов этого металла в растворе, равном I моль/л. называется обратимым, и, по уравнению Нернста, определяется уравнением:
 (1)
(1)
|
|
|
где φмет-стационарный потенциал, φ0- стандартный потенциал, 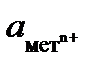 - активность металла в растворе
- активность металла в растворе
Если потенциал измерен при единичной концентрации ионов металла в растворе, измеряемый потенциал называется стандартным потенциалом. Стандартные потенциалы некоторых металлических электродов приведены в таблице 13.1.
Таблица 13.1 - Стандартные электродные потенциалы металлических электродов
| металл | стандартный электродный потенциал, мВ | металл | стандартный электродный потенциал, мВ |
| Mg | -2,37 | Fe | -0,44 |
| Ti | -1,75 | Ni | -0,25 |
| Al | -1,66 | Sn | -0,14 |
| Zr | -1,54 | Pb | -0,13 |
| Ta | -0,81 | W | -0,1 |
| Zn | -0,76 | Cu | 0,34 |
| Cr | -0,56 |
Если в процессе обмена ионами между металлом и электролитом участвуют не только ионы данного металла но и другие ионы или атомы, причем анодный процесс осуществляется в основном ионами металла а катодный - другими ионами, например, водородными, устанавливается необратимый электродный потенциал. Этот потенциал не подчиняется термодинамическому уравнению (I) и поэтому не может быть по нему рассчитан, а определяется только опытным путем. Устойчивое во времени значение необратимого электродного потенциала металла, соответствующее равенству сумм анодных и катодных процессов, называется стационарным. Таким образом, при электрохимическом растворении металла в растворе чужеродных ионов или в другом агрессивном растворе на нем устанавливается необратимый электродный потенциал, характеризующий коррозионную активность металла. Как уже отмечалось, растворение металла складывается из двух электродных процессов:
|
|
|
1. анодного - образования гидратированных ионов металла в электролите и электронов на поверхности металла: Ме + nН20 = Меn+nН20 + nе,
2. катодного - ассимиляции электронов какими-либо ионами (кроме
ионов данного металла) или молекулами раствора - деполяризаторами "Д",
способными к восстановлению по реакции: nе + Д = Дnе.
Следовательно, первопричиной особенностей поведения металлов при их коррозии в реальных условиях является их термодинамическая неустойчивость. А электрохимический механизм коррозии, протекающей в виде электрохимической реакции с участием свободных электронов, сопровождается ионизацией атомов металла и восстановлением окислительного компонента коррозионной среды. Эти акты проходят на различных участках поверхности и зависят от величины электродного потенциала. На практике коррозии подвергаются чаще не индивидуальные металлы, а, как минимум, два металла, имеющих электрический контакт между собой. Это - детали машин, выполненных из различных металлов и соприкасающихся между собой, или детали с нанесенными на их поверхность металлическими покрытиями.
|
|
|
Для сравнительной характеристики коррозионной способности металлов измеряют их стационарные потенциалы относительно электрода сравнения. Моделью для изучения процесса коррозии гетерогенной металлической поверхности служит пара пластинок различных металлов, замкнутых между собой металлическим проводником. Сравнение потенциала этой пары с потенциалами индивидуальных металлов позволяет судить о процессах, протекающих на их поверхности. Как правило, потенциал пары находится между значениями потенциалов индивидуальных металлов, при этом более электрохимически активный металл имеет более отрицательное значение потенциала и в составе пары является анодом, он окисляется .На втором металле локализован катодный процесс деполяризации. Этот электрод не растворяется, он защищен от разрушения в результате того, что потенциал его сдвинут в отрицательную сторону, и его окисление термодинамически невозможно. На этом металле протекает процесс деполяризации, т.е. связывания электронов, высвобождающихся при коррозии первого металла.
|
|
|
Такая модель может быть реализована также на примере коррозии металлических сплавов. Здесь на поверхности можно выделить отдельные участки одного металла, входящего в состав сплава, граничащие с участками другого металла, также входящего в его состав. На этих различных участках одной и той же поверхности локализуются процессы коррозии. На участках более электроотрицательного металла локализован анодный процесс растворения, а на участках более электроположительного металла локализован процесс деполяризации. Такой же механизм коррозии может быть реализован на поверхности чистых металлов. В этом случае локализация анодных и катодных процессов происходит из-за различной пассивности отдельных участков поверхности. Стационарный потенциал металла, корродирующего в таких условиях, будет сдвинут в более положительную сторону, в сравнении со стандартным потенциалом. Если поверхность металла покрыта пассивной окисной пленкой, устойчивой в условиях данного коррозионного процесса, то потенциал сдвигается в отрицательную сторону.
В зависимости от условий протекания процесса коррозия может протекать с кислородной или с водородной деполяризацией. Кислородная деполяризация в нейтральных и щелочных растворах протекает за счет растворенного в воде кислорода по суммарному уравнению: О2 + 4е + 2Н2О = 4ОН−.
В кислых растворах : О2 + 4е + 4Н+ = 2Н2О.
Водородная деполяризация в кислых средах протекает в соответствии с уравнением: 2Н+ + 2е = Н2.
В щелочных растворах процесс идет за счет восстановления водорода их молекул воды: 2Н2О + 2е = 2ОН- + Н2.
Условием кислородной деполяризации является неравенство:
(φме)обр < (φо  )обр.
)обр.
Условием водородной деполяризации является неравенство:
(φме)обр < (φн  )обр.
)обр.
Обратимый потенциал кислородного электрода можно рассчитать по формуле Нернста: 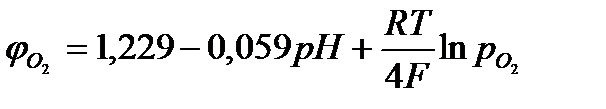 , (2)
, (2)
где р0  = 0,21атм - парциальное давление кислорода в атмосфере.
= 0,21атм - парциальное давление кислорода в атмосфере.
Обратимый потенциал водородного электрода можно рассчитать по формуле: φн  = - 0,58 рН . (3)
= - 0,58 рН . (3)
Практическая часть
Измерение стационарных потенциалов
Измерение стационарных потенциалов производится на специальной установке, включающей: милливольтметр (рН – метр), измерительную ячейку с блоком электродов и магнитной мешалкой, блок переключателей. Для выполнения работы необходимо :
1. Получить задание от преподавателя по составу рабочего раствора (0,01н. СН3СООН; 0,01н. NaHCO3) и режиму измерений .
2. Подготовить поверхность электродов: обезжирить протиркой венской известью, промыть проточной водой и просушить фильтровальной бумагой.
3. Приготовить рабочий раствор и залить его в ячейку так, чтобы его уровень не доходил до места крепления электродов к проводникам на 5-10 мм. Установить в центр крышки электрод сравнения.
4. Включить прибор в сеть дать ему прогреться 15 - 20 минут. На переключателе рода работ блока управления установить положение указателя на индекс Е – «измерение потенциалов».
5. На пульте управления рН – метра выбрать род работы – «измерение потенциалов» и размах шкалы: -100…+1900 мВ. С помощью шагового переключателя подключать поочередно исследуемые электроды к измерительной цепи. Результаты замеров занести в таблицу13.2.
Таблица 13.2 - Результаты измерений
| Материал электрода | |
| Значение потенцила, мВ |
6.Перенести данные таблицы на шкалу потенциалов (горизонтальная линия с нанесенными на нее делениями в диапазоне от +2,0 вольт до -2,0 вольт с ценой деления 0,1 В.
7. Сделать вывод о взаимном положении потенциалов различных металлов и относительной коррозионной активности этих металлов.
8. Отметить положение на шкале потенциалов значений потенциалов железа, цинка и электрода железо/цинк. Сделать вывод о положении потенциала железо/цинк относительно потенциалов собственно цинка и железа, оценить смещение потенциала пары относительно индивидуальных электродов и сделать вывод о поляризации железа и цинка при их совместной коррозии.
9. Измерить рН рабочего раствора и рассчитать стандартные потенциалы водородного и кислородного электродов. Сопоставить полученные значения с результатами измерения потенциалов сделать вывод, какой механизм электродной деполяризации характерен для каждого из изучаемых металлов.
10. Сопоставить очередность расположения металлов в таблице стандартных потенциалов и на шкале потенциалов. В случае изменений в очередности расположения металлов в таблице и на шкале потенциалов объяснить наблюдаемые отклонения.
Измерение токов коррозии при протекторной защите.
Для изучения процессов, протекающих на поверхности раздела металл-раствор при погружении в раствор короткозамкнутой пары металлов переключатель перевести из положения "Потенциал" в положение "Ток". При этом к входу рН- метра подключается железный электрод, ко второму входу будет подключен тот электрод, которому соответствует положение основного переключателя, например, цинк. В таком положении пара электродов соединена через электрическое сопротивление между собой. При этом металлический цинк будет растворяться, а на железе будет протекать процесс катодной деполяризации, т.е. само железо будет тем самым защищено от коррозионного разрушения. В процессе коррозии железа и цинка электроны будут перетекать от более отрицательного цинка к более положительному железу через соединяющее их сопротивление. В этой цепи возникнет электрический ток. При протекании тока через сопротивление на нем происходит падение потенциала, которое и измеряется милливольтметром. Исходя из величины напряжения, измеренного с помощью милливольтметра (в вольтах) и величины сопротивления (10000 Ом ) рассчитывают силу тока коррозии по закону Ома: I = U/R
Измерьте рабочую поверхность цинкового электрода и рассчитайте плотность тока коррозионного разрушения цинка в единицах: ампер/м2. Из этих данных рассчитайте время коррозионного разрушения цинкового покрытия на стальной детали площадью 1 м2 и толщиной покрытия 0,1 мм, если плотность цинка 7,1 г/см3 , а его электрохимический эквивалент q = 1,22 г/а -час, используя закон Фарадея:
m = qIt (4)
где m - масса металла в граммах, q - электрохимический эквивалент в г/а-час; I- сила тока в амперах, t – время в часах.
Вопросы для самоконтроля
1. Дайте определение следующим терминам: стандартный электродный потенциал; обратимый электродный потенциал; стационарный электродный потенциал.
2. Как определить возможный механизм катодной деполяризации процесса коррозии металла по величине его электродного потенциала?
3. Назовите причину отклонения стационарного потенциала металла в процессе коррозии от его стандартного потенциала.
4. Как рассчитать время защитного действия защитного покрытия на поверхности металла при его коррозии?
5. Какие металлы из приведенных в таблице стандартных потенциалов могут быть использованы для электрохимической защиты железа?
6.Как увеличить время защитного действия цинкового покрытия?
Лабораторная работа № 14
Дата добавления: 2018-04-05; просмотров: 1408; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
