Изучение процесса адсорбции на твердом сорбенте
Цель работы -изучить зависимость адсорбции уксусной кислоты на активированном угле от концентрации раствора и определить постоянные в уравнении Фрейндлиха для случая адсорбции уксусной кислоты на активированном угле.
Теоретическая часть
Адсорбцией называется концентрирование какого-либо вещества в поверхностном слое в результате самопроизвольного его перехода из объёма фазы.
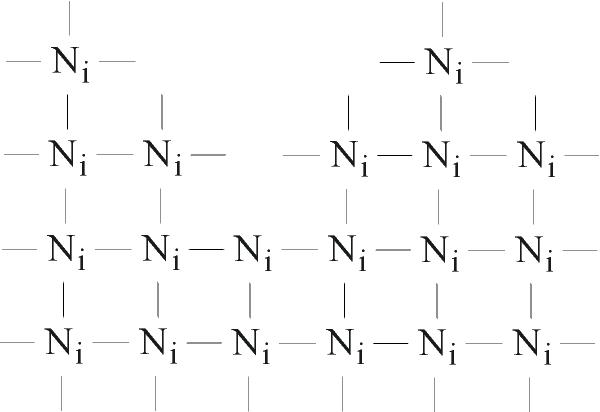 Адсорбция, или поглощение растворённого вещества твёрдой поверхностью адсорбента, происходит благодаря межмолекулярному взаимодействию активных центров адсорбента и молекул растворённого вещества. Все адсорбенты характеризуются высокой удельной поверхностью (по этому параметру они близки к коллоидальным системам), так как имеют большую шероховатость и множество капилляров. Активные центры адсорбента находятся на пиках, выступах твёрдой поверхности (рисунок 8.1).
Адсорбция, или поглощение растворённого вещества твёрдой поверхностью адсорбента, происходит благодаря межмолекулярному взаимодействию активных центров адсорбента и молекул растворённого вещества. Все адсорбенты характеризуются высокой удельной поверхностью (по этому параметру они близки к коллоидальным системам), так как имеют большую шероховатость и множество капилляров. Активные центры адсорбента находятся на пиках, выступах твёрдой поверхности (рисунок 8.1).
| Рисунок 8.1 - Схематическое изображение адсорбента скелетного никеля |
Экспериментально адсорбцию растворённых веществ на твёрдой поверхности обычно изучают, измеряя концентрацию до того, как раствор был в контакте с адсорбентом (начальная – 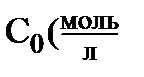 )) и после наступления адсорбционного равновесия (равновесная концентрация -
)) и после наступления адсорбционного равновесия (равновесная концентрация - 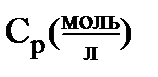 ). Поверхность твёрдого адсорбента пористая и величину поверхности измерить, как правило, очень сложно. Поэтому адсорбцию на твёрдой поверхности относят не к единице поверхности, а к единице массы адсорбента.
). Поверхность твёрдого адсорбента пористая и величину поверхности измерить, как правило, очень сложно. Поэтому адсорбцию на твёрдой поверхности относят не к единице поверхности, а к единице массы адсорбента.
|
|
|
Количество адсорбированного из раствора вещества находят по разности концентраций его до и после адсорбции ( 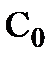 и
и 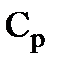 ):
):
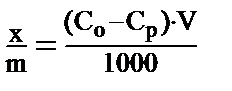 (1)
(1)
где  - удельная адсорбция
- удельная адсорбция 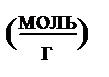 – количество адсорбированного вещества
– количество адсорбированного вещества 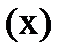 на навеску адсорбента (m); V- объём раствора в мл.
на навеску адсорбента (m); V- объём раствора в мл.
Измеряя равновесную концентрацию, надо учитывать, что адсорбционное равновесие наступает быстро лишь на гладких поверхностях. Большинство же твёрдых адсорбентов пористы и скорость адсорбции зависит от скорости диффузии вещества в порах. При адсорбционном равновесии скорость процесса адсорбции равна скорости процесса десорбции.
Зависимость адсорбции растворённых веществ от концентрации их в растворе выражается уравнением изотермы адсорбции Фрейндлиха (2).
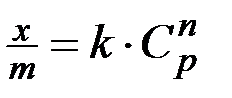 (2)
(2)
где  – концентрация растворённого вещества, k и n - постоянные уравнения Фрейндлиха.
– концентрация растворённого вещества, k и n - постоянные уравнения Фрейндлиха.
|
|
|
Уравнение Фрейндлиха справедливо для участка АВ изотермы адсорбции (рисунок 8.2), т. к. уравнение (2) - уравнение кривой. Для нахождения постоянных k и n прологарифмируем уравнение (2) и получим выражение 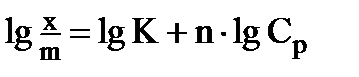 . Построим график зависимости
. Построим график зависимости 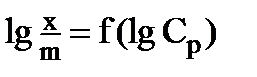 (рисунок 8.3).
(рисунок 8.3).
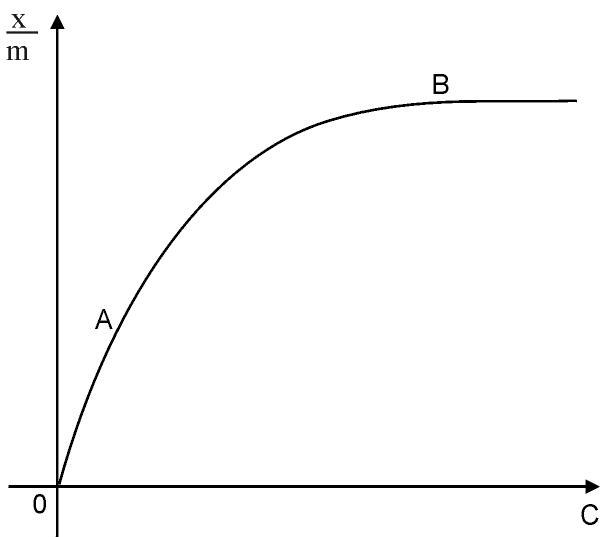
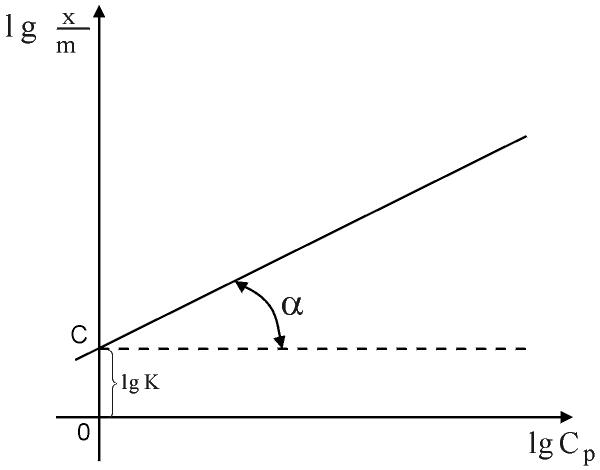
Рисунок 8.3 - Зависимость 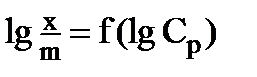
|
| Рисунок 8.2 - Изотерма адсорбции |
Прямая 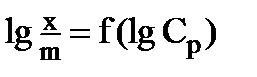 отсекает на оси ординат отрезок ОС, который равен lgK, а тангенс угла наклона прямой (
отсекает на оси ординат отрезок ОС, который равен lgK, а тангенс угла наклона прямой ( 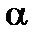 ) есть постоянная n, т.е.
) есть постоянная n, т.е. 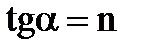 , где 0 < n < 1.
, где 0 < n < 1.
Практическая часть
Измерение адсорбции уксусной кислоты на поверхности угля
Для выполнения работы необходим исходный раствор уксусной кислоты с концентрацией 2н., последовательным его разбавлением приготовьте ряд растворов (объём раствора и концентрации указаны в таблице 8.1).
Таблица 8.1 - Объёмы и концентрации исходных растворов CH3COOH
| Номер колбы | №1 | №2 | №3 | №4 | №5 | №6 |
| Объём (мл) | 50 | 50 | 50 | 50 | 50 | 50 |
| С0 (СН3СООН), н | 0,4 | 0,2 | 0,1 | 0,05 | 0,025 | 0,0125 |
В каждую колбу (с 50 мл раствора) внесите по 1,5 г активированного угля, и тщательно перемешайте растворы во всех колбах в течение 15 минут. Затем содержимое каждой колбы отфильтруйте через бумажный фильтр в соответственно пронумерованные колбы. В полученном фильтрате определите концентрацию уксусной кислоты, оставшуюся в растворе после установления равновесия в процессе адсорбции ( 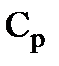 - равновесная концентрация).
- равновесная концентрация).
|
|
|
Концентрацию CH3COOH ( 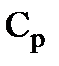 ) определите титрованием 0,1н. раствором NaOH ( индикатор – фенолфталеин), причём для титрования из колбы № 1 пипеткой отберите 5 мл фильтрата, из колбы № 2 – 10 мл, из колбы № 3 – 15 мл, из колбы № 4 – 20 мл, из колбы № 5 – 25 мл, из колбы № 6 – 50 мл фильтрата.
) определите титрованием 0,1н. раствором NaOH ( индикатор – фенолфталеин), причём для титрования из колбы № 1 пипеткой отберите 5 мл фильтрата, из колбы № 2 – 10 мл, из колбы № 3 – 15 мл, из колбы № 4 – 20 мл, из колбы № 5 – 25 мл, из колбы № 6 – 50 мл фильтрата.
Обработка результатов
Концентрацию CH3COOH ( 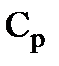 ) после титрования рассчитайте по формуле:
) после титрования рассчитайте по формуле:
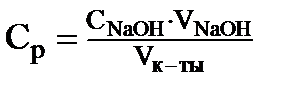 , (3)
, (3)
где 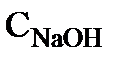 - концентрация NaOH (
- концентрация NaOH ( 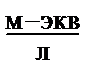 ),
),  - объём раствора NaOH , пошедший на титрование,
- объём раствора NaOH , пошедший на титрование, 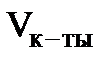 - объём фильтрата, взятый для титрования.
- объём фильтрата, взятый для титрования.
Затем по формуле (1) рассчитайте значения удельной адсорбции ( 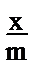 ) и заполните таблицу 8.2.
) и заполните таблицу 8.2.
Далее постройте график изотермы адсорбции (рисунок 8.2) и график зависимости 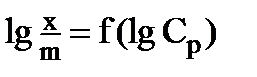 (рисунок 8.3); по последнему определите постоянные уравнения Фрейндлиха.
(рисунок 8.3); по последнему определите постоянные уравнения Фрейндлиха.
| № колбы | 
| Vк-ты | VNaOH | 
| 
| 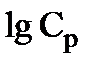
| 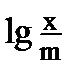
|
| 1 2 … | 0,4 0,2 … | 5 10 … |
Таблица 8.2 – Результаты эксперимента
Вопросы для самоконтроля
1. Дайте определение адсорбции и назовите ее виды.
|
|
|
2. Что такое адсорбционное равновесие? Чем обусловлена обратимость адсорбционного процесса?
3. Как определяют удельную адсорбцию при адсорбции на твёрдых адсорбентах из раствора?
4. В какой области изотермы применимо уравнение Фрейндлиха?
5. Как сместилась бы изотерма адсорбции для изучаемой системы при температуре более высокой или более низкой?
6. Приведите примеры процессов адсорбции, абсорбции, хемосорбции.
7. В результате адсорбции активированным углем уксусной кислоты, концентрация ее снизилась с 1,5 М раствора до 1,0 М раствора. Определить количество поглощенной уксусной кислоты, если первоначальный объем составлял 5 л.
8. Равные объемы 1н. и 0,1н. растворов уксусной кислоты взбалтывались с равными навесками активированного угля. Одинаковые ли количества уксусной кислоты адсорбировались из обоих растворов? Ответ поясните.
9. Какие вещества являются хорошими адсорбентами? Приведите примеры.
Лабораторная работа № 9
Дата добавления: 2018-04-05; просмотров: 722; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
