Обработка результатов эксперимента
1. Относительную массу осадка Qв данный момент времени рассчитайте по формуле:
Q = 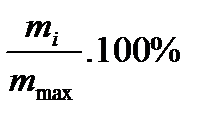 ,
,
где т -масса осадка на чашечке весов в данный момент времени; mmax -максимальная масса осадка на чашечке весов, она равна массе всех частиц, которые находятся в столбе жидкости над чашечкой весов.
Qmax= S ∙ h ∙ c ∙ 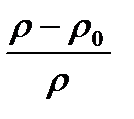 ,
,
где S - площадь чашечки весов, см2; h -высота слоя суспензии над чашечкой, см (h = 10 см); с - содержание сухого вещества в рабочей суспензии, мг/дм3, 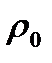 - плотность дисперсионной среды,
- плотность дисперсионной среды,  воды = 1,000 г/см3, или 1,00.103 кг/м3;
воды = 1,000 г/см3, или 1,00.103 кг/м3; 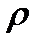 - плотность частиц дисперсной фазы,
- плотность частиц дисперсной фазы, 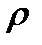 глины = 2,54.103 кг/м3.
глины = 2,54.103 кг/м3.
2. По результатам анализа постройте кривую седиментации в координатах Q % = f (t). Кривая, выражающая зависимость должна быть плавной. Линия графика зависимости должна проходить насколько возможно близко к экспериментальным точкам, однако не обязательно через каждую из них; число точек по обе стороны линии должно быть приблизительно одинаковым.
3. Определите максимальный rmax и минимальный rmin радиусы частиц суспензии по кривой седиментации и уравнениям (11) и (12). В уравнения подставьте значение времени τ в с, высоты слоя суспензии h в см; вязкость воды примите равной 1∙10-3 Па∙с, радиусы частиц суспензии выразите в метрах.
Вопросы для самоконтроля
1. Какие системы называются суспензиями?
2. Какие размеры имеют частички дисперсной фазы в суспензиях?
|
|
|
3. Приведите примеры суспензий.
4. В чем заключается седиментационный анализ суспензий и порошков? Каково его значение?
5. Как на основе кривой седиментации определить максимальный и минимальный радиусы частиц дисперсной фазы?
6. Какие условия должны выполняться, чтобы была возможность использовать седиментационный анализ?
7. Для очистки водопроводной воды от взвешенных частиц глины, песка добавляют небольшое количество сульфата алюминия. Почему наблюдается быстрое оседание частиц?
8. Скорость оседания частиц монодисперсной суспензии равна 0,105 см/с. Определите радиус частиц, приняв вязкость воды 0,001 Па·с, плотность вещества частиц 5000кг/м3.
Лабораторная работа № 7
Измерение поверхностного натяжения водных растворов ПАВ
Цель работы - освоить методику определения поверхностного натяжения растворов с помощью сталагмометра; определить поверхностное натяжение серии растворов предложенного спирта в воде; построить изотерму адсорбции спирта на поверхности раздела жидкость - газ.
Теоретическая часть
| Рисунок 7.1 - Двухфазная система газ - жидкость |
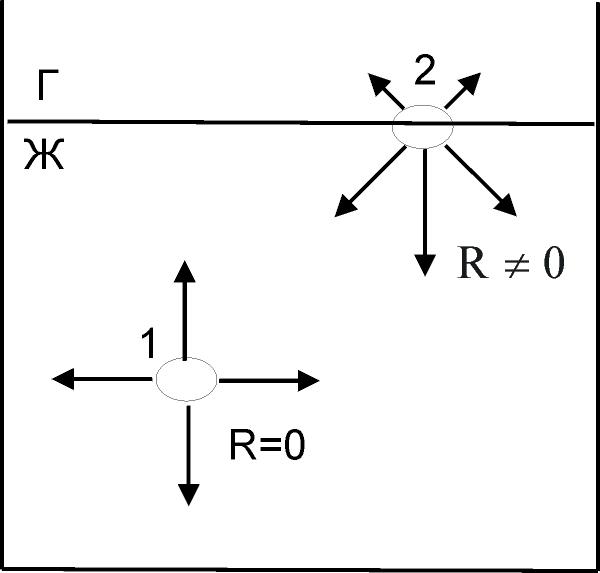 Молекулы, находящиеся на границе раздела фаз, отличаются по своим свойствам от молекул, находящихся в глубине фазы.Рассмотрим двухфазную систему газ - жидкость (рисунок 7.1). Выберем молекулу жидкости (1) в глубине фазы, она окружена точно такими же молекулами и взаимодействует со всеми соседями одинаково, т.е. равнодействующая всех сил взаимодействия этой молекулы равна нулю. Теперь возьмём молекулу на поверхности раздела газ-жидкость (2). С одной стороны эта молекула жидкости взаимодействует с молекулами газа, с другой стороны – с молекулами жидкости. Сила взаимодействия между молекулами жидкости, конечно, превосходит силу взаимодействия молекул жидкости с молекулами газа (N2, O2 – молекулы, способные к очень слабому молекулярному взаимодействию).
Молекулы, находящиеся на границе раздела фаз, отличаются по своим свойствам от молекул, находящихся в глубине фазы.Рассмотрим двухфазную систему газ - жидкость (рисунок 7.1). Выберем молекулу жидкости (1) в глубине фазы, она окружена точно такими же молекулами и взаимодействует со всеми соседями одинаково, т.е. равнодействующая всех сил взаимодействия этой молекулы равна нулю. Теперь возьмём молекулу на поверхности раздела газ-жидкость (2). С одной стороны эта молекула жидкости взаимодействует с молекулами газа, с другой стороны – с молекулами жидкости. Сила взаимодействия между молекулами жидкости, конечно, превосходит силу взаимодействия молекул жидкости с молекулами газа (N2, O2 – молекулы, способные к очень слабому молекулярному взаимодействию). |
|
|
Равнодействующая сил взаимодействия такой молекулы с соседними имеет некоторую величину и направлена внутрь жидкости перпендикулярно поверхности раздела.
Равнодействующая всех сил притяжения поверхностных молекул жидкости, отнесённая к единице поверхности, называется внутренним давлением.
Из всего вышесказанного вытекает, что при данной температуре внутреннее давление жидкости, контактирующей с воздухом, тем больше, чем выше полярность молекул этой жидкости, так как с увеличением полярности молекул будет увеличиваться и сила межмолекулярного взаимодействия.
|
|
|
Естественно, что с повышением температуры жидкости силы межмолекулярного взаимодействия уменьшаются, соответственно, и внутреннее давление также уменьшается.
Так как для молекулы (1) R = 0, то работа по перемещению молекулы внутри объёма жидкой фазы (без учёта силы трения) равна нулю, если же мы будем перемещать молекулу из объёма в поверхностный слой, то работа будет совершаться против внутреннего давления (т. е. против сил межмолекулярного взаимодействия).
Эта работа (А) против сил межмолекулярного взаимодействия (или эквивалентная ей свободная энергия (F) единицы поверхности), необходимая для образования единицы поверхности в изотермическом процессе, называется поверхностным натяжением –  (
( 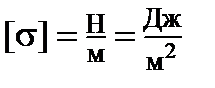 ).
).
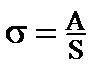 или
или  , (1)
, (1)
Поверхностное натяжение, как и внутреннее давление, является мерой полярности жидкости и тем больше, чем больше полярность жидкости.
Поверхностное натяжение растворов может быть и больше, и меньше поверхностного натяжения растворителя. При растворении веществ менее полярных, чем растворитель, поверхностное натяжение уменьшается и такие менее полярные, чем растворитель, вещества называются поверхностно- активными веществами (ПАВ).
|
|
|
Рассмотрим более подробно действие ПАВ. Возьмём смесь воды и этилового спирта 1:1. Вода является более полярной жидкостью, чем этанол, так при 25 0С:
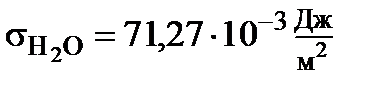 ,
, 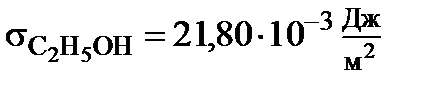 .
.
Молекулы, имеющие в своем составе полярную группу (-ОН) и неполярный углеводородный радикал, называются дифильными молекулами и являются ПАВ. К таким дифильным молекулам относятся, например, органические кислоты, спирты, аминокислоты, и т. д.
Обозначим молекулу H2O символом Δ, а дифильную молекулу C2H5OH символом ~ . Тепловое движение будет стремиться равномерно распределить молекулы воды и спирта. Так как была взята смесь воды и спирта 1:1, то распределение молекул на поверхности должно быть следующее:
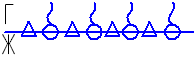
Но на поверхностные молекулы действует сила внутреннего давления и для более полярной молекулы воды эта сила внутреннего давления больше, чем у спирта и тогда должно быть:
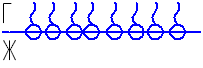
Однако, при таком распределении возникает слишком большая разница в концентрации молекул H2O и C2H5OH на поверхности и в объёме, что является условием возникновения процесса диффузии, который приводит к некоторому выравниванию концентрации. В результате наблюдается следующее распределение молекул на поверхности:

Итак, для раствора спирта в воде концентрация спирта (растворённого вещества) на поверхности больше, чем в объёме раствора. Такое самопроизвольное изменение концентрации растворённого вещества на поверхности по сравнению с концентрацией его в объёме называется адсорбцией.
Адсорбцию называют положительной, когда концентрация растворённого вещества на поверхности больше, чем в объёме; в противном случае адсорбция называется отрицательной.
Правило Гиббса: вещества, понижающие поверхностное натяжение при растворении, адсорбируются положительно, и наоборот. Количественной характеристикой адсорбции является удельная адсорбция (поверхностный избыток) – [Г] = моль / м2.
 (2)
(2)
где n - число молей растворённого вещества, S – площадь поверхностного слоя.
Удельная адсорбция и поверхностное натяжение связаны уравнением изотермы адсорбции Гиббса (3):
 (3)
(3)
где C - концентрация растворённого вещества, моль/л; R- газовая постоянная, 8,31 Дж/моль∙К; Т - температура, К
Уравнение Гиббса справедливо для разбавленных растворов на начальном участке изотермы адсорбции Г = f (C) (рисунок 7.3)
Для определения поверхностного натяжения по методу счёта капель используют прибор, называемый сталагмометром. Нижний конец сталагмометра отшлифован в форме плоского диска для получения одинаковых капель правильной формы. Вытекающая из сталагмометра жидкость собирается в каплю, висящую на нижнем диске сталагмометра. Капля отрывается от поверхности диска в тот момент, когда сила тяжести на ничтожно малую величину превысит силу поверхностного натяжения, удерживающего каплю. Чем больше объём капли, тем больше и её вес, а, следовательно, и поверхностное натяжение удерживающее ее, и тем меньше число капель, находящихся в фиксированном объёме жидкости в сталагмометре.
Зная поверхностное натяжение воды, можно рассчитать поверхностное натяжение раствора по формуле:
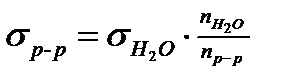 , (4)
, (4)
где σр-р - поверхностное натяжение раствора;  - поверхностное натяжение H2O (по табл. 7.1 или прил. 1);
- поверхностное натяжение H2O (по табл. 7.1 или прил. 1);  - число капель воды в фиксированном объёме сталагмометра; nр-р - число капель раствора в том же объёме.
- число капель воды в фиксированном объёме сталагмометра; nр-р - число капель раствора в том же объёме.
Практическая часть
1. Приготовление исходных растворов спирта
Возьмите 6 стаканчиков на 50 мл и пометьте их восковым карандашом. В стакане № 1 приготовьте 20 мл раствора бутилового спирта/изобутилового спирта с концентрацией 0,2 моль/л. В остальные стаканчики налейте по 10 мл дистиллированной воды. Далее наберите пипеткой 10 мл раствора бутанола из стакана № 1 и перенесите в стакан № 2, перемешайте раствор. Наберите пипеткой 10 мл раствора из стаканчика №2 и перенесите в стаканчик № 3 и т. д. Поступая таким образом, получим 6 растворов с последовательно убывающей концентрацией бутилового (изоамилового ) спирта. Если через n обозначить порядковый номер раствора, то концентрация растворов будет:
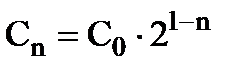 , (5)
, (5)
где С0 = 0,2 М.
2. Непосредственные измерения на сталагмометре
Сначала определите число капель воды, содержащейся во всём объёме сталагмометра. Сталагмометр промойте дистиллированной водой. Затем наберите в сталагмометр дистиллированную воду до верхнего деления шкалы, снимите фильтровальной бумагой каплю, висящую на нижнем конце сталагмометра и, открыв зажим, подсчитайте число капель воды, самопроизвольно вытекающих из сталагмометра.
Аналогично проведите определение числа капель для всех растворов спирта, начиная с раствора самой низкой концентрации. По формуле (4) рассчитайте  , поверхностное натяжение воды (
, поверхностное натяжение воды (  ) возьмите из таблицы 7.1 или приложения 1. Результаты расчётов
) возьмите из таблицы 7.1 или приложения 1. Результаты расчётов  занесите в таблицу 7.2.
занесите в таблицу 7.2.
Таблица 7.1 - Поверхностное натяжение воды при различных температурах (Дж/ м2).
| toC | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 |
| σ | 73,49 | 73,34 | 73,19 | 73,05 | 72,90 | 72,75 | 72,59 | 72,44 | 72,28 |
Обработка результатов
Конечная цель – построение изотермы адсорбции Г = f(C). Удельную адсорбцию (Г) для каждой концентрации находят графически. Для этого по полученным экспериментальным данным постройте на миллиметровой бумаге плавную кривую 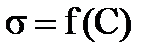 (рисунок 7.2). Целесообразно для этого выбрать наиболее крупный масштаб (по оси ординат откладывайте
(рисунок 7.2). Целесообразно для этого выбрать наиболее крупный масштаб (по оси ординат откладывайте  не от нуля, а от наименьшего измеренного значения).
не от нуля, а от наименьшего измеренного значения).


| Рисунок 7.3 - Изотерма адсорбции бутилового спирта на поверхности водного раствора |
Рисунок 7.2-Зависимость 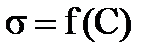
|
К кривой 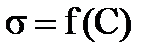 в шести точках постройте касательные и продолжайте их до пересечения с осью ординат (рисунок 7.2). Через точку, к которой построена касательная, проведите прямую, параллельную оси абсцисс и получите отрезок А. Длина отрезка А (в Дж/м2).
в шести точках постройте касательные и продолжайте их до пересечения с осью ординат (рисунок 7.2). Через точку, к которой построена касательная, проведите прямую, параллельную оси абсцисс и получите отрезок А. Длина отрезка А (в Дж/м2).
 или
или  (6)
(6)
Подставив в уравнение Гиббса:  значение
значение  из формулы (6), получите расчётную формулу для поверхностного избытка Г:
из формулы (6), получите расчётную формулу для поверхностного избытка Г:
 (7)
(7)
где А - величина, полученная из графика (Дж/м2); R = 8,31 Дж/моль∙К; T – в градусах по шкале Кельвина; Г – удельная адсорбция (моль/м2)
Результаты расчётов занесите в таблицу 7.2. По расчётным данным постройте изотерму адсорбции 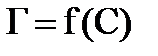 (рисунок 7.3).
(рисунок 7.3).
Таблица 7.2 - Экспериментальные и расчётные данные
С(  ) )
| число капель, n | σ 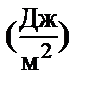
| А 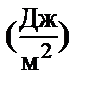
| Г 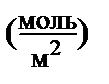
|
Вопросы для самоконтроля
1. Что называется внутренним давлением жидкости, поверхностным натяжением жидкости?
2. Как зависит внутреннее давление и поверхностное натяжение от полярности жидкости?
3. Какие вещества называются ПАВ, ПИАВ?
4. Что называется адсорбцией? Назовите правило Гиббса.
5. Уравнение изотермы адсорбции Гиббса. В какой области изотермы применимо уравнение Гиббса?
6. Как определить поверхностное натяжение растворов методом счета капель?
7. Как изменится поверхностное натяжение воды после добавления к ней равного объема этилового спирта?
8. Как изменится число капель в единице объема жидкости по мере увеличения в ней концентрации ПАВ?
9. Почему с ростом концентрации спирта увеличивается количество капель, вытекающих из сталагмометра?
10. Приведите положительные и отрицательные примеры адсорбции?
Лабораторная работа №8
Дата добавления: 2018-04-05; просмотров: 639; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
