Определение константы скорости гидролиза сахарозы
Цель работы -ознакомление с кинетикой протекания химических процессов и понятиями: молекулярность и порядок химических реакций.
Теоретическая часть
1. Скоростью химических реакций называется изменение концентрации любого из участвующих в реакции веществ в единицу времени:
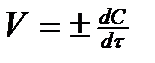 . (1)
. (1)
Согласно закону действующих масс: скорость реакции пропорциональна произведению концентраций реагирующих веществ в степенях, соответствующих их стехиометрическим коэффициентам в уравнении реакции.
Поэтому для реакции : aA + bB ⇆ cC + dD
можно записать: 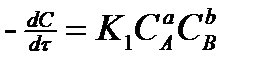 (2)
(2)
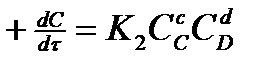 (3)
(3)
где K1 -константа скорости прямой реакции; K2-константа скорости обратной реакции.
Показатели степени a, b, c, d в уравнениях могут быть равны нулю, если данное вещество берётся в избытке, т. к. при этом его концентрация в реакции практически не меняется.
Константа скорости химической реакции численно равна скорости химической реакции при концентрациях реагирующих веществ, равных единице. Константа скорости химической реакции зависит от природы реагирующих веществ, температуры, наличия катализатора.
2. Каждая реакция характеризуется молекулярностью и порядком.
Молекулярность – наименьшее число частиц, принимающих участие в реакции.
Например, для реакции 2H2+O2 → 2H2O молекулярность равна трём, а для реакции С12H22O11 + H2O → C6H12O6 + C6H12O6 равна двум.
Порядок химической реакции равен сумме показателей степеней в выражениях для концентрации в кинетических уравнениях реакций. Порядок реакции не может быть больше трёх, так как с точки зрения вероятности и стехиометрии одновременно больше трёх частиц сталкиваться не может. Если в реакции участвует большее число частиц, то их взаимодействие происходит ступенчато, последовательно.
Существуют реакции первого, второго, третьего и нулевого порядка. Порядок реакции часто не совпадает с её молекулярностью. Например, все реакции гидролиза бимолекулярны, а порядок их первый, так как концентрация воды в этих реакциях практически не меняется, потому что вода берётся в большом избытке.
Реакции нулевого порядка. Это обычно гетерогенные реакции, которые протекают на поверхности раздела фаз. Например, реакция омыления эфира щелочью.
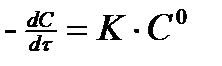 (4)
(4)
При омылении эфира щёлочью концентрация эфира и щёлочи на поверхности раздела двух жидкостей, где протекает реакция, не меняется.
Реакции первого порядка. Реакции изотермического гидролиза, термического разложения сложных веществ и т. д.
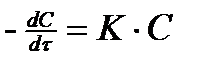 (5)
(5)
Поделим переменные и проинтегрируем
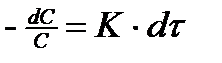
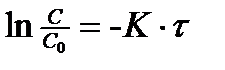 (6)
(6)
Уравнение (5) - кинетическое уравнение реакции первого порядка в дифференциальном виде, а уравнение (6) – в интегральном виде.
Реакции второго порядка.
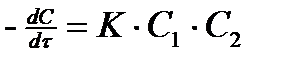 (7)
(7)
В простейшем случае при С1 = С2 = С получим  , тогда
, тогда 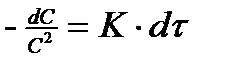 или в интегральном виде
или в интегральном виде
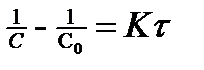 (8)
(8)
3. Определение порядка реакции графо-аналитическим методом.
Снимают зависимость 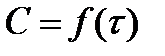 , т. е. измеряют концентрацию одного из участвующих в реакции веществ через определённые промежутки времени. Далее подставляют эти значения в интегральные кинетические уравнения реакций соответствующего порядка.
, т. е. измеряют концентрацию одного из участвующих в реакции веществ через определённые промежутки времени. Далее подставляют эти значения в интегральные кинетические уравнения реакций соответствующего порядка.
Так, если подставить значения 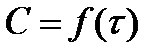 в уравнение
в уравнение 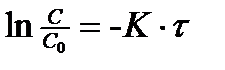 или
или 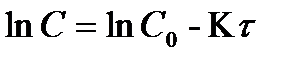 , то на графике
, то на графике 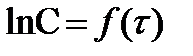 должна получиться прямая линия, если реакция действительно первого порядка, т. к. уравнение (6) - это уравнение прямой линии. Причём из графика можно определить постоянные уравнения (6). Тангенс угла наклона прямой
должна получиться прямая линия, если реакция действительно первого порядка, т. к. уравнение (6) - это уравнение прямой линии. Причём из графика можно определить постоянные уравнения (6). Тангенс угла наклона прямой 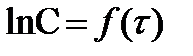 равен “K”, а отрезок, отсекаемый на оси ординат, равен
равен “K”, а отрезок, отсекаемый на оси ординат, равен  . Если прямой не получается, то реакция имеет иной порядок и данные необходимо подставить в кинетическое уравнение другого порядка.
. Если прямой не получается, то реакция имеет иной порядок и данные необходимо подставить в кинетическое уравнение другого порядка.
4. Гидролиз сахарозы
При гидролизе сахарозы (С12H22O11) получаются две гексозы - глюкоза и фруктоза (C6H12O6).
C12H22O11 + H2O → C6H12O6 + C6H12O6
И сахароза, и продукты её гидролиза содержат ассиметричные атомы углерода, т. е. являются оптически активными веществами. При пропускании поляризованного света через раствор сахарозы плоскость поляризации будет поворачиваться по мере течения реакции – правое вращение сменяется левым.
Угол вращения плоскости поляризации связан с концентрацией раствора и толщиной слоя, через который проходит поляризованный луч, соотношением:
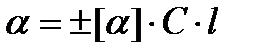 (9)
(9)
где 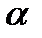 - угол вращения плоскости поляризации;
- угол вращения плоскости поляризации; 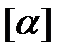 - удельный угол вращения- угол вращения при концентрации С = 1 г/мл и толщине слоя в l = 1дм.
- удельный угол вращения- угол вращения при концентрации С = 1 г/мл и толщине слоя в l = 1дм.
Угол вращения смеси оптически активных веществ представляет собой алгебраическую сумму углов вращения отдельных веществ. Сахароза имеет правое вращение 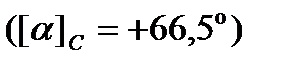 , смесь продуктов гидролиза имеет левое вращение, хотя фруктоза вращает плоскость поляризации влево
, смесь продуктов гидролиза имеет левое вращение, хотя фруктоза вращает плоскость поляризации влево 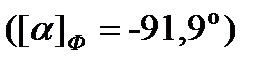 , а глюкоза вправо
, а глюкоза вправо 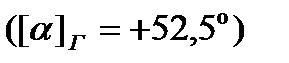 , но удельный угол вращения фруктозы больше, чем глюкозы. Поэтому в процессе протекания гидролиза угол вращения падает до нуля, а затем становится отрицательным, приближаясь к предельному значению a¥, отвечающему окончанию реакции.
, но удельный угол вращения фруктозы больше, чем глюкозы. Поэтому в процессе протекания гидролиза угол вращения падает до нуля, а затем становится отрицательным, приближаясь к предельному значению a¥, отвечающему окончанию реакции.
Гидролиз сахарозы идёт до конца и является реакцией первого порядка, так как молярная концентрация воды намного больше молярной концентрации сахарозы. Концентрацию воды по этой причине можно считать постоянной.
Основной задачей работы является определение константы скорости реакции гидролиза сахарозы. Преобразуя уравнение (6), можно получить уравнение (10), по которому и предполагается рассчитывать К
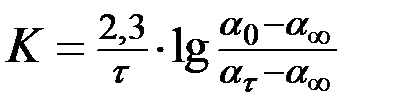 (10)
(10)
где 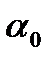 - угол вращения в момент начала реакции (находится практически);
- угол вращения в момент начала реакции (находится практически); 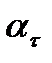 -угол вращения в момент времени
-угол вращения в момент времени  ;
;  - угол вращения, соответствующий окончанию реакции;
- угол вращения, соответствующий окончанию реакции;  - время от начала реакции.
- время от начала реакции.
Гидролиз сахарозы в нейтральной среде практически не идёт. Для проведения реакции требуется добавлять катализатор, которым являются ионы водорода, т. е. реакция проводится в кислой среде.
Практическая часть
1. Подготовка прибора
Измерение углов вращения плоскости поляризации проводятся на поляриметре СМ-2. Натриевая лампа, испускающая желтый монохроматический цвет требует прогрева около 15 минут. Поляриметрическая трубка должна быть тщательно промыта дистиллированной водой, а затем исходным раствором сахарозы.
2. Приготовление раствора и измерение углов
Работа проводится при комнатной температуре. Приготовьте 10% раствор сахарозы, для чего на технических весах взвесьте 2,5 г сахарозы, навеску поместите в мерную колбу на 25 мл и долейте до метки дистиллированной воды. Затем этот раствор перелейте в плоскодонную колбу и добавьте 25 мл 2н. раствора HСl, раствор тщательно перемешайте. Момент сливания раствора сахарозы и соляной кислоты соответствует началу реакции τ0, которому отвечает начальный угол вращения α0 (последний находят графически, см. рис. 8.1). Раствор залейте в поляриметрическую трубку. Следите за тем, чтобы в трубке с раствором не было пузырьков воздуха, которые затрудняют измерения. Поляриметрическую трубку поместите в поляриметр и произведите измерение углов вращения через каждые 10 минут после сливания растворов. Всего проведите 6…8 измерений, после чего раствор из трубки вылейте.
Смесь, оставшуюся в колбе, поместите в термостат и выдержите при 60…70 0С около 30 минут. За это время при заданной температуре процесс гидролиза практически заканчивается. После охлаждения исследуемый раствор залейте в поляриметрическую трубку и произведите измерение угла вращения, отвечающего окончанию реакции -α∞.
Обработка результатов
Результаты измерения α и расчёты занесите в таблицу 4.1.
Таблица 4.1 - Опытные и расчетные данные
| Время, τ (мин) | Угол вращения, ατ | ατ-α∞ | lg (ατ-α∞) | K |
| 10 | ||||
| 20 | ||||
| 30 | ||||
| 40 | ||||
| … |
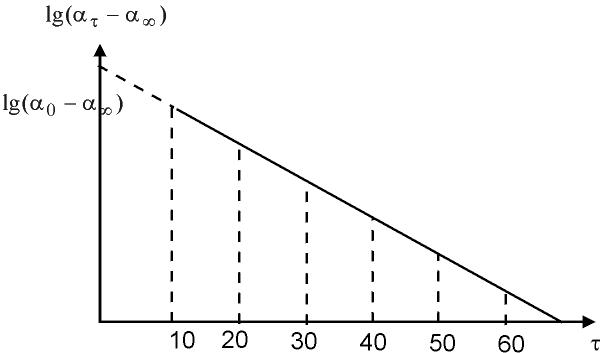 На миллиметровой бумаге постройте график зависимости скорости гидролиза от времени: lg (ατ - α∞) = f (τ), из которого экстраполяцией до τ=0 находят lg (ατ - α∞) и далее антилогарифмированием ατ - α∞ (рисунок 4.1). Данные подставьте в уравнение 10, по ко
На миллиметровой бумаге постройте график зависимости скорости гидролиза от времени: lg (ατ - α∞) = f (τ), из которого экстраполяцией до τ=0 находят lg (ατ - α∞) и далее антилогарифмированием ατ - α∞ (рисунок 4.1). Данные подставьте в уравнение 10, по ко
| Рисунок 4.1 - Зависимость lg (ατ-α∞) = f (τ) |
Вопросы для самоконтроля
1. Что называется порядком, молекулярностью реакции?
2. В каком случае молекулярность и порядок реакции могут не совпадать? Почему двумолекулярная реакция гидролиза является реакцией 1 порядка?
3. Как можно определить порядок реакции?
4. Какой физический смысл имеет константа скорости химической реакции?
5. Почему угол вращения ατ с течением времени уменьшается?
6. Что такое поляриметр?
7. Константа скорости реакции CH3COOC2H5 + NaOH = CH3COONa + C2H5OH при 318 К равна 21,6 с-1 (моль/м3)-1. Вычислите, сколько вещества прореагировало к моменту времени τ = 0,025 с, если начальные концентрации C0 = 0,9 кмоль/м3 реагирующих веществ одинаковы. Порядок реакции считать по молекулярности.
Лабораторная работа № 5
Дата добавления: 2018-04-05; просмотров: 3418; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
