Определение молярной массы неэлектролита криоскопическим методом
Министерство сельского хозяйства российской федерации
Федеральное государственное образовательное учреждение
высшего профессионального образования
«ИЖЕВСКАЯ ГОСУДАРСТВЕННАЯ СЕЛЬСКОХОЗЯЙСТВЕННАЯ АКАДЕМИЯ»
| УТВЕРЖДАЮ Проректор по учебной работе профессор П.Б.Акмаров __________________________ «_____» ____________201__г. |
Физическая и коллоидная химия
Лабораторный Практикум
Составители: В.Г. Чураков, В.А.Руденок, И.Ш.Шумилова
Ижевск
ФГОУ ВПО Ижевская ГСХА
2011г
УДК 544(076)
ББК 24.5я73-5
Ф 50
Лабораторный практикум рассмотрен и рекомендован к изданию редакционно-издательским советом ФГОУ ВПО Ижевская ГСХА, протокол № ___ от «____» __________ 2011г.
Рецензент:
Л.А.Грозина – кандидат химических наук, доцент кафедры химии и химической технологии Ижевского государственного технического университета
В.В.Сентемов – кандидат химических наук, профессор кафедры химии ФГОУ ВПО Ижевской государственной сельскохозяйственной академии
Физическая и коллоидная химия: лабораторный практикум / сост.:,
| В.Г. Чураков |
Пособие предназначено для выполнения практикума по физической и коллоидной химии студентами агроинженерного, зоонженерного, агрономического факультетов.
|
|
|
УДК 544(076)
ББК 24.5я73-5
| В.Г. Чураков |
© , Руденок В.А., Шумилова И.Ш., составление 2011.
Содержание
1. Введение 4
2. Определение молярной массы неэлектролита криоскопическим методом 6
3. Измерение электропроводности электролитов 10
4. Определение вязкости растворов 15
5. Определение константы скорости гидролиза сахарозы 21
6. Изучение микрогетерогенных систем 26
7. Седиментационный анализ суспензий и порошков 33
8. Измерение поверхностного натяжения водных растворов ПАВ 39
9. Изучение процесса адсорбции на твердом сорбенте 46
10. Получение коллоидных растворов 50
11. Изучение электролитной коагуляции 58
12. Электрофорез. Измерение величины дзета-потенциала 62
13. Образование и разрушение растворов высокомолекулярных веществ 67
14. Измерение стационарных потенциалов металлов. Измерение токов коррозии 72
|
|
|
15. Потенциометрическое титрование и определение рН 79
16. Фотоколориметрическое определение концентраций растворов 85
17. Кондуктометрическое титрование 90
18. Фотонефелометрия 95
19. Определение размеров частиц золя турбидиметрическим методом 98
20. Определения нитратов в растительной продукции и кислотности пищевых объектов потенциометрическим методом 101
21. Фотоколометрическое определение содержания лактозы в молоке и растворимых белков в мясе 108
22. Рекомендуемая литература для подготовки 113
23. Рекомендации по оформлению отчетов о лабораторных работах 114
24. Словарь 121
приложения 125
Введение
Данное пособие подготовлено на основе многолетнего опыта по проведению лабораторно-практических занятий со студентами по курсу физической и коллоидной химии и адаптировано к условиям материальной базы кафедры химии и потребностей специальных дисциплин агрономического, зооинженерного и агроинженерного факультетов ИжГСХА. Набор, компьютерная верстка ряда работ, графики и рисунки для этих работ выполнены А.В.Чураковым, за что кафедра химии выражает ему огромную благодарность.
|
|
|
Изучение физической и коллоидной химии завершает химический цикл дисциплин в сельскохозяйственных вузах, ему предшествует изучение общей и неорганической химии, органической и биологической химии.
Опыт преподавания физической и коллоидной химии показывает, что порядок выполнения лабораторных работ не удаётся сочетать с последовательностью изложения лекционного курса. Поэтому описанию каждой лабораторной работы предшествует теоретическая часть, облегчающая сознательное проведение опытов, оформление экспериментальной части и защиту лабораторной работы.
Настоящий практикум рассчитан на 30…36 часов лабораторных работ по физической и коллоидной химии. В практикуме приведено большее количество работ, чем можно выполнить за это время, для того, чтобы преподаватель имел возможность некоторого выбора в зависимости от наличия того или иного оборудования, приборов, химических реактивов.
|
|
|
Практически все работы дают возможность проводить их как учебно-исследовательские, поскольку допускают изменение режимов объектов исследования.
Данный лабораторный практикум по физической и коллоидной химии должен способствовать прочному усвоению студентами основных разделов курса. Кроме того, в процессе прохождения практикума студенты совершенствуют навыки пользования аппаратурой и приборами, обработки результатов физико-химического эксперимента с помощью аналитических и графических методов, оформления экспериментальных данных в виде наглядных цифровых и графических материалов.
Прежде чем приступить к выполнению работы, студент должен изучить соответствующий раздел теоретического курса, ознакомиться с устройством и назначением используемого в работе оборудования, уяснить цель работы и методику эксперимента. Перед началом работы преподаватель проверяет готовность студента к практикуму, проводя собеседование, и принимает решение о возможности допуска студента к эксперименту.
Выполнив работу, учащиеся оформляют в рабочем журнале (тетради) отчет о работе и предъявляют его преподавателю. Отчет должен содержать следующие элементы:
1. Название и цель работы; краткое изложение основных теоретических положений, на которых базируется данная работа.
2. Краткое описание порядка выполнения работы.
3. Результаты эксперимента в виде таблиц, куда заносятся все экспериментальные данные и результаты расчетов.
4. В случае необходимости графической интерпретации полученных результатов к отчету прилагаются графики, выполненные на миллиметровой бумаге в оптимальном масштабе.
5. Вывод по работе, соответствующий полученным результатам; если обнаружены отклонения от теоретических закономерностей, указывается их предполагаемая причина.
При выполнении лабораторных работ студенты обязаны строго соблюдать правила техники безопасности. Студенты, нарушающие правила техники безопасности, могут быть отстранены от выполнения лабораторных работ.
Лабораторная работа №1
Определение молярной массы неэлектролита криоскопическим методом
Цель работы - научиться работать с термометром Бекмана; определять криоскопическим методом молекулярную массу неэлектролита и степень диссоциации известного электролита по понижению температуры замерзания.
Теоретический материал
При любой температуре часть молекул растворителя переходит из жидкой в парообразную фазу. Пар растворителя, находящийся в равновесии с раствором при данной температуре, называется насыщенным паром. С увеличением концентрации растворяемого вещества давление насыщенного пара растворителя понижается, так как часть молекул растворителя связана молекулами или ионами растворённого вещества в гидратные или сольватные оболочки, кроме того, часть поверхности занята растворённым веществом и испарение происходит с меньшей поверхности.
Следовательно, давление насыщенного пара растворителя над раствором всегда меньше, чем над чистым растворителем, а понижение давления пара будет тем больше, чем больше концентрация растворённого вещества.
Количественно зависимость понижения давления пара растворителя от концентрации раствора выражается первым законом Рауля: относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворённого вещества в растворе.
Для растворов неэлектролитов первый закон Рауля можно записать так:
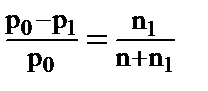 , (1) где p0 - давление насыщенного пара над растворителем, p1 - давление насыщенного пара над раствором, n1 - число молей растворённого вещества, n - число молей растворителя.
, (1) где p0 - давление насыщенного пара над растворителем, p1 - давление насыщенного пара над раствором, n1 - число молей растворённого вещества, n - число молей растворителя.
Для растворов электролитов необходимо учитывать электролитическую диссоциацию, т. к. при диссоциации молекул электролита происходит увеличение числа частиц в растворе по сравнению с числом недиссоциированных молекул. В этих случаях в закон Рауля вводится изотонический коэффициент Вант-Гоффа i, который показывает, во сколько раз количество частиц в растворе электролита (число ионов плюс число непродиссоциировавших молекул) в растворе больше числа растворённых молекул в этом веществе. И тогда для электролитов закон Рауля принимает вид:
 (2)
(2)
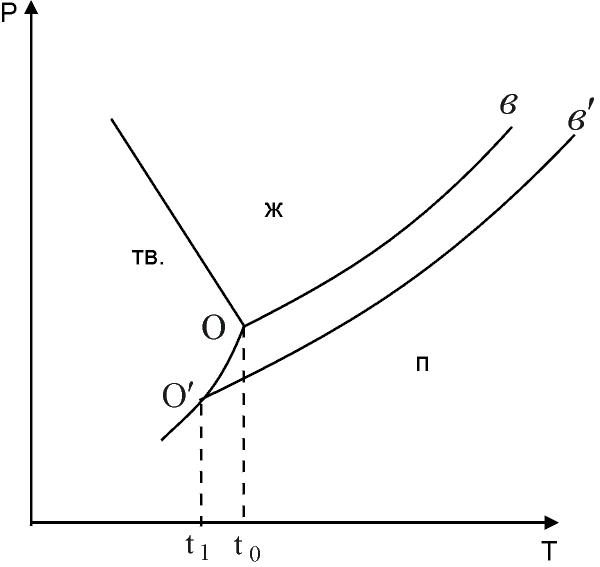 Известно, что растворы, как правило, замерзают при более низких температурах, чем чистые растворители, причём температура замерзания раствора зависит от его концентрации и природы растворителя. Объяснить понижение температуры замерзания можно по диаграмме состояния воды (рисунок 1.1).
Известно, что растворы, как правило, замерзают при более низких температурах, чем чистые растворители, причём температура замерзания раствора зависит от его концентрации и природы растворителя. Объяснить понижение температуры замерзания можно по диаграмме состояния воды (рисунок 1.1).
| Рисунок 1.1 - Диаграмма состояния воды Ов - кривая пар - жидкость для чистой воды О´в´ - кривая пар - жидкость для водного раствора |
Количественно зависимость понижения температуры замерзания от концентрации растворённого вещества для растворов неэлектролитов выражается вторым законом Рауля:
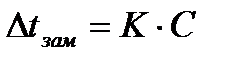 или
или 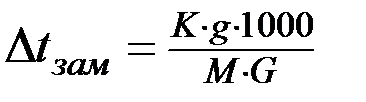 (3) где
(3) где 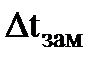 – понижение температуры замерзания раствора по сравнению с температурой замерзания чистого растворителя; K - криоскопическая постоянная; C - моляльная концентрация; g-количество граммов растворённого вещества; M - молярная масса растворённого вещества; G - количество граммов растворителя.
– понижение температуры замерзания раствора по сравнению с температурой замерзания чистого растворителя; K - криоскопическая постоянная; C - моляльная концентрация; g-количество граммов растворённого вещества; M - молярная масса растворённого вещества; G - количество граммов растворителя.
Криоскопическая постоянная К для каждого растворителя величина постоянная, так 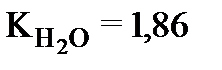 ,
, 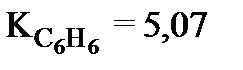 . По физическому смыслу К это понижение температуры замерзания одномоляльного раствора.
. По физическому смыслу К это понижение температуры замерзания одномоляльного раствора.
Для растворов электролитов уравнение (3) примет вид:
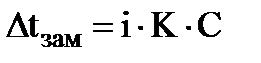
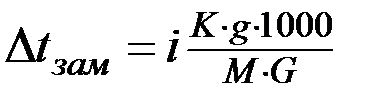 (4)
(4)
Практическая часть
1. Определение молекулярной массы неэлектролита
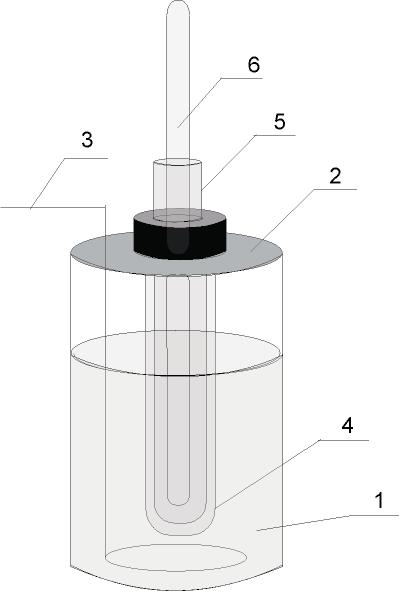 В работе используется криостат - прибор, изображённый на рисунке 1.2.
В работе используется криостат - прибор, изображённый на рисунке 1.2.
| Рисунок 1.2 - Криостат |
Настройку термометра Бекмана проводите вместе с преподавателем. Сначала определите температуру замерзания чистой воды. Для этого в пробирку 5 налейте 10 мл дистиллированной воды и поместите в неё термометр Бекмана. Затем пробирку 5 с термометром Бекмана поместите в более широкую пробирку и всё вместе поставьте в охладительную смесь. Далее приведите в действие мешалку и наблюдайте за понижением уровня ртути в термометре Бекмана.
Кристаллизация воды (как и любого раствора) сопровождается выделением тепла, т. е. с началом кристаллизации температура будет повышаться до некоторой температуры замерзания и потом некоторое время будет оставаться постоянной. Эту температуру записывают – 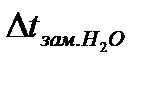
Затем в эту же пробирку поместите раствор вещества, молекулярную массу которого определяете. Для этого возьмите навеску (около 1 г) исследуемого вещества, взвешенную на аналитических весах с точностью 0,0001 г , поместите её в пробирку 5 и налейте 10 мл H2O, растворите исследуемое вещество и определите температуру замерзания раствора - 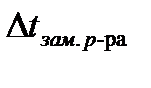 .
.
По полученным результатам рассчитайте 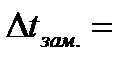
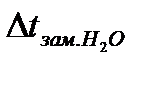 -
- 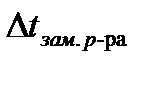 .
.
И, наконец, рассчитайте молекулярную массу исследуемого вещества:
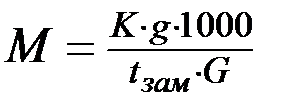 ;
; 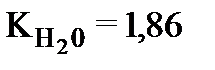 .
.
2. Определение степени диссоциации электролита
Если растворённое вещество – электролит, то число частиц в растворе не равно числу молекул и завышено вследствие распада молекул на ионы. Так, если в растворе находится С молекул электролита и степень его диссоциации 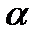 , то число молекул, распавшихся на ионы будет –
, то число молекул, распавшихся на ионы будет – 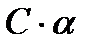 , а тогда число нераспавшихся молекул будет
, а тогда число нераспавшихся молекул будет 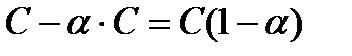 . Если молекула распадается на n ионов, то число ионов в растворе будет
. Если молекула распадается на n ионов, то число ионов в растворе будет 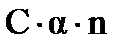 и тогда
и тогда
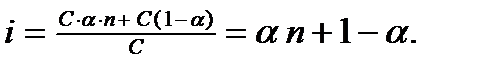
i -1 = 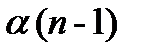
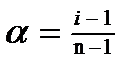 (5)
(5)
Определите температуру замерзания чистой воды, затем температуру замерзания 5% раствора NaСl. Далее рассчитайте 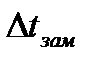 . Затем по формуле
. Затем по формуле
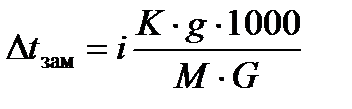
Найдите i - изотонический коэффициент Вант-Гоффа и по формуле рассчитайте - степень диссоциации NaCl при данной концентрации.
Вопросы для самоконтроля
1. Почему растворы замерзают при более низких температурах, чем чистые растворители?
2. Какой физический смысл имеет криоскопическая постоянная?
3. Чему равно i для СaCl2, если 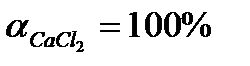 ?
?
4. Имеем два раствора: а) 1 г NaCl + 10 г H20
б) 1 г KCl + 10 г H20
Какой из указанных растворов замерзает при более низкой температуре, если 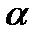 обоих веществ одинаковы?
обоих веществ одинаковы?
Лабораторная работа №2
Дата добавления: 2018-04-05; просмотров: 1614; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
