Типы связей в кристаллической решетке
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ, МОЛОДЕЖИ И СПОРТА УКРАИНЫ
ОДЕССКИЙ НАЦИОНАЛЬНЫЙ ПОЛИТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
К ИЗУЧЕНИЮ КУРСА «Материаловедение»
Для студентов специальности «Атомная энергетика» 7.050603
Утверждено
На заседании кафедры АЭС
от 17.11.2011
Протокол №3
Одесса 2011
ОСНОВЫ СТРОЕНИЯ ВЕЩЕСТВА
В основе любого материала, используемого в ядерной технике, лежит кристаллическая решетка - упорядоченное расположение атомов в пространстве.
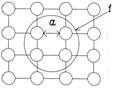
Элементарный объем, который характеризует особенности строения данного типа кристалла, называется элементарной ячейкой (1).
Многократным переносом (трансляцией) данного элемента объема в пространстве можно построить весь кристалл.
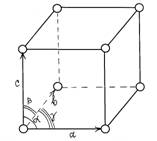
Имеется семь типов кристаллических решеток. От наиболее распространенной – кубической, у которой три базисных вектора равны между собой и углы равны между собой и равны 90˚
(a═b═c ∟α═∟β═∟γ═90˚), до наименее симметричной - триклинной (a≠b≠c ∟α≠∟β≠∟γ).
|
|
|
Девяносто процентов кристаллических материалов, используемых на АЭС, кристаллизуются в кубической форме, имеющей две разновидности:
1) объемноцентрированную структуру
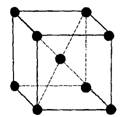
 ОЦК
ОЦК
2) гранецентрированную структуру


 ГЦК
ГЦК
Примерно 5 % используемых на АЭС материалов имеют гексагональную плотноупакованную структуру.
Каждый тип кубической кристаллической решетки соответствует определенному температурному диапазону. К примеру: ОЦК решетка для железа устойчива примерно до 910˚C. Выше этой температуры она переходит в ГЦК структуру. Аналогичное превращение кристаллических решеток характерно для всех материалов с изменением температуры. (Уран имеет 3 кристаллические модификации, плутоний – 6.)
Главной опасностью для конструкционных материалов является выход (для температурных режимов эксплуатации) за рамки диапазона стабильности данной кристаллической структуры.
|
|
|
В момент фазового превращения (перехода от одного типа решетки к другому) атомы имеют повышенную диффузионную подвижность. Это может привести к сдвигу атомных слоев друг относительно друга, привести к образованию микротрещины, которая впоследствии может развиться в макротрещину. Исход – развал конструкции.
Различные формы кристаллической структуры для одного и того же элемента обозначаются буквами:
α−Fе (ОЦК), γ−Fе (ГЦК)
Периодом решетки называется расстояние между центрами двух соседних частиц (атомов, ионов).
Под атомным радиусом мы понимаем половину межатомного расстояния (а) между центрами ближайших атомов в кристаллической решетке элемента при нормальных условиях (t = 20˚, p = 760 мм ртутного столба). Атомный радиус не является неизменной величиной, а зависит от типа решетки и типа химической связи между атомами в кристалле.
Энергия кристаллической решетки определяется как энергия, выделяемая при образовании кристалла из атомов или ионов, когда исходное состояние этих частиц газообразное.
Любая кристаллическая решетка может принять и рассеять без разрушения только ограниченное количество энергии, поступающей извне (в виде температуры, давления и радиации).
|
|
|
Типы связей в кристаллической решетке.
Для получения материалов с требуемыми свойствами необходимо знать, какие силы удерживают частицы в кристаллической решетке. Эти силы имеют электромагнитную природу, но проявляются в разных кристаллах различным образом.
Различают следующие типы связи:
- Ионная
- Ковалентная
- Металлическая
- Полярная (Ван-дер-Ваальса)
Тип связи оказывает значительное влияние на механические свойства материалов. Главным образом на то, как проявляет себя материал при воздействии внешней нагрузки: будет ли он деформироваться или в процессе роста нагрузки разрушится хрупким образом (без предварительной деформации).
I. Ионные кристаллы (NaCl, UO2, ZrO2)
Кристаллическая решетка таких кристаллов состоит из разноименно заряженных ионов(U4++2О2-),
которые образуются в результате перехода электронов от атома одного типа (урана) к атомам другого (кислорода).
Расстояние между центрами ионов в таких кристаллах определяется равновесием сил притяжения, между анионами и катионами, и сил отталкивания их электронных оболочек.
Кристаллы с ионной связью – хрупкие.
II. Атомные кристаллы(ковалентная связь)
|
|
|
Этот тип связи осуществляется обобществлением валентных электронов соседних атомов.
Связь между соседними атомами осуществляется парами электронов, находящихся на общей для них связывающей орбите.
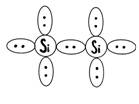
В межатомном пространстве, таким образом, формируются резко выраженные «электронные мостики». Электронная плотность вне мостиков – мала. Характерными свойствами веществ с такой связью являются:
- малая плотность;
- высокая хрупкость;
- иногда, высокая твердость (алмаз, карбиды SiC, UC, нитриды).
Материалы с ковалентным типом связи используются в полупроводниковой технике, получении новых типов ядерного топлива (UC, PuC, UN, PuN), а также являются упрочняющими фазами в высокопрочных металлических сплавах (Fe3C). Ковалентная связь широко распространена в полимерных материалах.
III. Металлическая связь
При конденсации паров металлов в жидкое или твердое состояние, их атомы сближаются настолько, что электронные орбиты их внешних электронов перекрываются. Из-за этого, валентные электроны могут свободно переходить от одного атома к другому, формируя своеобразное электронное облако. Между электронами и положительными ионами возникают силы электростатического взаимодействия, определяющие силу связи между атомами в кристалле. Наличие электронного газа (облака) и «сферической симметрии» заряда ионов обуславливает пластичность металла.
Дата добавления: 2018-04-04; просмотров: 1484; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
