Провести химические испытания на подлинность, чистоту и количественное определение натрия салицилата
| Методика проведения | Наблюдения | Выводы | |
| Свойства: белый кристаллический порошок или мелкие чешуйки, без запаха, сладковато-соленого вкуса. |
| ||
| Растворимость: очень легко растворим в воде, легко растворим в глицерине, растворим в спирте, практически не растворим в эфире. |
| ||
| Подлинность: 1. 0,05 г препарата растворяют в 4 мл воды, прибавляют 1-2 капли железа окисного хлорида; появляется сине-фиолетовое окрашивание, которое сохраняется при добавлении небольшого количества уксусной кислоты, но исчезает при добавлении раствора хлористоводородной кислоты. |
| ||
| Химизм: | |||
| Количественное определение: 1,5 г препарата (точная навеска) помещают в колбу с притертой пробкой объемом 200-250 мл, растворяют в 20 мл воды, прибавляют 45 мл эфира, 3-4 капли смешанного индикатора (1 мл метилового оранжевого и 1 мл метиленового синего) и титруют 0,5 М раствором кислоты хлористоводородной до появления сиреневой окраски в водном слое. В конце титрования содержимое колбы хорошо встряхивают. 1 мл 0,5 М раствора кислоты хлористоводородной соответствует 0,08005 г C7H5NaО3., которого в препарате должно быть не менее 99,5%. | Формула расчета содержания действующего вещества (Х%, Хг) | Расчет теоретического объема титранта (мл) | |
|
| |||
| Химизм: | |||
Задание № 5
Провести химические испытания на подлинность, чистоту и количественное определение анестезина.
|
|
|
| Методика проведения | Наблюдения | Выводы | |||
| Свойства: белый кристаллический порошок без запаха, слабогорького вкуса. Вызывает на языке чувство онемения. |
| ||||
| Растворимость:очень малорастворим в воде, легко растворим в спирте, эфире, хлороформе, трудно растворим в жирных маслах и разведенной соляной кислоте. |
| ||||
| Подлинность: 1. 0,05 г препарата растворяют в 2 мл воды, подкисленной 3 каплями разведенной соляной кислоты, прибавляют 3 капли 0,1 М раствора нитрита натрия и взбалтывают. К полученному раствору прибавляют 3 мл щелочного раствора β – нафтола – появляется вишнево-красное окрашивание или образуется оранжево-красный осадок. |
| ||||
| Химизм: | |||||
| 2. 0,05 г препарата нагревают с 5 мл раствора натрия гидроксида и приливают 0,05 М раствор йода до неисчезающего желтого окрашивания - появляется запах йодоформа. |
| ||||
| Химизм:
| |||||
| 3. 0,05 г препарата растворяют в 2 мл воды с 5 каплями разведенной соляной кислоты и прибавляют 2 мл хлорамина. Через 2-3 мин. добавляют 2 мл эфира и взбалтывают – эфирный слой окрашивается в оранжевый цвет. |
| ||||
| Химизм:
| |||||
| Количественное определение: 0,2 г препарата растворяют в 10 мл воды и 10 мл разведенной соляной кислоты. Добавляют воды до общего объема 80 мл, 1 г бромида калия и при постоянном перемешивании титруют 0,1 М раствором нитрита натрия, добавляя его в начале со скоростью 2 мл в минуту, а в конце титрования (за 0,5 мл до эквивалентного количества) по 0,05 мл через минуту.
Титрование проводят при температуре не выше 18-20°С, однако в некоторых случаях требуется охлаждение до 0-10°С. В случае применения внутренних индикаторов используют нейтральный красный или тропеолин 00 в смеси с метиленовым синим. 1 мл 0,1 М раствора нитрита натрия соответствует 0,01652 г анестезина, которого в субстанции должно быть не менее 99,5%.
| Формула расчета содержания действующего вещества (Х%, Хг) | Расчет теоретического объема титранта (мл) | |||
|
| |||||
| Химизм: | |||||
Задание № 6
Провести химические испытания на подлинность, чистоту и количественное определение прокаина гидрохлорида.

| Методика проведения | Наблюдения | Выводы | |||
| Свойства: бесцветные кристаллы или белый кристаллический порошок, без запах, горького вкуса. На языке вызывает чувство онемения. |
| ||||
| Растворимость: очень легко растворим в воде, легко растворим в спирте, малорастворим в хлороформе, практически не растворим в эфире. |
| ||||
| Подлинность: 1. 1 мл препарата подкисляют 3 каплями разведенной соляной кислоты, прибавляют 3 капли 0,1 М раствора нитрита натрия и взбалтывают; полученный раствор прибавляют к 3 мл щелочного раствора β-нафтола; появляется вишнево-красное окрашивание или образуется оранжево-красный осадок. |
| ||||
| Химизм: | |||||
| 2. К 2 мл раствора препарата прибавляют 0,5 мл разведенной азотной кислоты и 0,5 мл раствора нитрата серебра; образуется белый творожистый осадок, растворимый в растворе аммиака. |
| ||||
| Химизм:
| |||||
| 3. К 1 мл препарата прибавляют 3 капли разведенной серной кислоты и 1 мл 0,02 М раствора перманганата калия; фиолетовая окраска моментально исчезает (отличие от совкаина). |
| ||||
| Химизм:
| |||||
| 4. К 2 мл препарата прибавляют 0,5 мл раствора калия гидроксида – образуется коричне-красное окрашивание раствора. |
| ||||
| Химизм:
| |||||
| Количественное определение:К 2 мл 2% раствора прибавляют 10 мл разведенной соляной кислоты. Добавляют воды до общего объема 80 мл, 1 г бромида калия и при постоянном перемешивании титруют 0,1 М раствором нитрита натрия, добавляя его в начале со скоростью 2 мл в минуту, а в конце титрования (за 0,5 мл до эквивалентного количества) по 0,05 мл через минуту.
Титрование проводят при температуре не выше 18-20 С, однако в некоторых случаях требуется охлаждение до 0-10°С. В случае применения внутренних индикаторов используют нейтральный красный или тропеолин 00 в смеси с метиленовым синим. 1 мл 0,1 М раствора нитрита натрия соответствует 0,02728 г новокаина, которого в 1 мл препарата соответственно должно быть 0,0194 - 0,0206г. | Формула расчета содержания действующего вещества (Х%, Хг) | Расчет теоретического объема титранта (мл) | |||
|
| |||||
| Химизм: | |||||
Вывод по лабораторной работе: ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Лабораторная работа № 7
Тема:Лекарственные вещества – производные амидов сульфаниловой кислоты.
Цель:определить подлинность, доброкачественность лекарственных веществ, провести их количественное определение.
 Задание № 1
Задание № 1
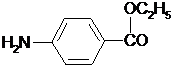
Провести химические испытания на подлинность, чистоту и количественное определение сульфаниламида.
| Методика проведения | Наблюдения | Выводы |
| Свойства: белый кристаллический порошок без запаха. | ||
| Растворимость: мало растворим в воде, легко растворим в кипящей воде, в разведенной соляной кислоте, растворах едких щелочей и ацетоне, трудно растворим в спирте, практически не растворим в эфире и хлороформе. | ||
| Подлинность: 1. 0,1 г порошка растертых таблеток взбалтывают с 3 мл ацетона, фильтруют и выпаривают досуха. Остаток дает следующие реакции подлинности: Реакция на первичные ароматические амины: к осадку приливают 2 мл воды, подкисленной 3 каплями кислоты хлористоводородной разведенной, прибавляют 3 капли 0,1 М раствора нитрита натрия и взбалтывают; полученный раствор прибавляют к 3 мл щелочного раствора β-нафтола; появляется вишнево-красное окрашивание или образуется оранжево-красный осадок. | ||
| Химизм: | ||
| 2. 0,1 г препарата нагревают в сухой пробирке на пламени горелки; образуется плав фиолетово-синего цвета и ощущается запах аммиака и анилина (отличие от других сульфаниламидных препаратов). | ||
| Химизм:
| ||
| Количественное определение: 0,2 г порошка растертых таблеток (точная навеска) растворяют в 10 мл воды и 10 мл разведенной соляной кислоты. Добавляют воды до общего объема 80 мл, 1 г бромида калия и при постоянном перемешивании титруют 0,1 М раствором нитрита натрия, добавляя его в начале со скоростью 2 мл в минуту, а в конце титрования (за 0,5 мл до эквивалентного количества) по 0,05 мл через минуту. Титрование проводят при температуре не выше 18-20°С, однако в некоторых случаях требуется охлаждение до 0-10°С. В случае применения внутренних индикаторов используют тропеолин 00 в смеси с метиленовым синим. 1 мл 0,1 М раствора нитрита натрия соответствует 0,01722 г С6Н8N2О2, которого соответственно должно быть 0,285-0,315 г или 0,475-0,525 г, считая на средний вес одной таблетки.
| Формула расчета содержания действующего вещества (Х%, Хг) | Расчет теоретического объема титранта (мл) |
| Химизм: | ||
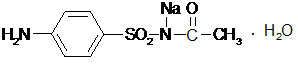 Задание № 2
Задание № 2
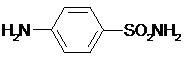
Провести химические испытания на подлинность, чистоту и количественное определение сульфацил - натрия
| Методика проведения | Наблюдения | Выводы |
| Свойства: белый кристаллический порошок без запаха. | ||
| Растворимость: малорастворим в воде, легко растворим в кипящей воде, в разведенной соляной кислоте, растворах едких щелочей и ацетоне, трудно растворим в спирте, практически нерастворим в эфире и хлороформе. | ||
| Подлинность: 1. К 2 мл препарата прибавляют 1 мл раствора сульфата меди; образуется осадок голубовато-зеленого цвета, который не изменяется при стоянии. | ||
| Химизм: | ||
| Количественное определение: На призму рефрактометра наносят несколько капель воды и по шкале находят показатель преломления. Вытирают призму досуха, наносят на нее несколько капель испытуемого раствора и находят показатель преломления, который определяют 3-4 раза. Для расчета берут среднее из всех определений. Величина прироста показателя преломления при увеличении концентрации на 1% - 0,00213.
| Формула расчета содержания действующего вещества (Х%, Хг) | |
| n1 = n2 = n3 = nсреднее =
Х =
| ||
| Химизм: | ||
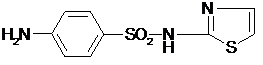 Задание № 3
Задание № 3
Провести химические испытания на подлинность, чистоту и количественное определение норсульфазола.
| Методика проведения | Наблюдения | Выводы |
| Свойства: белый или белый со слегка желтоватым оттенком кристаллический порошок без запаха. | ||
| Растворимость: очень мало растворим в воде, мало растворим в спирте, трудно растворим в ацетоне, практически не растворим в эфире, растворим в разведенных минеральных кислотах и растворах едких и углекислых щелочей. | ||
| Подлинность: 1. 0,05 г препарата растворяют в 2 мл воды, подкисленной 3 каплями кислоты хлористоводородной разведенной, прибавляют 3 капли 0,1 М раствора нитрита натрия и взбалтывают; полученный раствор прибавляют к 3 мл щелочного раствора β-нафтола; появляется вишнево-красное окрашивание или образуется оранжево-красный осадок. | ||
| Химизм: | ||
| 2. 0,1 г препарата растворяют в 3 мл воды и прибавляют 1 мл раствора сульфата меди; образуется осадок грязно-фиолетового цвета (отличие от других сульфаниламинов). | ||
| Химизм:
| ||
| 3. 0,05 г препарата нагревают в сухой пробирке на пламени горелки; образуется сплав темно-бурого цвета и ощущается резкий запах сероводорода. | ||
| Химизм:
| ||
| Количественное определение: Около 0,4 г препарата (точная навеска) растворяют в 10 мл воды и 10 мл разведенной соляной кислоты. Добавляют воды до общего объема 80 мл, 1 г бромида калия и при постоянном перемешивании титруют 0,1 М раствором нитрита натрия, добавляя его в начале со скоростью 2 мл в минуту, а в конце титрования (за 0,5 мл до эквивалентного количества) по 0,05 мл через минуту. Титрование проводят при температуре не выше 18-20 С, однако в некоторых случаях требуется охлаждение до 0-10°С. В случае применения внутренних индикаторов используют тропеолин 00. 1 мл 0,1 М раствора нитрита натрия соответствует 0,02773 г норсульфазола, которого в пересчете на сухое вещество должно быть не менее 99,0%. | Формула расчета содержания действующего вещества (Х%, Хг) | Расчет теоретического объема титранта (мл) |
| Химизм: | ||
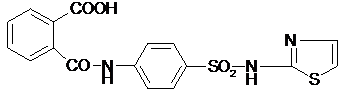
Задание № 4
Провести химические испытания на подлинность, чистоту фталазола.
| Методика проведения | Наблюдения | Выводы |
| Свойства: белый или белый со слегка желтоватым оттенком порошок. | ||
| Растворимость:практически не растворим в воде, эфире и хлороформе, очень мало растворим в спирте, растворим в водном растворе карбоната натрия, легко растворим в водном растворе натрия гидроксида. | ||
| Подлинность: 1. 0,05 г порошка растертых таблеток кипятят с 2 мл воды и 2 капли кислоты хлористоводородной разведенной в течение 1-2 минут. Полученный раствор охлаждают, прибавляют 3 капли 0,1 М раствора нитрита натрия и взбалтывают; полученный раствор прибавляют к 3 мл щелочного раствора β-нафтола; появляется вишнево-красное окрашивание или образуется оранжево-красный осадок. | ||
| Химизм: | ||
| 2. К 0,05 г препарата прибавляют 0,05 г резорцина, 1-2 капли концентрированной серной кислоты и сплавляют на пламени горелки в течение 1-2 минут. После охлаждения полученную массу растворяют в 2-3 мл раствора натрия гидроксида и выливают в воду; наблюдается ярко-зеленая флюоресценция. | ||
| Химизм:
| ||
| Примесь: 3. Норсульфазол.1 г препарата взбалтывают с 10 мл разведенной хлористоводородной кислоты в течении 15 минут и после отстаивания при комнатной температуре фильтруют. К фильтрату прибавляют 40 мл воды, 0,5 г бромида калия, 2 капли раствора тропеолина 00 и 1 каплю раствора метиленового синего и титруют 0,1 М раствором нитрита натрия по 0,05 мл через 1 минуту до зеленого окрашивания. На титрование должно расходоваться не более 0,2 мл 0,1 М раствора нитрита натрия. 1 мл 0,1 М раствора нитрита натрия соответствует 0,02553 г C9H9N3O2S2, которого должно быть не более 0,5%. При отсутствии норсульфазола от прибавления 1 капли 0,1 М раствора нитрита натрия появляется голубое окрашивание. | ||
| Химизм:
| ||
Вывод по лабораторной работе: __________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Приложение.
АНАЛИЗ ЛЕКАРСТВЕННЫХ ФОРМ
Анализ лекарственной смеси начинают обычно с органолептической проверки. Контролируется соответствие цвета, запаха, вкуса, прозрачность, однородность и т. д. Затем проверяется общая масса или объем лекарственной формы и развеска порошков на дозы. При этом необходимо руководствоваться «Нормами отклонений», утвержденными МОЗ Украины № 626 от 24.12.2004 г.
| Порошки | Жидкости | Мази | |||
| Прописанная масса, г | Отклоне-ние, % | Прописанный объем или масса, мг или г | Отклоне-ние, % | Прописанная масса, г | Отклоне-ние, % |
| До 0,1 | ±15 | До 10 | ±10 | До 5 | ±15 |
| Свыше 0,1 до 0,2 | ±10 | Свыше 10 до 20 | ±8 | ||
| » 0,2 » 0,3 | ±7 | » 20 » 50 | ±4 (5) | Свыше 5 до 10 | ±10 |
| » 0,3 » 0,5 | ±5 | ||||
| » 0,5 » 0,8 | ±4 | » 50 » 150 | ±3 | » 10 » 20 | ±8 |
| » 0,8 » 1,0 | ±3 | ||||
| » 1,0 » 2,0 | ±4 | » 150 » 200 | ±2 | » 20 » 30 | ±7 |
| » 2,0 » 5,0 | ±3 | ||||
| » 5,0 » 10,0 | ±2 | » 200 | ±1 | » 30 » 50 | ±5 |
| » 10,0 | ±1 | ||||
Определение подлинности
Анализ лекарственной формы, состоящей из одного ингредиента, прост и сводится к проведению специфической реакции на данный ингредиент.
Гораздо чаще в состав лекарства входит несколько компонентов, что создает определенные трудности при их идентификации. Сложность анализа лекарственных смесей связана с тем, что один ингредиент часто мешает открытию другого по разным причинам. Так, два или несколько ингредиентов могут реагировать с одним и тем же реактивом. Например, в лекарственной форме, в состав которой входят салициловая кислота и резорцин, оба препарата образуют с хлоридом окисного железа сине-фиолетовое окрашивание. По той же причине невозможно идентифицировать амидопирин в присутствии анальгина с помощью окислителей, натрия бензоат в смеси с натрия салицилатом с помощью хлорида окисного железа, хлориды в присутствии бромидов при помощи нитрата серебра и т. д.
Иногда препарат не удается обнаружить принятой для него реакцией в связи с тем, что выделяющееся в результате реакции вещество вступает во взаимодействие с другим компонентом лекарственной смеси. Например, невозможно обнаружить калия бромид реакцией с перманганатом калия в присутствии больших количеств натрия салицилата, так как выделяющийся бром вступает в реакцию бромирования:
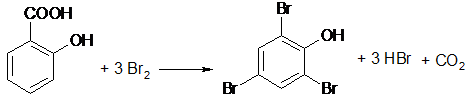
В указанных случаях часто приходится прибегать к разделению компонентов с помощью воды, органических растворителей (эфир, хлороформ и др.), кислот, щелочей.
Однако метод разделения лекарственной смеси трудоемок и длителен, в связи, с чем весьма важно пользоваться реакциями, позволяющими провести идентификацию одного компонента в присутствии другого, а в некоторых случаях использовать возможность определения подлинности двух и более ингредиентов одним реактивом или одной реакцией. Для этой цели используют следующие возможности.
1. Прибавляемый реактив реагирует сначала с одним ингредиентом, а затем со вторым. Так, в порошке следующего состава:
Кодеина 0,015
Ацетилсалициловой кислоты 0,3
прибавление к щепотке порошка 2—3 капель реактива Марки вызывает появление сине-фиолетового окрашивания (кодеин), а при легком подогревании образуется красное окрашивание (ацетилсалициловая кислота).
2. Прибавляемый реактив реагирует одновременно с двумя ингредиентами: например, к 1—2 мл микстуры, в состав которой входят бензоат и салицилат натрия, прибавляют в пробирке 1 мл хлороформа и 3—4 капли раствора сульфата меди. При встряхивании водный слой окрашивается в зеленый цвет (салицилат-ион), хлороформный — в голубой (бензоат-ион).
3. Прибавляемый реактив с одним из ингредиентов анализируемой лекарственной смеси является реактивом на второй ингредиент: например, к 1—2 каплям микстуры, содержащей гексаметилентетрамин и салицилат натрия, прибавляют в фарфоровой чашке 7—8 капель концентрированной серной кислоты и слегка подогревают. Появляется красное окрашивание вследствие образования ауринового красителя за счет конденсации салициловой кислоты и формальдегида, выделившегося в результате гидролиза гексаметилентетрамина.
4. Часто при прибавлении реактивов для идентификации одного компонента открывают последовательно остальные компоненты лекарственной смеси. Например, для идентификации анестезина в порошках состава:
Натрия гидрокарбоната
Амидопирина
Анестезина по 0,2
проводят реакцию азосочетания. К щепотке порошка в фарфоровой лодочке прибавляют 3—4 капли разведенной кислоты хлористоводородной, при этом наблюдается выделение пузырьков углекислого газа (гидрокарбонат), затем после прибавления 2—3 капель раствора нитрита натрия появляется быстро исчезающее сине-фиолетовое окрашивание (амидопирин), а от добавления щелочного раствора β-нафтола реакционная смесь окрашивается в красный цвет (анестезин).
Дата добавления: 2018-02-28; просмотров: 1287; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
