Провести химические испытания на подлинность, чистоту и количественное определение кислоты бензойной
| Методика проведения | Наблюдения | Выводы |
| Свойства: бесцветный игольчатые кристаллы или белый мелкокристаллический порошок. При нагревании возгоняется; перегоняется с водяным паром. | ||
| Растворимость: Мало растворим в воде, растворим в кипящей воде, легко растворим в спирте, хлороформе, эфире и бензоле, растворим в жирных маслах. | ||
| Подлинность: 1. 0,02 г препарата растворяют в 1,5 мл 0,1 М гидроксида натрия прибавляют 0,2 мл раствора хлорида окисного железа; появляется осадок розовато-желтого цвета. | ||
| Химизм: | ||
| 2. Окисляющие вещества 0.2 г субстанции растворяют в 10 мл кипящей воды, охлаждают, встряхивают и фильтруют. К полученному фильтрату прибавляют 1 мл кислоты серной разведенной и 0,2 мл 0,02 М раствора калия перманганата; розовое окрашивание раствора должно сохраняться в течение не менее 5 мин. | ||
| Химизм:
| ||
| Количественное определение: 0,2 г препарата (точная навеска) растворяют в 20 мл нейтрализованного по фенолфталеину спирта и титруют с тем же индикатором 0,1 М гидроксидом натрия до розового окрашивания. 1 мл 0,1 М гидроксида натрия соответствует 0,01221 г С7Н6О2, которого в препарате должно быть не менее 99,5%.
| Формула расчета содержания действующего вещества (Х%, Хг) | Расчет теоретического объема титранта (мл) |
| Химизм: | ||

Задание № 2
Провести химические испытания на подлинность, чистоту и количественное определение натрия бензоата.
|
|
|
| Методика проведения | Наблюдения | Выводы | |||
| Свойства: белый кристаллический порошок без запаха или с очень слабым запахом, сладковато-соленого вкуса. |
| ||||
| Растворимость:легко растворим в воде, трудно растворим в спирте. |
| ||||
| Подлинность: 1. 0,02 г препарата растворяют в 1,5 мл 0,1 М натрия гидроксида прибавляют 0,2 мл раствора хлорида окисного железа; появляется осадок розовато-желтого цвета. |
| ||||
| Химизм: | |||||
| 2. Окрашивание пламени горелки в желтый цвет. |
| ||||
| Количественное определение: Около 1,5 г препарата (точная навеска) растворяют в 20 мл воды в колбе с притертой пробкой емкостью 250 мл, прибавляют 45 мл эфира, 3-4 капли смешанного индикатора (1 мл раствора метилового оранжевого и 1 мл раствора метиленового синего) и титруют 0,5 М раствором кислоты хлористоводородной до появления сиреневой окраски в водном слое. В конце титрования содержимое колбы хорошо встряхивают. 1мл 0,5 М раствора соляной кислоты соответствует 0,07205 г C7H5NaO2, которого в пересчете на сухое вещество должно быть не менее 99,0%. | Формула расчета содержания действующего вещества (Х%, Хг)
| Расчет теоретического объема титранта (мл) | |||
|
| |||||
| Химизм: | |||||
 Задание № 3
Задание № 3
Провести химические испытания на подлинность, чистоту и количественное определение кислоты салициловой.
| Методика проведения | Наблюдения | Выводы | |||
| Свойства: белые мелкие игольчатые кристаллы или легкий кристаллический порошок без запаха. Летуч с водяным паром. При осторожном нагревании возгоняется. |
| ||||
| Растворимость: малорастворим в воде, растворим в кипящей воде, легко растворим в спирте, эфире, трудно растворим в хлороформе. |
| ||||
| Подлинность: 1. 0.01 г препарата растворяют в 10 мл воды, к полученному раствору прибавляют 1 каплю, железа хлорида (III); появляется сине-фиолетовое окрашивание, исчезающее от прибавления нескольких капель раствора соляной кислоты и не исчезающее от прибавления концентрированной уксусной кислоты. |
| ||||
| Химизм: | |||||
| 2. 0,1 г препарата нагревают с 0,3 г цитрата натрия; ощущается запах фенола. |
| ||||
| Химизм:
| |||||
| 3. Водный раствор препарата имеет кислую реакцию. |
| ||||
| Количественное определение: 0,120 г препарата (точная навеска) растворяют в 30 мл спирта 96% и титруют 0,1 М раствором натрия гидроксида, используя как индикатор 0,1 мл раствора фенолового красного.
1 мл 0,1 М раствора натрия гидроксида соответствует 0,01381 г C7H6O3, которого в препарате должно быть не менее 99,5%. | Формула расчета содержания действующего вещества (Х%, Хг) | Расчет теоретического объема титранта (мл) | |||
|
| |||||
| Химизм: | |||||
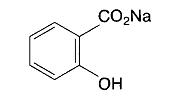 Задание № 4
Задание № 4
Дата добавления: 2018-02-28; просмотров: 671; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
