Связь между изобарной и изохорной теплоемкостью для идеального газа
Так, если система заключена в постоянный объем, т. е. для изохорного процесса имеем: 
Если же система расширяется или сжимается, а давление остается постоянным, т.е. для изобарного процесса имеем: 
Но ΔQV = dU, а ΔQP = dH поэтому
CV = (∂U/∂T)v , а СP = (∂H/∂T)p
(если одна или несколько переменных поддерживаются постоянными, в то время как другие изменяются, то производные называются частными по отношению к изменяющейся переменной).
Оба соотношения справедливы для любых веществ и любых агрегатных состояний. Чтобы показать связь между СV и СP , надо продифференцировать по температуре выражение для энтальпии Н=U+pV /
Для идеального газа рV=nRT

для одного моля 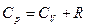 или
или 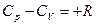
Разность R представляет собой работу изобарного расширения 1 моля идеального газа при повышении температуры на единицу.
54. Зависимость теплоемкости от температур. Уравнения Дебая, Эйнштейна, эмпирические уравнения.
Закон кубов Дебая
Исследуя вопрос о внутренней энергии кристаллов, Дебай нашел, что при температурах, близких к абсолютному нулю, внутренняя энергия твердого тела пропорциональна четвертой степени абсолютной температуры
 ,
,
где а – постоянный множитель, зависящий от природы кристалла.
Из этого соотношения можно найти выражение для теплоемкости
 .
.
Следовательно, вблизи абсолютного нуля теплоемкость твердого тела пропорциональна кубу абсолютной температуры.
Уравнение Эйнштейна
Определяя теплоёмкость как производную внутренней энергии по температуре, получаем окончательную формулу для теплоёмкости:
 .
.
Согласно модели, предложенной Эйнштейном, при абсолютном нуле температуры теплоёмкость стремится к нулю, при больших температурах, напротив, выполняется закон Дюлонга-Пти. Величина  иногда называется температурой Эйнштейна.
иногда называется температурой Эйнштейна.
Мольная теплоемкость большинства одноатомных кристаллов при комнатной
температуре равна 3R (закон Дюлонга-Пти)7:
CV ≈ 3R.
Зависимость теплоемкости от температуры в интервале температур 298 – Т для практических расчетов выражают обычно эмпирическими уравнениями в виде средних рядов:

где: а0, а1, а2 и а-2 – коэффициенты, зависящие от природы вещества
Статистический характер второго закона термодинамики. Связь энтропии и термодинамической вероятности.
Количественно связь энтропии с термодинамической вероятностью W нахождения данной системы в данном состоянии выражают с помощью уравнения Больцмана 
где k – постоянная Больцмана.
Из этого уравнения следует, что чем больше энтропия системы, тем больше вероятность нахождения системы в данном состоянии. Увеличение энтропии в самопроизвольных процессах указывает пути наиболее вероятного их осуществления в изолированной системе.
Поэтому второй закон термодинамики можно рассматривать как закон вероятности, применимый к системам, состоящим из большого числа частиц, т.е. к макросистемам, свойства которых складываются из свойств микросистем. Чем больше в макросистеме число микросистем, изменяющихся в определенном направлении, тем наиболее вероятным становится это направление процесса для всей макросистемы. В то время как в системах, состоящих из малого числа частиц возможны и менее вероятные процессы из-за флуктуаций В этом заключается статистический характер второго закона термодинамии
Дата добавления: 2018-02-28; просмотров: 3838; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
