Диаграмма плавкости двухкомпонентных систем с
Неустойчивым химическим соединением при неограниченной
Растворимости компонентов в жидком состоянии и отсутствии
Растворимости в твердом состоянии
При образовании компонентами Аи Вхимического соединения AxBy, плавящегося с разложением (инконгруэнтно), на линии ликвидуса диаграммы плавкости (рис.4.5) возникает перегиб, отмеченный точкой Р. Инконгруэнтно плавящееся химическое соединение AxByустойчиво
только ниже температуры ТP. Поэтому при повышении температуры выше ТPэто твердое соединение распадается с образованием двух фаз, в данном случае: кристаллов компонента Ви расплава соответствующего состава. Точка перегиба Рназывается перитектической, и ей соответствует равновесие:
расплав + ВТВ. ↔ AxBy ТВ.
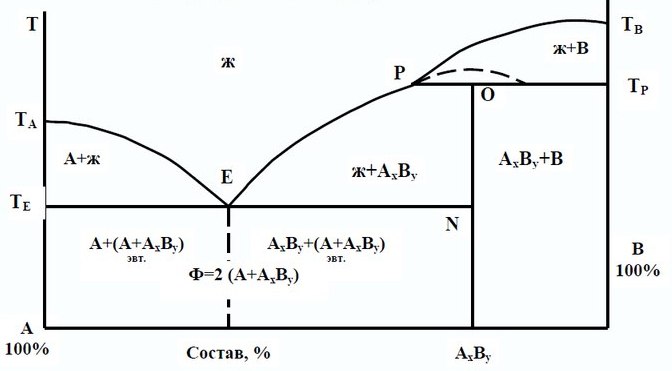
Рис. 4.5. Диаграмма плавкости с инконгруэнтно плавящимся химическим соединением
Инконгруэ́нтное плавле́ние — плавление с разложением, при котором твёрдая фаза преобразуется в расплав и твёрдую фазу другого состава, например, в бинарной системе D(твёрдая фаза) → L (расплав) + А(твёрдая фаза). Инконгруэнтная точка, инконгруэнтная реакция – соответственно точка (в координатах Т–р–х) и реакция, отвечающие инконгруэнтному плавлению.
В отличие от эвтектической точки, в которой одновременно выпадают две твердые фазы, в перитектической точке одна твердая фаза (соединение AxBy) выпадает, а другая (выпавшие ранее кристаллы вещества В) растворяется. Система в этой точке и на всей перитектической прямой РТРнонвариантная S = 2 – 3 + 1 = 0). Пунктирной линией (со скрытым максимумом) на диаграмме показано возможное положение сингулярной области. На представленной в качестве примера диаграмме для рассматриваемого случая (рис. 4.5) указаны фазы, которые находятся в равновесии при соответствующих составах систем и температурах.
Криоскопия.
Криоскопия– метод определения молекулярных масс по понижению температуры замерзания раствора. При охлаждении растворов наблюдается их замерзание. Температура замерзания – температура, при которой образуются первые кристаллы твердой фазы. Если эти кристаллы состоят только из молекул растворителя, то температура замерзания раствора (Т) всегда ниже температуры замерзания чистого растворителя (Тпл). Разность температур замерзания растворителя и раствора называют понижением температуры замерзания раствора.
Количественная зависимость понижения температуры замерзания от концентрации раствора выражается следующим уравнением:
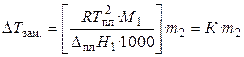 , (33)
, (33)
где М1 — молярная масса растворителя, DплН1 — энтальпия плавления растворителя, m2 — моляльность раствора; K – криоскопическая постоянная, зависящая от свойств только растворителя, равная понижению температуры замерзания раствора с моляльностью растворенного в нем вещества, равной единице.
|
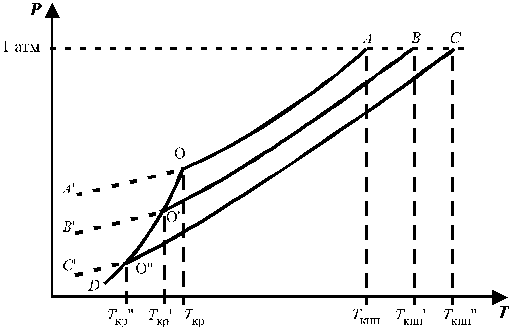
На рис. 3 представлена температурная зависимость давления насыщенного пара над чистым жидким и твердым растворителем (кривые ОА и ОD) и его парциального давления в паре над растворами разных составов (кривые ВО¢ и СО¢¢) для случая, когда растворенное вещество нелетуче. Кривые ОА¢, O¢B¢,O¢¢C показывают ход с температурой давления паров над переохлажденным и чистым растворителем (ОА¢) и растворами соответствующих составов (О¢B¢, O¢¢C).
Рис. 3. Зависимость давления насыщенного пара растворителя от температуры.
Кристаллы растворителя будут находиться в равновесии с раствором, если давления пара растворителя над твердой и жидкой фазами будут равны, т.е. когда кривая ОD пересечет кривые ВВ¢, CC¢ при соответствующих температурах Tкр¢ и Tкр¢¢. Температуры, отвечающие этому условию, будут ниже температуры замерзания чистого растворителя (Tкр – тройная точка растворителя).
Понижение точки замерзания и повышение точки кипения растворов, их осмотическое давление не зависят от природы растворенных веществ. Такие свойства называют коллигативными. Эти свойства зависят от природы растворителя и концентрации растворенного вещества. Как правило, коллигативные свойства проявляются, когда в равновесии находятся две фазы, одна из которых содержит растворитель и растворенное вещество, а вторая – только растворитель.
Дата добавления: 2018-02-28; просмотров: 1127; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
