Теория мономолекулярной адсорбции Ленгмюра
Основные положения:
1. адсорбция идет не на всей поверхности, а на активных центрах (АЦ), которые всегда имеются на поверхности адсорбента (пики, возвышения, неровности). АЦ равноценны и характеризуются максимальной свободной энергией;
2. адсорбция идет под действием сил, близких к химическим, которые характеризуются большой интенсивностью и малым радиусом действия, поэтому только одна частица (молекула) может зафиксироваться на одном АЦ, т.е. адсорбция мономолекулярна;
3. взаимодействием адсорбированных молекул между собой можно пренебречь;
4. каждый центр работает автономно, т.е. независимо друг от друга;
5. адсорбция локализована, т.е. отсутствует перемещение адсорбированных частиц вдоль поверхности раздела;
6. в системе устанавливается динамическое равновесие
Адсорбция ↔ Десорбция,
когда число адсорбирующихся частиц равно числу частиц, покидающих поверхностный слой, т.е. скорость адсорбции равна скорости десорбции;
7.  .
.
Допустим, единица массы адсорбента имеет  АЦ. При определенном равновесном парциальном давлении адсорбтива
АЦ. При определенном равновесном парциальном давлении адсорбтива  установилось состояние равновесия и оказались занятыми
установилось состояние равновесия и оказались занятыми  АЦ, а
АЦ, а 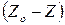 остались свободными.
остались свободными.
Скорость адсорбции пропорциональна количеству свободных АЦ и парциальному давлению адсорбтива:
 ,
,
скорость десорбции зависит только от количества занятых АЦ:
 .
.
где  – константы адсорбционного и десорбционного равновесия.
– константы адсорбционного и десорбционного равновесия.
|
|
|
При равновесии скорость адсорбции равна скорости десорбции:
 .
.
Разделим левую и правую части уравнения на  :
:
 .
.
Преобразуем
 .
.
Разделим левую и правую часть уравнения на  и выразим
и выразим 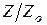 :
:
 ,
,
где  – константа адсорбционно-десорбционного равновесия, тогда
– константа адсорбционно-десорбционного равновесия, тогда
 .
.
Так как один АЦ адсорбирует только одну частицу, то количество адсорбированных частиц равно  . Найдем число моль адсорбированных частиц:
. Найдем число моль адсорбированных частиц:
1 моль –  частиц,
частиц,
 моль –
моль –  частиц
частиц
тогда  . Так как рассматривается единица массы адсорбента, то
. Так как рассматривается единица массы адсорбента, то  – адсорбция (см. уравнение (14)). Если заняты все активные центры, то
– адсорбция (см. уравнение (14)). Если заняты все активные центры, то  . Тогда получим
. Тогда получим
 – уравнение Ленгмюра. (16)
– уравнение Ленгмюра. (16)
При адсорбции газов из их смесей (многокомпонентных систем), получаем:
 ,
,
где  – равновесное парциальное давление
– равновесное парциальное давление  го компонента раствора.
го компонента раствора.
Теория Ленгмюра, разработанная для адсорбции газов и паров на твердых адсорбентах с энергетически эквивалентными центрами, редко оправдывается на практике, поскольку реальные поверхности твердых тел, как правило, таким свойством не обладают. Однако она хорошо описывает адсорбцию из жидких растворов на границе с газом. В этом случае парциальное давление адсорбтива заменяют его равновесной концентрацией:
 . (17)
. (17)
Константа адсорбционного равновесия в уравнении Ленгмюра ( и
и 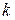 ) характеризует энергию взаимодействия адсорбата с адсорбентом. Чем сильнее это взаимодействие, тем больше константа адсорбционного равновесия.
) характеризует энергию взаимодействия адсорбата с адсорбентом. Чем сильнее это взаимодействие, тем больше константа адсорбционного равновесия.
|
|
|
Лекция 4
Графическую зависимость величины адсорбции от парциального давления (концентрации) веществ при  – называют изотермой адсорбции.
– называют изотермой адсорбции.
 Изотерма адсорбции Ленгмюра изображена на рис. 3. По мере увеличения концентрации адсорбтива адсорбция резко возрастает. При малых концентрациях график имеет прямолинейную зависимость (участок I). При насыщении поверхностного слоя (когда все АЦ поверхности адсорбента заняты), адсорбция достигает предельного (максимального) значения
Изотерма адсорбции Ленгмюра изображена на рис. 3. По мере увеличения концентрации адсорбтива адсорбция резко возрастает. При малых концентрациях график имеет прямолинейную зависимость (участок I). При насыщении поверхностного слоя (когда все АЦ поверхности адсорбента заняты), адсорбция достигает предельного (максимального) значения  и дальше уже практически не изменяется (участок III).
и дальше уже практически не изменяется (участок III).
Уравнение Ленгмюра можно использовать только при отсутствии адсорбции сверх мономолекулярного слоя.
Анализ уравнения Ленгмюра (16, 17):
1) при малых равновесных концентрациях (давлениях) адсорбтива  , следовательно, этим слагаемым в знаменателе можно пренебречь. Тогда уравнение Ленгмюра примет вид уравнения прямой
, следовательно, этим слагаемым в знаменателе можно пренебречь. Тогда уравнение Ленгмюра примет вид уравнения прямой

и описывает прямолинейный участок изотермы адсорбции (рис. 3, участок I);
2) при больших равновесных концентрациях (давлениях)  и пренебрегая единицей в знаменателе, (17) преобразуется в уравнение
и пренебрегая единицей в знаменателе, (17) преобразуется в уравнение
|
|
|
 ,
,
которое описывает горизонтальный участок изотермы адсорбции (участок III).
Таким образом, уравнение Ленгмюра описывает всю изотерму адсорбции.

 На практике изотермы мономолекулярной адсорбции встречаются довольно редко. Экспериментально установлено, что адсорбция не ограничивается образованием одного слоя адсорбата. Теория Ленгмюра позволяют объяснить ступенчатую адсорбцию, изотерма которой представлена на рис. 4. Если принять, что на поверхности адсорбента имеются группы активных центров, резко отличающихся по своей адсорбционной активности, то I ступень отвечает заполнению более активных центров, II ступень – заполнению следующих по активности центров и т. д.
На практике изотермы мономолекулярной адсорбции встречаются довольно редко. Экспериментально установлено, что адсорбция не ограничивается образованием одного слоя адсорбата. Теория Ленгмюра позволяют объяснить ступенчатую адсорбцию, изотерма которой представлена на рис. 4. Если принять, что на поверхности адсорбента имеются группы активных центров, резко отличающихся по своей адсорбционной активности, то I ступень отвечает заполнению более активных центров, II ступень – заполнению следующих по активности центров и т. д.
Однако наиболее общим типом изотерм адсорбции являются не ленгмюровские, а S-образные изотермы, которые показывают, что адсорбция продолжается и после образования мономолекулярного слоя (рис. 5). Теория мономолекулярной адсорбции Ленгмюра для описания таких изотерм не подходит, поэтому учеными разработаны несколько теорий полимолекулярной адсорбции, наиболее известные из которых – теории Поляни и БЭТ.
Дата добавления: 2015-12-18; просмотров: 98; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
