Фундаментальное адсорбционное уравнение Гиббса
Из предыдущего материала следует, что процесс адсорбции обусловлен снижением поверхностного натяжения. Связь адсорбции со способностью растворенного вещества изменять поверхностное натяжение выражается уравнением Гиббса, которое выводится из объединенного уравнения I и II законов термодинамики, записанного для энергии Гиббса поверхностного слоя  :
:
 , (20)
, (20)
где  – энтропия поверхностного слоя;
– энтропия поверхностного слоя;
 – поверхностное натяжение раствора;
– поверхностное натяжение раствора;
 – избыточное число моль
– избыточное число моль  го компонента в поверхностном слое, по сравнению с числом моль этого компонента в объеме фазы;
го компонента в поверхностном слое, по сравнению с числом моль этого компонента в объеме фазы;
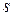 – поверхность раздела фаз;
– поверхность раздела фаз;
 – равновесный химический потенциал
– равновесный химический потенциал  го компонента.
го компонента.
Рассмотрим изотермический процесс, т.к. адсорбция протекает преимущественно при  . Тогда
. Тогда  и при равновесии
и при равновесии  из уравнения (20) получаем:
из уравнения (20) получаем:
 . (21)
. (21)
Если состав поверхностного слоя не изменяется, что соответствует конечным значениям 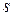 и
и  , то можно записать:
, то можно записать:
 .
.
Дифференцируя последнее уравнение по всем переменным, получим:
 .
.
Вычтем из последнего уравнения уравнение (21):
 .
.
Разделим обе части последнего уравнения на 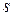 и решим относительно
и решим относительно  :
:
 .
.
Отношение 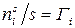 – избыток
– избыток  компонента в поверхностном слое по сравнению с его концентрацией в объеме фазы, отнесенный к единице площади поверхности – избыточная (или гиббсовская) адсорбция, тогда
компонента в поверхностном слое по сравнению с его концентрацией в объеме фазы, отнесенный к единице площади поверхности – избыточная (или гиббсовская) адсорбция, тогда
 . (22)
. (22)
Уравнение (22) – фундаментальное адсорбционное уравнение Гиббса.
Уравнение Гиббса выведено теоретически на основе термодинамических представлений и применимо при адсорбции на границе раздела любых фаз. Однако, его используют в основном для расчета адсорбции на границе жидкость – газ, т.к. определение поверхностного натяжения твердых тел затруднено.
|
|
|
Для двухкомпонентной системы, состоящей из растворителя 1 и растворенного вещества 2 уравнение (22) запишется
 .
.
Так как  , то адсорбцией растворителя можно пренебречь, тогда
, то адсорбцией растворителя можно пренебречь, тогда
 .
.
Поскольку последнее уравнение записано для одного компонента, индекс 2 опущен.
Химический потенциал компонента  можно выразить через стандартный химический потенциал
можно выразить через стандартный химический потенциал  и его термодинамическую активность
и его термодинамическую активность  :
:
 ;
;
 ;
;
 . (23)
. (23)
Для разбавленных растворов коэффициент активности  , т.е. активность можно заменить на концентрацию, тогда уравнение (23) запишется
, т.е. активность можно заменить на концентрацию, тогда уравнение (23) запишется
 . (24)
. (24)
Экспериментальная проверка уравнения (24) весьма затруднительна в связи со сложностью определения концентрации вещества в поверхностном слое.
Анализ уравнения Гиббса:
Если производная  , то
, то  – наблюдается положительная избыточная адсорбция, вещество концентрируется на поверхности растворителя (это соответствует адсорбции поверхностно-активных веществ (ПАВ)).
– наблюдается положительная избыточная адсорбция, вещество концентрируется на поверхности растворителя (это соответствует адсорбции поверхностно-активных веществ (ПАВ)).
Если  , то
, то  – отрицательная избыточная адсорбция, вещество уходит с поверхности в объем раствора (адсорбция поверхностно-инактивных веществ (ПИВ)).
– отрицательная избыточная адсорбция, вещество уходит с поверхности в объем раствора (адсорбция поверхностно-инактивных веществ (ПИВ)).
|
|
|
Если  , то
, то  – концентрация вещества в объеме фазы и на поверхности одинакова, адсорбции нет (поверхностно-неактивные вещества (ПНАВ)).
– концентрация вещества в объеме фазы и на поверхности одинакова, адсорбции нет (поверхностно-неактивные вещества (ПНАВ)).
Лекция 5
Закон Генри
При незначительном заполнении поверхности адсорбента адсорбатом наблюдается прямолинейная зависимость адсорбции от равновесного парциального давления (концентрации) адсорбтива (см. рис. 3 участок I):
 . (25)
. (25)
Уравнение (25) является аналитическим выражением закона Генри.
Коэффициент  не зависит от равновесного парциального давления (концентрации) адсорбтива и представляет собой константу распределения вещества между адсорбционным слоем и объемной фазой. Прямолинейное уравнение Генри соблюдается лишь приближенно.
не зависит от равновесного парциального давления (концентрации) адсорбтива и представляет собой константу распределения вещества между адсорбционным слоем и объемной фазой. Прямолинейное уравнение Генри соблюдается лишь приближенно.
Дата добавления: 2015-12-18; просмотров: 24; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
