Поверхностное натяжение индивидуальных жидкостей
Основные свойства ДС:
1. Наличие высокоразвитой (т.е. большой) удельной поверхности раздела фаз обусловленное раздробленностью ДФ. При этом свойства поверхности раздела любых фаз ДС резко отличаются от свойств самих фаз;
2. значительный избыток поверхностной энергии на межфазной поверхности, вызванный раздробленностью и большой удельной поверхностью раздела фаз.
Как видно, свойства ДС связаны со свободной поверхностной энергией. Выясним причины возникновения избыточной поверхностной энергии. Для этого рассмотрим возможные положения молекул в системе индивидуальная жидкость–газ (рис. 2).
 1-й случай: молекула, находящаяся в объеме жидкости, испытывает равномерное воздействие со стороны окружающих ее таких же молекул. Имеем симметричное силовое поле, т.е. векторы сил направлены в разные стороны и равны по модулю. Равнодействующая этих межмолекулярных сил (сил Ван-дер-Ваальса) равна 0.
1-й случай: молекула, находящаяся в объеме жидкости, испытывает равномерное воздействие со стороны окружающих ее таких же молекул. Имеем симметричное силовое поле, т.е. векторы сил направлены в разные стороны и равны по модулю. Равнодействующая этих межмолекулярных сил (сил Ван-дер-Ваальса) равна 0.
2-й случай: силы, действующие на молекулу, расположенную на поверхности раздела, направлены лишь внутрь жидкости и вдоль поверхности раздела. Силами притяжения со стороны молекул газа можно пренебречь, т.к. молекулы газа расположены очень далеко друг от друга. Молекулы на поверхности раздела фаз и в объеме жидкости равноценны, т.е. обладают одинаковой энергией (способностью к взаимодействию). Однако на поверхности раздела фаз они расходуют для взаимодействия лишь часть своей энергии (при взаимодействии с аналогичными молекулами жидкости). Другая часть энергии остается, т.к. молекулы граничащего с жидкостью газа не способны ее скомпенсировать. Таким образом, у каждой молекулы на поверхности раздела фаз остается определенная часть нескомпенсированной энергии.
|
|
|
Суммарная нескомпенсированная энергия всех молекул поверхностного слоя характеризует свободную поверхностную энергию  , которая и обусловливает протекание различных ПЯ.
, которая и обусловливает протекание различных ПЯ.
Нескомпенсированное межмолекулярное взаимодействие на границе раздела фаз (несимметричность силового поля) вызывает возникновение равнодействующей силы  , втягивающей молекулы внутрь жидкости. Равнодействующую сил, отнесенную к единице площади поверхности называют внутренним давлением жидкости.
, втягивающей молекулы внутрь жидкости. Равнодействующую сил, отнесенную к единице площади поверхности называют внутренним давлением жидкости.
Чем сильнее различаются межмолекулярные взаимодействия в граничащих фазах, тем больше внутреннее давление. Для жидкостей на границе с воздухом внутреннее давление очень велико, например, для воды оно составляет
14800 атм. Поэтому капельные жидкости при увеличении внешнего давления не изменяют свой удельный вес, т.е. они несжимаемы.
Под действием внутреннего давления молекулы поверхностного слоя втягиваются внутрь. В результате возникает сила, направленная тангенциально к поверхности жидкости, которая препятствует увеличению поверхности жидкости. Эту силу, рассчитанную на единицу длины периметра, ограничивающего поверхность жидкости, называют поверхностным натяжением  . В этом заключается силовой аспект поверхностного натяжения.
. В этом заключается силовой аспект поверхностного натяжения.
|
|
|
Величина  различна для различных тел и для индивидуальных веществ представляет собой характеристическую физическую константу.
различна для различных тел и для индивидуальных веществ представляет собой характеристическую физическую константу.
Термодинамическое определение  вытекает из объединенного уравнения I и II начал термодинамики. Его можно записать относительно изменения любого из термодинамических потенциалов:
вытекает из объединенного уравнения I и II начал термодинамики. Его можно записать относительно изменения любого из термодинамических потенциалов:  ,
,  ,
, 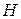 ,
,  . Чаще всего уравнение записывают относительно изменения энергии Гиббса, так как изобарно-изотермические условия реализуются в большинстве случаев. Изменение
. Чаще всего уравнение записывают относительно изменения энергии Гиббса, так как изобарно-изотермические условия реализуются в большинстве случаев. Изменение  ДС определяют:
ДС определяют:
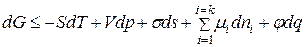 , (3)
, (3)
где  – энтропия,
– энтропия,  ;
;  – объем ДС,
– объем ДС,  ;
;  – поверхностное натяжение,
– поверхностное натяжение,  ;
;  ,
,  ,
,  – изменение температуры, общего давления системы и поверхности раздела фаз, соответственно;
– изменение температуры, общего давления системы и поверхности раздела фаз, соответственно;  ,
, 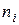 – химический потенциал и число моль
– химический потенциал и число моль  го компонента системы;
го компонента системы;  ,
, 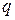 – электрический потенциал и заряд поверхности.
– электрический потенциал и заряд поверхности.
В изобарно-изотермических условиях ( ,
,  ) в отсутствии физико-химических и электростатических взаимодействий граничащих фаз (
) в отсутствии физико-химических и электростатических взаимодействий граничащих фаз ( ,
,  ) при равновесии из уравнения (3) получим
) при равновесии из уравнения (3) получим
|
|
|
 . (4)
. (4)
Таким образом, изменение свободной поверхностной энергии  определяется поверхностным натяжением
определяется поверхностным натяжением  и приращением поверхности раздела фаз
и приращением поверхности раздела фаз  .
.
Из уравнения (4) следует, что
 . (5)
. (5)
Из (5) видно, что поверхностное натяжение есть частная производная от энергии Гиббса по площади раздела фаз при постоянных температуре и давлении, в отсутствие химического, электрического и других видов взаимодействий.
Выражения аналогичные формуле (5) можно получить и для других термодинамических потенциалов, при постоянстве соответствующих параметров:
 . (6)
. (6)
Наличие на поверхности раздела фаз избытка поверхностной энергии означает, что для образования новой межфазной поверхности необходимо перевести часть молекул из объема жидкости на поверхность, для чего необходимо совершить работу против внутреннего давления, стремящегося втянуть молекулы поверхностного слоя внутрь жидкой фазы. Совершая работу, свободная энергия системы уменьшается, благодаря уменьшению величины поверхности 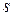 (см. уравнение 4).
(см. уравнение 4).
Из ФХ известно, что энергия Гиббса  является термодинамическим потенциалом, т.е. ее убыль в обратимо протекающих процессах равна максимальной полезной работе этого процесса. При
является термодинамическим потенциалом, т.е. ее убыль в обратимо протекающих процессах равна максимальной полезной работе этого процесса. При  имеем
имеем
|
|
|
 .
.
Подставляя последнее уравнение в (5), получим:
 , (7)
, (7)
где  – термодинамическая обратимая работа образования поверхности площадью
– термодинамическая обратимая работа образования поверхности площадью  ; так как работа совершается над системой, она отрицательна.
; так как работа совершается над системой, она отрицательна.
 определяет энергетический аспект поверхностного натяжения.
определяет энергетический аспект поверхностного натяжения.
Поэтому поверхностное натяжение одновременно равно термодинамически обратимой, изотермической работе, которую необходимо совершить, чтобы увеличить площадь межфазной поверхности на единицу.
Соответственно определению и уравнениям (5) и (7) поверхностное натяжение выражают в
 .
.
В результате действия  текучие системы принимают форму с минимальной поверхностью фазы при заданном объеме, т.е. шарообразную. Поэтому такие жидкости называют капельными.
текучие системы принимают форму с минимальной поверхностью фазы при заданном объеме, т.е. шарообразную. Поэтому такие жидкости называют капельными.
Поверхностное натяжение позволяет поверхности воды выдерживать вес водяного паука, а пауку шагать по поверхности воды.
Поверхностное натяжение  характеризует различия в интенсивности межмолекулярных взаимодействий граничащих фаз. Чем больше эти различия, тем больше
характеризует различия в интенсивности межмолекулярных взаимодействий граничащих фаз. Чем больше эти различия, тем больше  . Поэтому на границе с газовой фазой
. Поэтому на границе с газовой фазой  жидкостей меньше, чем твердых тел
жидкостей меньше, чем твердых тел 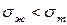 ,
,  неполярных жидкостей меньше, чем у полярных
неполярных жидкостей меньше, чем у полярных  .
.
Таким образом, одним из условий существования ДС является различие межмолекулярных взаимодействий между граничащими фазами.
Поверхностное натяжение на границе двух конденсированных фаз называют межфазовым. Оно образуется на поверхности раздела двух взаимно нерастворимых жидкостей  , твердого тела и жидкости
, твердого тела и жидкости  и двух твердых тел
и двух твердых тел  .
.
Вопрос: чему будет равно  , если воздействие на молекулы в поверхностном слое со стороны молекул газа будет таким же, как со стороны жидкости?
, если воздействие на молекулы в поверхностном слое со стороны молекул газа будет таким же, как со стороны жидкости?
Ответ:  . Молекулы на поверхности будут испытывать аналогичные воздействия со стороны соседних молекул. Скомпенсированность межмолекулярного взаимодействия означает, что граница раздела между фазами исчезла и система из гетерогенной превратилась в гомогенную.
. Молекулы на поверхности будут испытывать аналогичные воздействия со стороны соседних молекул. Скомпенсированность межмолекулярного взаимодействия означает, что граница раздела между фазами исчезла и система из гетерогенной превратилась в гомогенную.
Поверхностное натяжение с увеличением температуры снижается. Это связано с усилением диффузии молекул, ослаблением межмолекулярных связей и возрастанием давления насыщенного пара. В результате нескомпенсированность межмолекулярных взаимодействий уменьшается. Поэтому при оценке значений  необходимо указывать температуру.
необходимо указывать температуру.
Величина  , в соответствии с уравнением (5), выражает свободную энергию единицы поверхности индивидуальной жидкости. Если величина поверхности равна
, в соответствии с уравнением (5), выражает свободную энергию единицы поверхности индивидуальной жидкости. Если величина поверхности равна 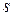 , то свободная поверхностная энергия системы равна
, то свободная поверхностная энергия системы равна
 . (8)
. (8)
Итак, поверхностное натяжение индивидуальных веществ соответствует удельной свободной поверхностной энергии Гиббса  , которая, в свою очередь, равна энергии Гиббса в расчете на единицу площади раздела фаз
, которая, в свою очередь, равна энергии Гиббса в расчете на единицу площади раздела фаз  .
.
Дата добавления: 2015-12-18; просмотров: 64; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
