Поверхностное натяжение. Свободная поверхностная энергия
Лекция 1
1. Предмет коллоидной химии
1.1. Основные понятия и определения
Коллоидная химия (КХ) берет свое начало с изучения коллоидов («коллоид», от др. - греч. kolla (колла) – клей и εἶδος (айдос) – вид; «клеевидный») или коллоидных растворов (водные растворы золота, серы, кремниевой кислоты и др.) и растворов ВМС (желатин, пектин, казеин).
В настоящее время объектами КХ является широкий диапазон дисперсных систем (ДС) от грубодисперсных до высокодисперсных, в том числе коллоидных (наносистем). Постепенно КХ существенно расширила свои границы и в 60-х годах 19 столетия, из раздела физической химии (ФХ), преобразовалась в самостоятельную науку. Основоположниками отечественной КХ были Антон Владимирович Думанский (основатель и первый зав. кафедрой физической и коллоидной химии ВГТА), Иван Иванович Жуков, Петр Александрович Ребиндер, Борис Владимирович Дерягин, Михаил Михайлович Дубинин и др. ученые.
КХ – устоявшееся традиционное, но не раскрывающее содержания, название науки. В некоторых странах КХ переименована в «Поверхностные явления», «Поверхностные явления и дисперсные системы».
Объектом изучения ФХ являются гомогенные системы (или истинные растворы) и гетерогенные системы, характеризующиеся незначительной поверхностью раздела фаз, которая существенно не влияет на свойства этих систем. КХ химия изучает ДС, имеющие развитую (т.е. значительную) поверхность раздела фаз, поэтому протекающие на ней явления, оказывают значительное влияние на свойства ДС, и мы уже не можем пренебрегать этим влиянием.
|
|
|
Коллоидная химия – наука, изучающая свойства ДС на основании исследования поверхностных явлений, а также физико-химические свойства ВМС и их растворов.
Поверхностные явления (ПЯ) – процессы, вызванные самопроизвольным уменьшением поверхностной энергии и протекающие на поверхности раздела фаз (межфазной границе). К ПЯ относятся: адсорбция, адгезия, смачивание, образование двойного электрического слоя (ДЭС) и др.
Дисперсными системами (ДС) (или дисперсиями) называют гетерогенные, преимущественно микрогетерогенные, системы, состоящие из двух и более фаз, по меньшей мере одна из которых находится в дисперсном (т.е. раздробленном) состоянии.
Например, если гетерогенную систему, состоящую из растительного масла и воды, взболтать, то образуется ДС типа эмульсия (рис. 1):
 Раздробленную (прерывную) часть ДС 1 называют дисперсной фазой (ДФ)(масло), а нераздробленную (непрерывную) 2 – дисперсионной (сплошной) средой (ДСр) (вода).
Раздробленную (прерывную) часть ДС 1 называют дисперсной фазой (ДФ)(масло), а нераздробленную (непрерывную) 2 – дисперсионной (сплошной) средой (ДСр) (вода).
Необходимым условием образования ДС является нерастворимость или ограниченная растворимость ДФ и ДСр, между которыми образуется граница раздела. Итак, основными признаками объектов КХ являются гетерогенность и дисперсность.
|
|
|
Большинство продуктов и материалов, создаваемых и используемых человеком, являются ДС, поэтому КХ является базовой дисциплиной для специалистов различных технологических специальностей. Примерами ДС в пищевой промышленности являются: сливочное масло, пиво, газированная вода, молоко, хлеб и др.
 Для количественной характеристики ДС применяются три величины:
Для количественной характеристики ДС применяются три величины:
1. Характерный размер частиц ДФ  ,
,  (для сферических частиц – это диаметр сферы
(для сферических частиц – это диаметр сферы  , для кубических – ребро куба
, для кубических – ребро куба  ).
).
2. Дисперсность (раздробленность)  – определяют как отношение суммарной межфазной поверхности
– определяют как отношение суммарной межфазной поверхности 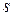 ,
,  к суммарному объему частиц ДФ
к суммарному объему частиц ДФ  ,
,  :
:
 ,
, 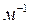 . (1)
. (1)
Системы, состоящие из частиц одинакового размера, называют монодисперсными, а из частиц различного размера – полидисперсными. Большинство систем являются полидисперсными. Монодисперсные системы можно приготовить только искусственно, используя специальные приемы.
В общем случае для монодисперсных систем, содержащих частицы произвольной формы
 ,
,
где 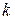 – коэффициент, зависящий от формы частиц (для кубических и сферических частиц –
– коэффициент, зависящий от формы частиц (для кубических и сферических частиц – 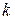 = 6).
= 6).
|
|
|
Таким образом, дисперсность – величина, обратная размеру частиц.
3. Удельная поверхность – это отношение суммарной поверхности раздела фаз 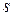 ,
,  к суммарной массе частиц ДФ
к суммарной массе частиц ДФ 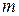 ,
, 
 ,
,  , (2)
, (2)
где  – плотность частиц ДФ,
– плотность частиц ДФ,  .
.
Рассмотрим, как влияет дробление фазы на ее дисперсность.
Пусть форма частиц ДФ – куб, тогда
 , , 
|  , , 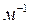
|

| |

| 
|
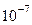
| 
|

| 
|
Таким образом, с уменьшением размера частиц ДФ (при дроблении) резко возрастает их дисперсность и удельная поверхность.
1.2. Классификация дисперсных систем
1) Классификация по агрегатному состоянию ДФ и ДСр
Сочетание трех видов агрегатного состояния ДФ и ДСр (твердое (Т), жидкое (Ж) и газообразное (Г)), позволяет выделить девять видов ДС. Для краткости их условно обозначают дробью, числитель которой указывает на агрегатное состояние ДФ, а знаменатель – ДСр (см. табл. 1).
Таблица 1
Классификация ДС по агрегатному состоянию ДФ и ДСр (по Фрейндлиху)
| Общее название | ДФ | ДСр | ДС | Название и примеры |
| Аэрозоли | Г1 | Г2 | Г1/Г2 | ДС не образуется, однако возникают неоднородности за счет флуктуации плотности (атмосфера Земли) |
| Ж | Г | Ж/Г | Аэрозоли(туманы, в том числе и промышленные, аэрозольные дезодоранты, облака) | |
| Т | Г | Т/Г | Аэрозоли(пыли, дымы(табачный дым)), порошки | |
| Лиозоли | Г | Ж | Г/Ж | Газ. эмульсии (газ. вода, пиво, игристые вина), пены (противопожарная, пивная, мыльная) |
| Ж1 | Ж2 | Ж1/Ж2 | Эмульсии (молоко, майонез, кремы, природная нефть) | |
| Т | Ж | Т/Ж | Суспензии(взвеси)и золи (пульпа, ил, золи металлов, естественные водоемы), гели, пасты | |
| Ксерозоли | Г | Т | Г/Т | Тв. пены (сыр, хлеб), пористые и капиллярные системы(пенопласты, туфы, пенобетоны, адсорбенты и катализаторы в газах, пемза, силикагель, активные угли) |
| Ж | Т | Ж/Т | Тв. эмульсии (масло), пористые тела и капиллярные системы (клетки животных и растений, жидкость в пористых телах, адсорбенты в растворах, почвы, влажные грунты) | |
| Т1 | Т2 | Т1/Т2 | Тв. золи, горные породы (драг. камни, минералы), сплавы (чугун, сталь), строит. материалы (асфальт, бетон, цемент) |
В общем случае все ВДС называют золями (нем. Sole от лат. solutio (солушио) – раствор). К слову золь добавляют приставку, характеризующую ДСр. Если ДСр твердая – ксерозоли, жидкая – лиозоли (гидрозоли), газ – аэрозоли.
|
|
|
Помимо простых существуют и сложные ДС, которые состоят из трех и более фаз. Например, тесто после замеса представляет собой сложную ДС, состоящую из твердой (зерна крахмала, частички оболочек зерна), жидкой (жир, вносимый в тесто) и газообразной (пузырьки воздуха и продуктов процесса брожения) ДФ, т.е. систему типа Т, Ж, Г /Т. Аэрозоли, в которых присутствуют твердые и жидкие частицы ДФ, т.е. системы типа Т, Ж /Г, называют смогами.
2) Классификация по кинетическим (структурно-механическим) свойствам
Различают свободнодисперсные и связнодисперсные системы, а также разбавленные и концентрированные.
а) свободнодисперсные системы – это системы, в которых частицы ДФ обособлены и свободно перемещаются по всему объему системы. Это лиозоли (разбавленные суспензии и эмульсии), аэрозоли, практически все сыпучие порошки и др.
б) связнодисперсные – это системы, в которых частицы ДФ связаны между собой и не могут свободно передвигаться в сплошной среде. В таких системах возникновение межмолекулярных связей между фазой и средой приводит к образованию структурированных систем. В разбавленных связнодисперсных системах частицы ДФ образуют сплошную пространственную сетку (дисперсную структуру) – возникают гели и студни. Концентрированные связнодисперсные системы это пасты, пены, кремы. Связнодисперсные системы, в отличие от свободнодисперсных, обладают новыми качествами: прочностью, упругостью, пластичностью.
Связнодисперсными являются практически все пищевые системы, которые могут быть в виде полупродуктов (тесто, мясной фарш) или готовых продуктов питания (творог, сливочное масло, халва, мармелад, плавленый сыр, дрожжи и т.д.).
3) Классификация по степени дисперсности
Свободно– и связнодисперсные системы имеют существенные различия в классификации по степени дисперсности.
а) Свободнодисперсные системы в зависимости от размеров частиц ДФ подразделяют на высокодисперсные (ВДС) (в том числе и коллоидно-дисперсные системы (КДС) (или коллоидные растворы)), среднедисперсные (СДС) и грубодисперсные системы (ГДС) (табл. 2). КХ изучает в основном ВДС.
Таблица 2
Классификация ДС по степени дисперсности
| Класс ДС | Размер частиц, 
| Дисперсность, 
| Примеры |
| Растворы ВМС и коллоидных ПАВ ВДС (в т.ч. КДС) (ультрамикрогетерогенные или наносистемы) | 
| 
| Раствор желатина |

| 
| Гидрозоли | |
| СДС (микрогетерогенные) | 
| 
| Растворимый кофе, сахарная пудра |
| ГДС | 
| 
| Крупы |
Частицы с размерами 
 образуют истинные молекулярные или ионные растворы (раствор сахарозы в воде).
образуют истинные молекулярные или ионные растворы (раствор сахарозы в воде).
Особое место среди ДС занимают растворы ВМС и коллоидных поверхностно-активных веществ (ПАВ). Из двух признаков ДС, гетерогенность и дисперсность, они обладают только одним – дисперсностью. Некоторые свойства растворов ВМС и коллоидных ПАВ (оптические, молекулярно-кинетические, электрокинетические, структурные) аналогичны или близки к свойствам коллоидных растворов, что позволяет рассматривать их в качестве объектов КХ.
б) Связнодисперсные системы, точнее, пористые тела классифицируют (табл. 3).
Таблица 3
| Название ДС | Размер пор частиц, нм | |
| По Дубинину М.М. | По рекомендации ИЮПАК* | |
| микропористые | менее 2 | |
| мезопористые (переходнопористые) | 2 – 200 | 2 – 50 |
| макропористые | более 200 | Свыше 50 |
| *ИЮПАК (IUPAC) – пер. с англ. Международный союз теоретической и прикладной химии |
Связнодисперсные системы типа Т/Т удобнее подразделять по степени дисперсности так же как и свободнодисперсные системы.
4) Классификация по природе устойчивости и характеру взаимодействия ДФ и ДСр
По классификации П.А. Ребиндера ДС разделяют на лиофильные и лиофобные.
а) Лиофильные (от греч. лио – жидкость, филио – любить) системы характеризуются высокой степенью сродства ДФ и ДСр, малой интенсивностью поверхностных сил на границе раздела фаз (т.е. низкими значениями межфазного поверхностного натяжения). Системы образуются самопроизвольно путем дробления более крупных частиц ДФ. Они термодинамически устойчивы, что означает постоянство концентрации и размеров частиц (отсутствие как агрегации, так и дальнейшего дробления до молекулярных размеров), которое зависит только от состава и условий существования системы. Если в качестве ДСр выступает вода – системы называют гидрофильными.
К лиофильным относятся преимущественно ВДС из агрегированных в растворах ВМС (пектина, агароида, крахмала), а также растворимых белковых веществ, микроэмульсии, растворы коллоидных ПАВ.
б) Большинство ДС термодинамически неустойчивы и называются лиофобными (гидрофобными) (от греч. фобио – ненавидеть). Неустойчивость лиофобных ДС вызвана избытком поверхностной энергии, что связано с увеличением энергии Гиббса ДС ( ). Для лиофобных ДС характерно слабое межфазное (ДФ – ДСр) взаимодействие и большая интенсивность поверхностных сил (высокие значения поверхностного натяжения). Для их образования необходимы определенные условия и воздействие извне.
). Для лиофобных ДС характерно слабое межфазное (ДФ – ДСр) взаимодействие и большая интенсивность поверхностных сил (высокие значения поверхностного натяжения). Для их образования необходимы определенные условия и воздействие извне.
Большинство ДС пищевых производств относятся к лиофобным.
Лекция 2
Поверхностное натяжение. Свободная поверхностная энергия
Дата добавления: 2015-12-18; просмотров: 84; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
