Лекция 6. Комплексонометрическое титрование. Кривые титрования.
2. Цель лекции: Изучить метод комплексонометрического титрования. Рассмотреть индикаторы и кривые комплексонометрического титрования.
3. Тезисы лекции: Комплексонометрия, или комплексонометрическое титрование, − метод, основанный на использовании реакций образования комплексонатов − комплексных соединений катионов металлов с комплексонами.
Комплексоны − это многоосновные аминополикарбоновые кислоты и их соли, анионы которых, выступая в роли полидентатных хелатообразующих лигандов, способны образовывать со многими катионами металлов устойчивые растворимые комплексы − комплексонаты. Известно более 30 комплексонов. Например: комплексон II, или этилендиаминтетрауксусная кислота (ЭДТУК, H4Y), имеющая бетаиновое строение (два протона связаны с атомами азота):

Комплексон III, Na2H2Y•2Н2О − двунатриевая соль ЭДТУК; этот комплексон часто называют также ЭДТА (этилендиаминтетраацетат), трилон Б, хелатон III и т.д. Комплексонаты металлов, образованные катионами металлов с ЭДТА, называют также «эдетеатами».
Комплексон II − H4Y − четырехосновная кислота. В сильно кислых растворах при рН < 1,6 она протонируется: протоны присоединяются к молекуле ЭДТУК, образуя протонированные формы (катионы) H5Y+ и H6Y2+. В водных растворах сосуществуют и находятся в равновесии все формы ЭДТУК, однако, в зависимости от кислотности среды, доминирует та или иная форма в интервалах ΔрН изменений рН раствора.
|
|
|
Если в растворе доминирует форма H2Y2-, то реакции комплексообразования протекают по схеме:
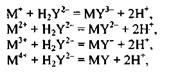
где Мn+− катионы металлов-комплексообразователей.
Катионы щелочных металлов образуют малостойкие эдетеаты. Двух-, трех- и четырехзарядные катионы металлов образуют весьма стабильные комплексонаты; поэтому катионы таких металлов определяют комплексонометрически. При этом катионы металлов, которые образуют высокоустойчивые эдетеаты, можно оттитровывать в кислой среде. Катионы металлов, дающие менее стойкие эдетеаты (lg β ≈ 9-12), определяют комплексонометрически в щелочной среде.
Вкачестве титрантов метода применяют стандартные водные растворы ЭДТА, обычно с молярной концентрацией 0,1; 0,05; 0,025 и 0,01 моль/л, а также стандартные растворы сульфата магния или цинка. Раствор титранта трилона Б готовят по точной навеске Na2H2Y . 2Н20, а затем стандартизуют по стандартному раствору сульфата магния или сульфата цинка. Трилон Б − дигидрат двунатриевой соли ЭДТУК C10H14N2Na2O8•2Н2O (молекулярная масса 372,24) − белый кристаллический порошок, растворимость в воде составляет 108 г/л при 22 °С. Устойчив на воздухе.
Для визуальной фиксации КТТ применяют 2 типа индикаторов.
|
|
|
К первому типу индикаторов относятся бесцветные органические вешества, образующие с катионами определяемых металлов окрашенные комплексы. К числу таких индикаторов относятся салициловая, сульфо-салициловая кислоты, тайрон, гидроксамовые кислоты, тиокарбамид и др. Индикаторы этого типа применяют в комплексонометрии редко.
Ко второму типу индикаторов, наиболее часто применяемых в комплексонометрии, относятся металлохромные индикаторы (т.н. металло-индикаторы), представляющие собой органические красители, имеющие собственные хромофорные группы, способные обратимо изменять окраску при образовании комплексов с катионами металлов.
Принцип действия металлохромных индикаторов заключается в следующем. Индикатор прибавляется в исходный анализируемый раствор до начала прибавления титранта и образует окрашенный растворимый комплекс с определяемым катионом.

Исходный анализируемый раствор, содержащий определяемые катионы, принимает окраску цвета II. По ходу титрования образуются бесцветные растворимые комплексонаты MY2-:

Необходимое условие использования металлохромного индикатора заключается в том, что комплекс MInd должен быть менее устойчив, чем комплекс MY2-. Поэтому вблизи ТЭ, когда оттитрованы все катионы М, прибавляемый титрант взаимодействует с комплексом MInd, разрушая его:
|
|
|

Выделяющиеся анионы Ind2- окрашивают титруемый раствор в цвет I; на этом титрование заканчивают.
Известны многие десятки металлохромных индикаторов. Из них при комплексонометрическом анализе фармацевтических препаратов чаще других применяют следующие: кальконкарбоновую кислоту (кальцес), хромовый темно-синий (кислотный хром темно-синий), эриохром черный Т, ксиленоловый оранжевый, мурексид, пирокатехиновый фиолетовый и некоторые другие.
В комплексонометрии применяют прямое, обратное и заместительное титрование. Наиболее точные результаты получают при прямом титровании.
Кривая комплексонометрического титрования − это графическое представление зависимости концентрации определяемых катионов металла в растворе от количества прибавляемого титранта. Часто кривые комплексонометрического титрования строятся в координатах рМ−V (Т), где рМ = -lg[Mn+]. Скачок титрования комплексонометрического титрования зависит от ряда факторов: устойчивости комплексоната, концентрации титруемых катионов металла, значения рН раствора.
|
|
|
Комплексонометрическое титрование применяется для определения катионов многих металлов, образующих устойчивые комплексонаты. Комплексонометрически контролируют жесткость воды. Комплексонометрия применяется для определения редкоземельных элементов в различных объектах, в анализе сплавов металлов, руд и минералов, комплексных соединений металлов и т. д. Комплексонометрически можно определять также анионы (фосфаты, сульфаты, оксалаты, хроматы и др.), используя заместительное и обратное титрование в сочетании с методом осаждения.
4. Иллюстративный материал:

Рис.1. Схема диссоциации водного раствора эриохрома черного Т

Рис.2. Схема диссоциации водного раствора к ислотного хромового темно-синего
 рис.3 Кривые титрования 100 мл 0,1моль/л растворов, содержащих Са2+ и Zn2+, 0,1 моль/л раствором ЭДТА.
рис.3 Кривые титрования 100 мл 0,1моль/л растворов, содержащих Са2+ и Zn2+, 0,1 моль/л раствором ЭДТА.
5. Литература:
Основная: 1, 2, 3, 4, 5.
Дополнительная: 7, 8.
6. Контрольные вопросы:
· Сущность метода комплексонометрического титрования.
· Комплексоны, комплексонаты и их свойства.
· Металлохромные индикаторы.
· Кривые комплексонометрического титрования.
Кредит № 4
Дата добавления: 2016-01-05; просмотров: 68; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
