Лекция 2. Кривые кислотно-основного титрования. Индикаторы. Индикаторные ошибки кислотно-основного титрования. Применение кислотно-основного титрования в фармацевтическом анализе.
2. Цель лекции: Изучить метод кислотно-основного титрования. Рассмотреть кривые кислотно-основного титрования. Дать понятие об индикаторах и индикаторных ошибках кислотно-основного титрования.
3. Тезисы лекции: Индикатор кислотно-основного титрования − это ве-
щество, которое изменяет окраску в точке эквивалентности или вблизи ее.
Индикаторы кислотно-основного титрования должны отвечать следующим основным требованиям.
1) Окраска индикатора должна быть интенсивной и различаться в кислой и щелочной среде.
2) Изменение окраски должно быть быстрым, четким и обратимым.
3) Окраска индикатора должна меняться в узком интервале изменения рН раствора.
4) Индикатор должен быть чувствительным и менять свою окраску в присутствии минимального избытка кислоты или щелочи.
5) Индикатор должен быть стабильным, не разлагаться в водном растворе и на воздухе.
Для объяснения природы изменения окраски индикаторов при изменении рН раствора предложены различные теории, наиболее известными из которых являются ионная, хромофорная и ионно-хромофорная.
Интервал перехода кислотно-основного индикатора − это область концентрации ионов водорода, в пределах которой глаз способен обнаружитьизменение в оттенке окраски визуального индикатора.
рН = рКа±1 (1.1)
Введем обозначение рТ = рКа и назовем его показателем титрованияиндикатора. Тогда окончательно получим выражение для интервала перехода окраски индикатора: рН = рТ±1 (1.2)
|
|
|
В качестве кислотно-основных индикаторов предложено более 200 органических соединений. Их классифицируют различным образом:
1) по строению индикаторов (азосоединения, трифенилметановые индикаторы, нитроиндикаторы, индикаторы других структурных типов).
2) по составу индикаторов (индивидуальные и смешанные).
3) по способу применения (внутренние и внешние).
4) по цветности (одно- и двухцветные)
Кривые кислотно-основного титрования графически отображают зависимость изменения рН титруемого раствора от объема прибавленного титранта.Для построения кривой кислотно-основного титрования рассчитывают значения рН титруемого раствора в различные моменты титрования:для исходного раствора, для растворов до ТЭ, в ТЭ и после ТЭ. В основе титриметрических расчетов лежит закон эквивалентов.
Анализ кривых титрования позволяет определить интервал ΔрН раствора вблизи ТЭ, т.е. величину скачка на кривой титрования, или скачка титрования, и выбрать подходящий индикатор так, чтобы значении рТ индикатора укладывалось внутри скачка титрования, т.е. анализ кривых титрования позволяет указать оптимальные условия проведения титрования. Величина скачка титрования зависит от: 1) уровня титрования, т.е. концентрации реагентов титруемого вещества и титранта, 2) силы титруемых кислот и оснований, 3) температуры, 4) присутствия посторонних веществ в растворе.
|
|
|
При проведении кислотно-основного титрования возможно возникновение ошибок, которые подразделяют на объемные и индикаторные ошибки кислотно-основного титрования. Индикаторные ошибки кислотно-основного титрования обусловлены несовпадением значений рН титруемого раствора в ТЭ и рТ индикатора в КТТ. Индикаторные ошибки кислотно-основного титрования подразделяют на водородную (протонную), гидроксидную, кислотную и основную ошибки.
Водородная (протонная) ошибка XН3О+ошибка вызвана присутствием избытка ионов водорода в КТТ вследствие либо недотитровывания раствора сильной кислоты, либо перетитровывания раствора титруемого основания раствором сильной кислоты. В первом случае ошибка отрицательная, во втором − положительная.
ХН3О+ = ±10-рТ • [V(a) +V(b)] 100% / C(a)V(a) (1.3)
Гидроксидная ошибка ХОН-. Эта ошибка возникает при наличии избытка гидроксид-ионов ОН- в КТТ вследствие либо недотитровывания раствора сильного основания кислотой (отрицательнаяошибка), либо перетитровывания раствора кислоты раствором сильного основания (положителънаяошибка):
|
|
|
ХОН- = ±10-(14-рТ) • [V(a) +V(b)] 100% / C(b)V(b) (1.4)
Кислотная ошибка Ха. Эта ошибка вызвана присутствием в КТТ некоторого количества недотитрованной слабой кислоты:
Ха = 10рКа - рТ . 100% / 10рКа – рТ + 1 (1.5)
Под основной ошибкой Хb понимают выраженную в процентах долю недотитрованного слабого основания в КТТ:
Хb = 10рКb + рТ - 14 . 100% / 10рКb + рТ - 14 + 1 (1.6)
Кислотно-основное титрование в водных средах широко применяется в количественном анализе неорганических и органических веществ, обладающих кислотно-основными свойствами: сильных и слабых кислот, оснований, кислых и основных солей, а также солей, содержащих анионы слабых кислот и катионы слабых оснований. Модифицированными способами, включающими кислотно-основное титрование можно анализировать и соединения, не обладающие выраженными кислотно-основными свойствами.
4. Иллюстративный материал:


Рис.1 Кривая титрования 20 мл Рис.2. Кривая титрования 20 мл
0,1моль/л раствора NaOH 0,1моль/л раствора CH3COOH 0,1моль/л раствором НСl 0,1моль/л раствором NaOH
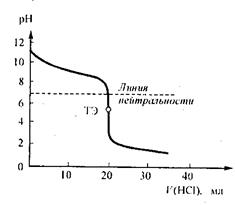

Рис.3 Кривая титрования 20 мл Рис.4. Кривая титрования 10 мл
0,1моль/л раствора аммиака 0,1моль/л раствора H2SO3 0,1моль/л раствором НСl 0,1моль/л раствором NaOH
|
|
|
5. Литература:
Основная: 1, 2, 3, 4, 5.
Дополнительная: 7, 8.
6. Контрольные вопросы:
· Индикаторы кислотно-основного титрования.
· Интервал перехода и показатель титрования индикатора.
· Ионная, хромофорная и ионно-хромофорная теории индикаторов.
· Расчет, построение и анализ кривых кислотно-основного титрования.
· Индикаторные ошибки титрования.
· Применение кислотно-основного титрования в анализе.
Дата добавления: 2016-01-05; просмотров: 315; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
