Иодиметрия. Иодометрия.
Иодиметрия (иодиметрическое титрование) − метод определения восстановителей прямым титрованием стандартным раствором иода.
В основе метода лежит полуреакция восстановления трииодид-иона:
I3- +2e = 3I-
Ео редокс-пары I3-/ 3I- равен 0,545 В.
Титрантом метода служит раствор иода в растворе иодида калия обычно с молярной концентрацией эквивалента 0,1 или 0,01 моль/л. Раствор иода стандартизуют по оксиду мышьяка(III) или по раствору тиосульфата натрия.
Для проведения иодиметрического титрования необходимо соблюдать ряд условий, важнейшими из которых являются следующие.
1). Титрование раствором иода следует проводить на холоду во избежание улетучивания иода.
2). ОВ потенциал редокс-пары I2/2I- невелик. Для увеличения полноты протекания реакций титрование часто ведут в присутствии веществ, связывающих продукты реакции в прочные комплексы.
3). Иодиметрическое титрование проводят в слабокислых, нейтральных или очень слабощелочныхрастворах при рН < 8.
В иодиметрии применяют различные способы фиксации КТТ.
1). Безындикаторный способ. Появление желтой окраски иногда используют при иодиметрическом определении КТТ. Для более четкого фиксирования КТТ к титруемому раствору прибавляют несколько капель четыреххлористого углерода или хлороформа. При встряхивании раствора иод в основном переходит в органическую фазу, окрашивая ее в фиолетовый цвет; титрование заканчивают, когда капли органической жидкости примут фиолетовую окраску.
2) Индикаторный способ.В качестве индикатора в иодиметрии применяют свежеприготовленный(обычно 1%-ный) раствор крахмала, который окрашивается в синий цвет в присутствии даже следовых количеств иода. Титрование ведут до появления неисчезающей синей окраски раствора.
Иодиметрию применяют для определения восстановителей: Na2S2O3, SnCl2 , As (III) и его соединений, Na2SO3, Cu2Cl2, анальгина, аскорбиновой кислоты кофеина и т.д.
Иодометрия (иодометрическое титрование) − метод определения окислителей косвенным титрованием заместителя − иода − стандартным раствором тиосульфата натрия.
В основе метода лежит реакция взаимодействия иодид-ионов с окислителем Ох с образованием иода и восстановителя Red:
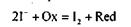
Иодид-ион − довольно эффективный восстановитель. Однако растворы иодида калия непосредственно не применяются в качестве титранта, так как они неустойчивы и окисляются кислородом воздуха. На практике к анализируемому раствору определяемого окислителя прибавляют избыток иодида калия. Иод, выделяющийся в качестве заместителя в количестве, эквивалентном количеству вступившего в реакцию окислителя, оттитровывают стандартным раствором тиосульфата натрия: 
Титрантом метода является стандартный раствор тиосульфата натрия с молярной концентрацией 0,1; 0,02; 0,01 моль/л. Стандартные растворы тиосульфата натрия нельзя готовить по точной навеске, так как кристаллический пентагидрат Na2S2О3•5Н2О при хранении частично обезвоживается. Растворы тиосульфата натрия наиболее устойчивы при рН = 9-10, поэтому для стабилизации растворов в них вводят небольшое количество карбоната натрия Na2CО3, или гидросульфата натрия NaHSО4. Стандартизованный раствор тиосульфата натрия хранят в сосудах из темного стекла с притертыми пробками в темном месте.
В качестве индикатора в иодометрии обычно используют свежеприготовленный 1%-ный раствор крахмала, который прибавляют в титруемый раствор тогда, когда основная часть иода уже оттитрована раствором тиосульфата натрия и титруемый раствор приобрел зеленовато-желтую окраску. После введения крахмала раствор становится синим; его продолжают титровать до перехода синей окраски в светло-зеленую.
Метод иодометрии применяют для определения: Н2О2, Na2О2, MgО2, ВаО2, меди(II), дихромата калия, перманганата калия, арсенат натрия и т.д.
4. Иллюстративный материал:

Рис.1. Кривая титрования 100 мл кислого 0,05 моль/л раствора железа (II) 0,05моль/л раствором K2Cr2O7.
5. Литература:
Основная: 1, 2, 3, 4, 5.
Дополнительная: 7, 8.
6. Контрольные вопросы:
· Классификация методов окислительно-восстановительного титрования.
· Перманганатометрия.
· Дихроматометрия.
· Бромо- и броматометрия.
· Иодометрия.
· Нитритометрия.
· Цериметрия.
Дата добавления: 2016-01-05; просмотров: 58; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
