Лекция 3. Окислительно-восстановительное титрование. Требования к реакциям. Индикаторы.
2. Цель лекции: Изучить метод окислительно-восстановительного титрования и его классификацию. Рассмотреть индикаторы и кривые окислительно-восстановительного титрования.
3. Тезисы лекции: Mетоды окислительно-восстановительного титрования, илиредокс-методы,основаны на использовании ОВР, т.е. реакций с переносом электронов.
Red1 + Ox2 = Ox1 + Red2
В любой ОВР участвуют, по крайней мере, две редокс-пары.
Известно несколько десятков различных методов ОВ титрования. Обычно их классифицируют следующим образом:
1) по характеру титранта на методы: оксидиметрии − методы определения восстановителей с применением титранта-окислителя; и редуктометрии − методы определения окислителей с применением титранта-восстановителя.
2) по природе реагента, взаимодействующего с определяемым веществом выделяют следующие методы: броматометрия (КВrO3), бромометрия (раствор Вr2), дихроматометрия (К2Сr2О7), иодатометрия (КIO3), uодиметрия (раствор I2), иодометрия (KI, Na2S2O3), нитритометрия (NaNO2), перманганатометрия (КМnO4), хлориодиметрия (IC1), цериметрия Ce(SO4)2, аскорбинометрия (аскорбиновая кислота) и др.
Реакции, применяемые в методах ОВ титрования, должны отвечать ряду требований, важнейшими из которых являются следующие.
1. Реакция должна протекать быстро и практически до конца.
2. Реакция должна протекать стехиометрически,побочные процессы должны быть исключены.
3. Конечная точка титрования должна определяться точно и однозначно.
|
|
|
В ОВ титровании применяют прямое, обратное и заместительное титрование.
В титриметрических методах ОВ титрования КТТ определяют индикаторным методом. При этом роль индикатора может играть либо сам реагент, участвующий в ОВРлибо специально вводимый индикатор.
Редокс-индикатором называют вещество, которое при определенном потенциале раствора окисляется или восстанавливается с изменением окраски в т.э. или вблизи ее. Окислительно-восстановительные индикаторы бывают обратимыми и необратимыми.Обратимые индикаторы меняют окраску обратимо при потенциале раствора в ТЭ и при этом не разрушаются. Необратимые индикаторы изменяют окраску при достижении определенного значения потенциала в ТЭ или вблизи ее и при этом необратимо разрушаются.
Окисленная и восстановлен формы обратимых редокс-индикаторов имеют различную окраску. Изменение цвета индикатора происходит при определенном значении потенциала раствора. Полуреакцию, соответствующую изменению окраски редокс-индикатора, можно представить в виде
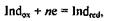
где Indox и Indred − соответственно окисленная и восстановленная формы индикатора.
ОВ потенциал Е редокс-пары Ind0X|Indred описывается уравнением Нернста, которое для комнатной температуры можно представить в виде:
|
|
|
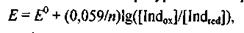 (1.1)
(1.1)
Интервал перехода окраски редокс-индикатора приближенно равен:
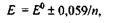 (1.2)
(1.2)
Наиболее резкое изменение окраски наблюдается при равенстве концентраций обеих форм, т.е. при значении потенциала раствора, равного
 (1.3)
(1.3)
Известно большое число обратимых редокс-индикаторов (табл. 1).
Одним из первых предложенных обратимых редокс-индикаторов является дифениламин С6Н5−NH−С6Н5. Полагают, что в присутствии окислителей дифениламин претерпевает в растворе превращения в соответствии с полуреакцией:
2С6Н5−NH−С6Н5 → С6Н5−NH−C6H4−C6H4−NH−С6Н5 + 2Н+ + 2е
дифениламин бесцветный дифенилбензидин бесцветный
Эта стадия необратима. Образовавшийся бесцветный дифенилбензидин затем обратимо окисляется по схеме:

дифенилдифенохинондиимин фиолетовый
с образованием окисленной окрашенной фиолетовой формы индикатора. Интервал перехода окраски индикатора изменяется в пределах Е = 0,76 ± 0,0295 В.
К недостаткам дифениламина как редокс-индикатора относится его малая растворимость в воде (обычно готовят его 1%-ный раствор в концентрированной серной кислоте).
В качестве обратимых редокс-индикаторов применяют также N-фенилантраниловую кислоту, ферроин и др.
|
|
|
Необратимые ОВ индикаторы. К индикаторам этой группы относятся метиловый оранжевый, метиловый красный, нейтральный красный. При потенциале раствора, равном потенциалу в ТЭ, они необратимо окисляются, вследствие чего исчезает присущая им окраска раствора.
Кривая ОВ титрования − это графическое представление изменения потенциала раствора в зависимости от объема прибавленного титранта. Обычно кривые ОВ титрования строят в координатах Е − V(Т). Следовательно, изменение потенциала раствора отражает изменение концентраций реагентов. Наибольшее изменение потенциала раствора наблюдается в ТЭ и вблизи ее, так как в этой области происходит самое большое изменение отношения концентраций окисленной и восстановленной форм редокс-пар. Поэтому в этой области и обнаруживается скачок на кривой ОВ титрования. Cкачок на кривой ОВ титрования зависит от: концентраций окисленной и восстановленной форм редокс-пар, рН среды, температуры, присутствия посторонних веществ, ионной силы раствора.
4. Иллюстративный материал:
Табл.1. Некоторые окислительно-восстановительные индикаторы.
|
|
|

5. Литература:
Основная: 1, 2, 3, 4, 5.
Дополнительная: 7, 8.
6. Контрольные вопросы:
· Окислительно-восстановительное титрование. Классификация методов.
· Индикаторы метода окислительно-восстановительного титрования.
· Кривые окислительно-восстановительного титрования.
Дата добавления: 2016-01-05; просмотров: 71; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
