Лекция 4. Электрохимические методы анализа. Потенциометрия.
2. Цель лекции: Изучить электрохимические методы анализа и их классификацию. Рассмотреть метод потенциометрического анализа.
3. Тезисы лекции: Электрохимические методы анализа основаны на электродных реакциях и на переносе электричества через растворы.
Электрохимические методы анализа классифицируют п о природе источника электрической энергии в системе. Различают две группы методов.
а) Методы без наложения внешнего (постороннего) потенциала. Источником электрической энергии служит сама электрохимическая система, представляющая собой гальванический элемент. К таким методам относятся потенциометрические методы. Электродвижущая сила и электродные потенциалы в такой системе зависят от содержания определяемого вещества в растворе.
б) Методы с наложением внешнего (постороннего) потенциала. К таким методам относятся:
Ø кондуктометрический анализ − основан на измерении электрической проводимости растворов как функции их концентрации;
Ø вольтамперометрический анализ − основан на измерении тока как функции приложенной известной разности потенциалов и концентрации раствора;
Ø кулонометрический анализ − основан на измерении количества электричества, прошедшего через раствор, как функции его концентрации;
Ø электрогравиметрический анализ − основан на измерении массы продукта электрохимической реакции.
|
|
|
По способу применения электрохимических методовразличают прямые и косвенные методы.
Потенциометрический анализ (потенциометрия) основан на измерении ЭДС и электродных потенциалов как функции концентрации анализируемого раствора. Если в электрохимической системе на электродах протекает реакция

с переносом п электронов, то уравнение Нернста для ЭДС Е этой реакции имеет вид:
 (1.1)
(1.1)
Уравнение (1.1) справедливо для ЭДС обратимо работающего гальванического элемента. Для комнатной температуры в разбавленных растворах это уравнение можно представить в виде:
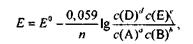 (1.2)
(1.2)
При потенциометрических измерениях в электрохимической ячейке используют два электрода: индикаторный электрод, потенциал которого зависит от концентрации определяемого (потенциалопределяющего) вещества в анализируемом растворе, и электрод сравнения, потенциал которого в условиях проведения анализа остается постоянным. Поэтому величину ЭДС можно рассчитать как разность реальных потенциалов этих двух электродов.
В потенциометрии используют электроды следующих типов: электроды первого и второго рода, окислительно-восстановительные, мембранные электроды.
Для потенциометрического определения концентрации вещества в растворе применяют как прямую потенциометрию, так и потенциометрическое титрование.
|
|
|
Определение концентрации вещества в прямой потенциометрии проводят обычно методом градуировочного графика или методом добавок стандарта.
Метод прямой потенциометрии применяется для определения концентрации ионов водорода (рН растворов), анионов, ионов металлов. К достоинствам прямой потенциометрии относятся простота и быстрота проведения измерений, для измерений требуются небольшие объемы растворов.
Потенциометрическое титрование − способ определения объема титранта, затраченного на титрование определяемого вещества в анализируемом растворе, путем измерения ЭДС с помощью гальванической цепи, составленной из индикаторного электрода и электрода сравнения. При потенциометрическом титровании анализируемый раствор, находящийся в электрохимической ячейке, титруют подходящим титрантом, фиксируя конец титрования по резкому изменению ЭДС измеряемой цепи − потенциала индикаторного электрода, который зависит от концентрации соответствующих ионов и резко изменяется в точке эквивалентности. В процессе титрования измеряют изменение потенциала индикаторного электрода в зависимости от объема прибавленного титранта. По полученным данным строят кривую потенциометрического титрования и по этой кривой определяют объем израсходованного титранта в ТЭ. При потенциометрическом титровании не требуется использование индикаторов, изменяющих окраску вблизи ТЭ.
|
|
|
Кривая потенциометрического титрования − графическое изображение изменения ЭДС электрохимической ячейки в зависимости от объема прибавленного титранта. Кривые потенциометрического титрования строят в различных координатах: E−V(Т) (интегральными кривыми титрования); dE/dV − V(Т) и d2E/dV2 − V(Т) (дифференциальные кривые титрования), ΔV/ΔE−V (Т) (кривые титрования по методу Грана). На рис. 1 схематически приведены различные типы кривых потенциометрического титрования. По построенным кривым титрования определяют объем титранта V(ТЭ) в ТЭ.
Метод потенциометрического титрования универсальный, его можно применять для индикации конца титрования во всех типах титрования: кислотно-основном, окислительно-восстановительном, комплексиметрическом, осадительном, при титровании в неводных средах. В качестве индикаторных используют стеклянный, ртутный, ион-селективные, платиновый, серебряный электроды, а в качестве электродов сравнения − каломельный, хлорсеребряный, стеклянный.
|
|
|
Метод обладает высокой точностью, большой чувствительностью: позволяет проводить титрование в мутных, окрашенных, неводных средах, раздельно определять компоненты смеси в одном анализируемом растворе.
4. Иллюстративный материал:

Рис. 1. Типы кривых потенциометрического титрования (Е - измеряемая ЭДС, V(T) - объем прибавленного титранта, V(ТЭ) - объем титранта, прибавленного в точке эквивалентности): а - кривая титрования в координатах Е - V(X); б, в - дифференциальные кривые титрования; г - кривая титрования по методу Грана
5. Литература:
Основная: 1, 2, 3, 4, 5.
Дополнительная: 7, 8.
6. Контрольные вопросы:
· Классификация электрохимических методов анализа.
· Теоретические основы метода потенциометрического анализа.
· Классификация и характеристика электродов.
· Прямая потенциометрия.
· Потенциометрическое титрование.
Дата добавления: 2016-01-05; просмотров: 69; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
