Лекция 1. Применение ЗДМ к равновесиям комплексо-образования и их роль в аналитической химии.
2. Цель лекции: Рассмотреть виды комплексных соединений и дать их характеристику. Рассмотреть применение ЗДМ к равновесиям комплексообразования.
3. Тезисы лекции: Комплексными называют молекулярные или ионные соединения, образующиеся путем присоединения к атому или иону металла или неметалла нейтральных молекул или ионов.
Комплексное соединение Kt[MLn] (напр. K2[PtCl4]) состоит из атома металла-комплексообразователя М, с которым связаны лиганды L. Атом М и лиганды L образуют внутреннюю сферу комплекса. Лигандами могут быть нейтральные молекулы и отрицательно заряженные ионы. Если внутренняя сфера комплекса несет отрицательный или положительный заряд, то для компенсации этого заряда необходимы ионы, образующие внешнюю сферу. Во внешней сфере могут находиться не только ионы, но и нейтральные молекулы
Лиганд L образует с металлом-комплексообразователем М координационную связь различной химической природы, которая может быть ординарной, двойной, тройной.
Координационное число центрального атома металла − это число координационных связей, образуемых атомом комплексообразователя с лигандами. Координационное число может иметь значения 2; 3; 4; 5; 6 и т. д. вплоть до 12.
Число координационных связей, образуемых одним и тем желигандом с одним атомомметалла-комплексообразователя, называется дентатностъю. Лиганды могут быть моно- и полидентатными (би-, три-, тетра-, пента-, гексадентатными).
|
|
|
Комплексные соединения катионного и анионного типа чаще всего растворимы в воде. В их водных растворах устанавливаются химические равновесия. Комплексы-неэлектролиты, как правило, малорастворимы в воде; растворившаяся часть этих комплексов ведет себя как слабый электролит.
Так, при растворении аммиачного комплекса серебра [Ag(NH3)2]Cl вначале происходит первичная электролитическая диссоциация (отщепляются ионы
внешней сферы по типу сильного электролита):
[Ag(NH3)2]Cl → [Ag(NH3)2]+ + Cl-
А затем происходит вторичная диссоциациякомплекса по типу слабого электролита − отщепляются лиганды внутренней сферы:
[Ag(NH3)2]+ → [Ag(NH3)]+ + NH3
[Ag(NH3)]+ → Ag+ + NH3
Каждая ступень диссоциации внутренней сферы комплекса характеризуется своей константой химического равновесия.
Рассмотрим равновесия комплексообразования в общем виде. Пусть при
реакции ионов металла М с лигандами L последовательно протекают процес-
сы ступенчатого комплексообразования (для краткости заряды не указаны):
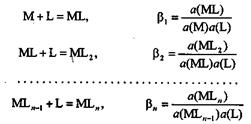
где все активности − равновесные; β1, β2,…, βn−истинные термодинамические константы ступенчатого комплексообразования. Произведение констант ступенчатого комплексообразования равно полной константе образования комплекса β:
|
|
|
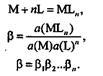 ( 1.1, 1.2,1.3)
( 1.1, 1.2,1.3)
Если коэффициенты активности реагентов равны единице, то равновесные активности равны равновесным концентрациям. Тогда константа устойчивости комплекса равна его концентрационной константе устойчивости:
Знание констант устойчивости комплексов позволяет рассчитывать равновесные концентрации частиц в растворах, проводить сравнительную оценку прочности комплексов и т. д.
Лиганды в растворе могут находиться в различных формах и участвовать в побочных равновесиях. Чтобы учесть все формы нахождения лиганда в растворах, вводят понятие условной концентрационной константы устойчивости комплекса или условной концентрационной константы нестойкости комплекса  (1.4)
(1.4)
Oтношение [L]/[cL] называется активной долей лиганда (α-доля, коэффициент конкурирующих реакций). Оно характеризует мольную долюлигандов в растворе, находящихся в свободном состоянии:
 (1.5)
(1.5)
Подставим в выражение (7.4) для р величину [L] согласно уравнению (7.8) и учтем соотношение Г7.71. Тогда:
 (1.6)
(1.6)
Формула (1.6) устанавливает связь между β и β':
β = β'/α".
Числовые значения условных констант устойчивости и нестойкости комплексов изменяются с изменением условийпроведения реакций. Тем не менее, они используются в практических расчетах, так как позволяют формально учитывать побочные реакции с участием лигандов.
|
|
|
На процессы комплексообразования в растворах оказывают влияние различные факторы: рН среды, концентрация лиганда, присутствие посторонних ионов, образующих малорастворимые соединения с металлом-комплексообразователем, ионная сила раствора, температура.
4. Иллюстративный материал:
Комплексы металлов с разными координационными числами:
а) координационное число 2:
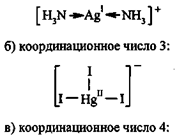
|

|

г) координационное число 5:

г) координационное число 6:

|

5. Литература:
Основная: 1, 2, 3, 4, 5.
Дополнительная: 7, 8.
6. Контрольные вопросы:
· Типы комплексных соединений и их характеристика.
· Дентантность. Координационное число.
· Равновесия реакций комплексообразования.
· Константы нестойкости и константы устойчивости комплексных соединений.
· Влияние различных факторов на процессы комплексообразования в растворах.
· Типы неорганических комплексных соединений, применяемых в аналитике.
Дата добавления: 2016-01-05; просмотров: 36; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
