Лекция 6. Применение ЗДМ к окислительно-восстановительным равновесиям и их роль в аналитической химии.
2. Цель лекции: Рассмотреть применение ЗДМ к окислительно-восстановительным равновесиям. Дать понятие об окислительно-восстановительных системах и константе равновесия ОВР.
3. Тезисы лекции: Многие методы химического анализа основаны на использовании окислительно-восстановительных реакций, в которых происходит
взаимодействие веществ, сопровождающееся передачей электронов.
Рассмотрим окислительно-восстановительную реакцию:
2FeCl3 + SnCl2 = 2 FeCl2 + SnCl4
2Fe3+ + Sn2+ = 2 Fe2+ + Sn4+
Здесь окислителем являются ионы Fe3+, а восстановителем - ионы Sn2+.
Соответствующие полуреакции можно записать в виде:
Fe3+ + e = Fe2+
Sn2+ - 2e = Sn4+
Здесь имеются две редокс-пары Fe3+/Fe2+ и Sn4+/Sn2+, каждая из которых содержит окисленную форму (Fe3+, Sn4+) и восстановленную форму(Fe2+, Sn4+).
Редокс-пара − это система из окисленной и восстановленной форм данного вещества, в которой окисленная форма является акцептором электронов и восстанавливается, принимая электроны, а восстановленная форма выступает в роли донора электронов и окисляется, отдавая электроны. В любой окислительно-восстановительной реакции участвуют, по крайней мере, две редокс-пары.
Эффективность окислительных или восстановительных свойств данного вещества зависит от его природы, от условий протекания ОВР и определяется величиной электродного потенциала редокс-пары (редокс-потенциала).Этот потенциал экспериментально определяют с помощью окислительно-восстановительного электрода.
|
|
|
Окислительно-восстановительный электрод − это электрод, состоящий из инертного материала (металлические платина, золото, вольфрам, титан, графит), погруженного в водный раствор, в котором имеются окисленная и восстановленная формы данного вещества.
Окислительно-восстановительные потенциалы принято отсчитывать от потенциала стандартного водородного электрода, который условно принимается равным нулю. Потенциалы, отсчитываемые от потенциала стандартного водородного электрода, называют условными (относительными) потенциалами по водородной шкале.
По определению условный окислительно-восстановителъный потенциал редокс-пары (электродный потенциал редокс-пары) – это электродвижущая сила гальванической цепи, составленной из данного окислительно-восстановительного электрода и стандартного водородного электрода.
Если в окислительно-восстановительной реакции не участвуют ионы водорода, то в общем случае реальный условный окислительно-восстановительный потенциал Е редокс-пары описывается уравнением Нернста:
 (1.1)
(1.1)
где Ео - стандартный окислительно-восстановительный потенциал данной редокс-пары; п - число электронов, участвующих в окислительно-восста-новительной реакции; R = 8,314 Дж . моль-1К-1 - универсальная газовая постоянная; F - число Фарадея, равное 96485 Кл/моль; Т - температура в Кельвинах (К), а(ок) и а(вос) - активность окисленной и восстановленной форм.
|
|
|
Если в окислительно-восстановительных реакциях участвуют ионы водорода, то в выражение для окислительно-восстановительного потенциала ред-
окс-пары входят также активности ионов водорода а(Н3О).
Потенциалом реакции Е, или электродвижущей силой (ЭДС) реакции называют величину, равную разности электродных потенциалов редокс-пар.
Е = Е1о – Е2о (1.2)
Учет знака потенциала окислительно-восстановительной реакции позволяет определять направление протекания реакции в заданных условиях. Если Е > 0, то реакция протекает в прямом направлении. Если Е < 0, то реакция протекает в обратном направлении. Если же Е = 0, то система находится в состоянии устойчивого химического равновесия.
Окислительно-восстановительные потенциалы редокс-пар и, следовательно, потенциалы ОВР зависят от природы реагентов и растворителя, концентраций реагентов, рН среды, температуры, присутствия других веществ в растворе. От тех же факторов зависит и направление протекания окислительно-восстановительной реакции.
|
|
|
Состояние устойчивого химического равновесия в окислительно-восстановительных процессах характеризуется константой равновесия К, которая связана со стандартнымпотенциалом реакции Е° следующим образом:
 (1.3, 1.4)
(1.3, 1.4)
При комнатной температуре уравнения (1.3) и (1.4) переходят в уравнения:
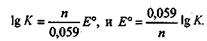 (1.5, 1.6)
(1.5, 1.6)
Чем больше стандартный потенциал реакции, тем выше ее константа равновесия и тем больше глубина протекания реакции.
Соотношение Е = Е1о – Е2о ≥ 0,5/n (1.7).
позволяет количественно оценивать возможность протекания окислительно-восстановительной реакции практически до конца, если известен стандартный окислительно-восстановительный потенциал этой реакции и число электронов, принимающих участие в реакции.
4. Иллюстративный материал:

Рис.1. Гальванический элемент.
1- водородный электрод, 2- вольтметр, 3- цинковый электрод,4- мембрана.
5. Литература:
Основная: 1, 2, 3, 4, 5.
Дополнительная: 7, 8.
6. Контрольные вопросы:
· Окислительно-восстановительные равновесия.
· Электродный потенциал.
· Уравнение Нернста.
· Электродвижущая сила.
· Факторы, влияющие на направление ОВР.
· Наиболее важные окислители и восстановители, применяемые в анализе.
|
|
|
Кредит №2
Дата добавления: 2016-01-05; просмотров: 64; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
