Все соли ртути ядовиты! 3 страница
Контрольная задача
ТЕМА: Анализ смеси катионов четвертой группы
Ход анализа катионов четвертой группы распадается на три стадии: выделение и определение катионов алюминия Al3+ и олова Sn4+; выделение и открытие катионов цинка; открытие катионов хрома и мышьяка.
Берут 8-9 капель исследуемого раствора, добавляют в пробирку 8 капель раствора аммиака и 6-7 капель перекисли водорода. И затем нагревают 6-7 минут на водяной бане. Осадок гидроксида алюминия Аl(OH)3 и гидроксида олова Sn(OH)4 выделяют центрифугированием. Центрифугат отделяют пипеткой и переносят в другую пробирку. Осадок растворяют в 5-6 каплях соляной кислоты и из полученного раствора открывают алюминий и олово, разделив раствор на две части.
Определение катиона Al3+ производят ализарином или нитратом кобальта. Ион Sn4+ открывают с нитратом висмута Bi(NO3)3, восстановив его до катиона Sn2+.
Центрифугат, содержащий анионы CrO42-, AsO43- и аммиакат цинка [Zn(NH3)4]2+, нейтрализуют уксусной кислотой (добавляя кислоту по каплям и помешивая стеклянной палочкой) и нагревают на водяной бане 2-5 минут, затем добавляют 5-6 капель раствора карбоната натрия и осаждают цинк в виде основной соли (ZnOH)2CO3. Осадок отделяют и растворяют в нескольких каплях уксусной кислоты. В полученном растворе катион Zn2+ обнаруживают реакцией с дитизоном или микрокристаллоскопической реакцией.
Фильтрат после отделения основной соли (ZnOH)2CO3 может содержать хромат- и арсенат-анионы CrO42-, AsO43-. Ион CrO42- открывают в виде CrO5, а AsO43- - восстанавливая до AsH3.
|
|
|
Анализ смеси катионов четвертой группы можно проводить дробным методом. Обычно рекомендуется начинать исследование с определения катиона Sn2+, чтобы избежать влияния процесса “старения”.
Определение Sn2+ и Sn4+. Они открываются из отдельной пробы общего раствора реакцией с нитратом висмута (предварительно восстановив Sn4+ до Sn2+). Катион Cr2+ открывают из отдельной пробы исследуемого раствора окислением пероксидом водорода до CrO5. Катион Zn2+ может быть открыт реакциями с дитизоном или сероводородом; As3+ и As+5 определяют способом, указанным выше, а алюминий – ализарином с “подкладкой из K4[Fe(CN)6] или алюминоном. Дробный метод определения служит чаще для предварительного исследования раствора на катионы четвертой группы.
Окончательные результаты получают, проверяя наличие тех или иных катионов систематическим ходом анализа.
Схема систематического хода анализа смеси катионов четвертой группы.
| 1. К испытуемому раствору добавляют раствор NH3 и Н2О2, нагревают и центрифугируют (или фильтруют) | |
| 2. Осадок (I) Al(OH)3, Sn(OH)4 обрабатывают HCl и определяют Al3+, Sn4+ частными реакциями: Al3+- при помощи ализарина или алюминона, а Sn4+ - сероводородной водой или восстанавливают до Sn2+ и действуют Bi3+ в щелочной среде. | 3. Центрифугат (I) CrO42-,AsO43-, [Zn(NH3)4]- -нейтрализуют СН3СООН, добавляют раствор Na2CO3 и центрифугируют (фильтруют). |
| 4. Осадок (II) (ZnOH)2CO3 растворяют в СН3СООН и определяют Zn2+ c дитизоном или микрокристаллоскопической реакцией. | 5. Центрифугат (II) CrO42-, AsO43-: а) CrO42-открывают в виде CrО5, б) AsO43- определяют реакцией восстановления до AsH3. |
|
|
|
Лабораторная работа № 6
ТЕМА: Пятая аналитическая группа катионов (катионы группы гидросидов нерастворимых в растворах гидроксидов NaOH и КОН)
Частные реакции катиона Fe2+
Растворы солей железа (II) окрашены в бледно-зеленый цвет, разбавленные растворы бесцветны.
1. Гидроксиды натрия и калия осаждают катион Fe2+ в виде гидроксида железа (II) Fe(OH)2:
Fe2+ + 2OH «Fe(OH)2
Свежеосажденный осадок имеет белый цвет. Однако на воздухе в результате частичного окисления кислородом осадок приобретает серо-зеленый цвет:
4Fe(OH)2 + 2H2O + O2 ® 4Fe(OH)3
Опыт: В пробирку налейте 2-3 капли раствора сульфата железа (II), добавьте 5 капель дистиллированной воды и 2 капли гидроксида натрия. Обратите внимание на цвет и характер осадка.
2. Раствор аммиака дает с катионом Fe2+ осадок гидроксида железа(II):
|
|
|
2NH4OH + FeSO4 ® Fe(OH)2¯ +(NH4)2SO4
Условия проведения опыта.
1. Реакция должна проводиться при рН =12-13.
2. Присутствие солей аммония препятствует выпадению осадка.
3. Кислород воздуха вызывает изменение окраски вследствие частичного окисления катионов Fe2+.
Опыт. В пробирку поместите 2-3 капли раствора сульфата железа (II), добавьте 4-5 капель 10% раствора хлорида или сульфата аммония, а затем 2-3 капли раствора гидроксида аммония. Проверьте, обрауется ли осадок.
3. Гексациано-(III) феррат калия K3[Fe(CN)6] дает с катионом Fe2+ синий осадок турнбулевой сини гексациано-(III) феррата железа(II):
2[Fe(CN)6]3- + 3Fe2+® Fe3[Fe(CN)6]2
Осадок не растворяется в воде.
Условия проведения опыта.
1. Реакция дает хорошие результаты при рН=3.
2. Свободные гидроксиды натрия и калия вызывают разложение турнбулевой сини.
3. Катионы Fe2+ и другие катионы пятой группы не мешают проведению реакции.
Опыт. Налейте в пробирку 2-3 капли раствора сульфата железа (II), добавьте 4-5 капель дистиллированной воды и 2 капли раствора гексациано-(III) феррата калия. Обратите внимание на цвет осадка. Проверьте растворимость в кислотах и щелочах.
4. Диметилглиоксим (реактив Чугаева) образует с катионом Fe2+ внутрикомплексную соль карминово-красного цвета состава:
|
|
|
Fe(C4H7N2O2)2 +NH3
Опыт. На предметное стекло поместите каплю анализируемого раствора, добавьте каплю реактива и каплю гидроксида аммония. В присутствии катиона Fe2+ раствор окрашивается в карминово-красный цвет.
Условия проведения опыта.
1. Реакция проводится при рН» 9 (в аммиачной среде).
2. Обнаружению катионов Fe2+ мешают катионы Mn2+, Ni2+.
5. a, a¢-дипиридил с катионом Fe2+ дает в кислых растворах комплексное соединение красного цвета.
Опыт. На предметное стекло поместите 2 капли анализируемого раствора и добавьте 2-3 капли 0,1 н раствора соляной кислоты и каплю солянокислогоо раствора реактива. При наличии катиона Fe2+ образуется красное окрашивание.
Условия проведения опыта.
1. Для проведения реакции требуется кислая среда.
2. Катионы железа(III) не мешают обнаружению железа (II).
6. Окисление катиона Fe2+в катион Fe3+.
Опыт. Возьмите 3-4 капли раствора соли железа (II) и прибавьте 3 капли 2 н раствора серной кислоты и 2-3 капли раствора азотной кислоты, смесь нагрейте до исчезновения бурой окраски:
6FeSO4 + 2H2SO4 + 2HNO3 ® 3Fe2(SO4)3 + 2NO +4H2O
6Fe2+ + 2H+ + NO3 ® 3Fe3+ + NO +2H2O
Условия проведения опыта.
1. Реакция проводится при рН< 7.
2 Для окисления берут 32 % азотную кислоту.
3. Реакция протекает лучше при нагревании.
Частные реакции катиона Fe3+
Растворы солей, содержащих катион Fe3+, имеют желтую или красно-бурую окраску.
1. Гидроксиды калия и натрия и аммония образуют с катионом Fe3+ красно-бурый осадок Fe(OH)3:
Fe3+ + 3OH- ® Fe(OH)3
Гидроксид железа (III) в отличие от гидроксида хрома и гидроксида алюминия не растворяется в избытке щелочи. ПР(Fe(OH)3)=3,2 ×10-38 очень мало, следовательно, Fe(OH)3 не будет растворятся и в солях аммония.
Условия проведения опыта.
1. Реакция проводится при рН> 7.
2. Реакцию можно проводить в присутствии солей аммония.
Опыт. Возьмите 3-4 капли раствора хлорида железа (III), добавьте 3-4 капли дистиллированной воды и 2-3 капли щелочи. Обратите внимание на характер и цвет осадка. Половину осадка вместе с жидкостью перенесите в другую пробирку. В первую пробирку прибавьте 5-7 капель раствора хлорида аммония NH4Cl, а во вторую 4-5 капель соляной кислоты. Где будет растворяться осадок? Напишите уравнения химических реакций.
2. Гексациано-(II) феррат калия K4[Fe(CN)6] образует с катионом Fe3+ темно-синий осадок берлинской лазури гексациано-(II) феррата железа Fe4[Fe(CN)6]3. Реакцию лучше проводить в слабокислых растворах:
3[Fe(CN)6]4- + 4Fe3+ ® Fe4[Fe(CN)6]3
Опыт. Возьмите в пробирку 2-3 капли раствора сульфата железа (III), добавьте 3-4 капли дистиллированной воды, 1-2 капли соляной кислоты и 2 капли раствора гексациано-(II) феррата калия. Образуется синий осадок или окрашивание. Реакцию можно проводить капельным методом на фильтровальной бумаге или на предметном стекле. Катионы Fe2+ и др. не мешают открытию катионов Fe3+.
Условия проведения опыта.
1. Реакция проводится при рН< 3
2. Свободные щелочи разлагают берлинскую лазурь.
3. Избыток K4[Fe(CN)6] не желателен, так как может вызвать образование растворимой формы берлинской лазури.
3. Роданид аммония NH4SCN образует с катионом Fe3+ роданид железа кроваво-красного цвета. Наличие ионов Fe2+ не мешают реакции:
Fe3+ + 3SCN-«Fe(SCN)3
Опыт. В пробирку налейте 2-3 капли раствора сульфата железа (III), прибавьте 4 капли воды и 2 капли раствора роданида калия. Обратите внимание на окраску раствора.
Условия проведения опыта.
1. Реакция проводится при рН < 3.
3. Для полноты протекания реакции необходимо использовать концентрированные растворы NH4SCN или KSCN.
Частные реакции катиона Mn2+
Растворы солей марганца имеют бледно-розовую окраску, а разбавленные растворы бесцветны.
1. Гидроксиды натрия и калия осаждают катион Mn2+ с образованием белого осадка гидроксида марганца (II), растворимого в кислотах, но нерастворимого в щелочах:
Mn2+ + 2OH- ® Mn(OH)2
Осадок на воздухе буреет вследствие перехода катиона Mn2+ в катион Mn4+, при этом образуется марганцовватистая кислота MnO(OH)2 или H2MnO3.
Опыт. Возьмите в пробирку 3-4 капли раствора сульфата марганца, добавьте 3-4 капли воды и 4-5 капель раствора щелочи. Образуется осадок, который изменяет свою окраску до желто-бурой. Реакция проводится при рН= 9-10.
2. Аммиак осаждает катион Mn2+ в виде Mn(OH)2. В присутствии солей аммония осаждения не происходит, Mn(OH)2 в отличии от MnO(OH)2 растворим в разбавленной серной кислоте.
Опыт. Налейте в пробирку 2-3 капли раствора сульфата марганца, добавьте 2-4 капли воды и 3 капли раствора аммиака. Получается белый осадок, растворимый в минеральных кислотах и в избытке гидроксида аммония (особенно в присутствии солей аммония).
Условия проведения опыта.
1. Реакция проводится при рН=9-10.
2. Наличие катионов NH4+ способствует растворению осадка.
3. Окисление катиона Mn2+ в анион MnO4-.
Эта реакция имеет очень большое значение для обнаружения катионов Mn2+, так как позволяет открывать его в присутствии катионов всех аналитических групп. В качестве окислителей можно использовать оксид свинца PbO2, персульфат аммония (NH4)2S2O8 и другие окислители с окислительно-восстановительным потенциалом выше 1,51.
а) Окисление оксидом свинца:
2Mn(NO3)2 + 5PbO2 + 6HNO3® 2HMnO4 + 5Pb(NO3)2 + 2H2O
2Mn2+ + 5PbO2 + 4H+® MnO4-+ 5Pb2+ + 2H2O
Опыт. Возьмите в пробирку немного оксида свинца, добавьте туда 5-7 капель азотной кислоты и нагрейте. Через 1-2 минуты отфильтруйте диоксид свинца, обратите внимание на окраску раствора. Если окраска раствора будет малиновой, то диоксид свинца содержит следы марганца и для опыта непригоден. Если же окраска отсутствует, то прибавьте каплю разбавленного раз в десять исследуемого на катион Mn2+ раствора и перемешайте его.
Условия проведения опыта.
1. Реакция должна проводится при рН< 2.
2. Хлорид марганца брать нельзя.
3. Анионы-восстановители мешают открытию ионов Mn2+ в виде МnO4 -, поэтому их следует предварительно удалить.
4. Умеренное нагревание способствует проведению реакции.
 б) Окисление персульфатом аммония в присутствии нитрата серебра AgNO3 (катализатор).
б) Окисление персульфатом аммония в присутствии нитрата серебра AgNO3 (катализатор).
2MnSO4 + 5(NH4)2S2O8 + 8H2O® 2HMnO4 + 5(NH4)2SO4 +7H2SO4
2Mn2+ + 5S2O82- + 8H2O ® 2MnO4- + 10SO42- +10H+
Опыт. Возьмите немного персульфата аммония и поместите в пробирку, прибавьте 8 капель 2 н раствора азотной кислоты, 2 капли раствора нитрата серебра и нагрейте. В нагретую смесь внесите на палочке разбавленного исследуемого раствора и перемешайте. Если окраска слабая, то можно еще прибавить исследуемого раствора. Если же наоборот, выпадает бурый осадок MnO(OH)2, то, следовательно, концентрация катиона Mn2+ слишком велика. В этом случае опыт повторите, разбавив испытуемый раствор водой (1 капля раствора на 4 капли воды) и нагрейте. Катионы Mn2+ окисляются в марганцевую кислоту, имеющую характерный малиновый цвет.
Условия проведения опыта.
1. Опыт проводится при рН< 2.
2. Реакция протекает в присутствии катализатора (ионов Аg+).
3. Концентрация соли марганца должна быть минимальной.
4. Восстановители Cl -, Br -, I - и др. мешают проведению реакции (хлорид марганца брать нельзя).
5. Нагревание способствует протеканию реакции.
Частные реакции катиона Bi3+
1. Гидролиз – одна из характерных реакций на висмут.
Опыт. Возьмите раствор хлорида висмута BiCl3 или нитрата висмута Bi(NO3)3 и сильно разбавьте водой. При этом выпадает белый осадок основной соли хлорида висмута:
BiCl3 + 2H2O ® Bi(OH)2Cl¯ + 2HCl
Образовавшаяся основная соль неустойчива, выделяет молекулу воды, образуя новую соль – хлористый висмутил:
Сl

 Bi ¾ OH ® BiOCl¯ + H2O
Bi ¾ OH ® BiOCl¯ + H2O
OH
Условия проведения опыта.
1. Реакцию гидролиза лучше проводить с хлоридом висмута, так как хлористый висмутил менее растворим, чем нитрат висмутила BiONO3.
2. Если используется нитрат висмута, то необходимо к раствору добавить 2-3 капли хлорида аммония NH4Cl.
3. Соли сурьмы мешают проведению реакции.
4. Хлористый висмутил не растворяется в винной кислоте (в отличие от хлористого стибила SbOCl).
2. Гидроксиды калия и натрия дают с катионом Bi3+ белый осадок гидроксида висмута Bi(OH)3, растворимый в кислотах, но нерастворимых в щелочах:
Bi3+ + 3OH- ® Bi(OH)3
Опыт. В пробирку поместите 3-4 капли раствора хлорида висмута BiCl3 и прибавьте 2-3 капли раствора щелочи. Выпадает белый осадок.
3. Восстановление катионов Bi3+ до металлического висмута (осадок черного цвета).
Опыт. Возьмите 3 капли раствора хлорида олова SnCl2, прибавьте избыток гидроксида натрия, чтобы первоначально выпавший осадок Sn(OH)2 растворился:
SnCl2 + 2NaOH ® 2NaCl + Sn(OH)2¯ или H2SnO2
Sn2+ + 2OH- ® + Sn(OH)2 ¯
H2SnO2 + 2NaOH ® Na2SnO2 + 2H2O
H2SnO2 + 2OH- ® SnO22-+ 2H2O
К полученному щелочному раствору прибавьте две капли раствора соли висмута. Выпадет осадок металлического висмута:
Bi(NO3)3 + 2NaOH ® Bi(OH)3¯ + 3NaNO3
Bi3+ + 3OH- ® Bi(OH)3
2Bi(OH)3 + 3Na2SnO2® 2Bi¯ + 3Na2SnO3 + 3H2O
2Bi(OH)3 + 3SnO22- ® 2Bi¯ + 3SnO32- + 3H2O
Условия проведения опыта.
1. Для проведения реакции берется свежеприготовленный раствор хлорида олова (II).
2. Не следует брать большого избытка щелочи.
3. Проведению реакции мешают катионы Ag+, Hg2+ и др.
Частные реакции катиона Mg2+
1. Гидроксиды калия и натрия образуют с катионом Mg2+ белый аморфный осадок гидроксида магния Mg(OH)2, растворимый в кислотах и солях аммония.
Опыт. В первую пробирку возьмите 4 капли раствора соли магния, прибавьте 4 капли насыщенного раствора хлорида аммония. Во вторую пробирку возьмите 4 капли раствора соли магния и прибавьте 4 капли воды (чтобы концентрация растворов была одинакова). Затем в обе пробирки прибавьте осадитель – гидроксид аммония. Почему не выпадает осадок в первой пробирке? Дайте объяснение.
2. Гидрофосфат натрия Na2HPO4 дает с катионом магния в присутствии гидроксида и хлорида аммония белый кристаллический осадок фосфата магния-аммония MgNH4PO4:
MgSO4 + Na2HPO4 + NH4OH ® MgNH4PO4¯ +Na2SO4 + H2O
Mg2+ + HPO42- + NH4OH ® MgNH4PO4 + H2O
Хлорид аммония добавляют, чтобы не выпал аморфный осадок гидроксида магния Mg(OH)2.
Опыт. Возьмите 3-4 капли раствора соли магния и смешайте с 4-5 каплями 2Н раствора соляной кислоты и 3-5 каплями раствора гидрофосфата натрия Na2HPО4. После этого прибавьте к раствору по одной капле 2 Н раствора аммиака, перемешивая раствор после каждой капли. Вначале аммиак нейтрализует прибавленную кислоту, причем образуется хлорид аммония, препятствующий образованию гидроксида магния. После окончания реакции выпадает характерный кристаллический осадок – фосфат магния-аммония MgNH4PO4.
Условия проведения опыта.
1. Реакция проводится в аммиачной среде при рН=8.
2. Избыток катионов NH4+ мешает выпадению осадка MgNH4PO4.
3. Не следует брать избыток соляной кислоты.
4. Катионы всех аналитических групп, кроме первой, могут мешать проведению реакции.
3. Микрокристаллоскопическая реакция.
Опыт. Каплю раствора соли магния, содержащую немного хлорида аммония поместите на предметное стекло и обработайте в парах 25% раствора аммиака. Затем поместите в каплю кристаллик гидрофосфата натрия Na2HPO4× 12Н2О и рассмотрите кристаллы под микроскопом.
4. Магнезон 1(пара-нитробензолазорезорцин) или магнезон II (пара-нитробензолазо-a-нафтол)
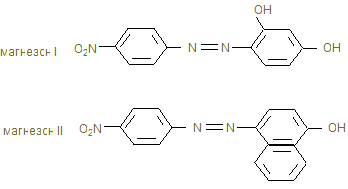
в щелочной среде дает красную или красно-фиолетовую окраску. Эта реакция основана на свойстве гидроксида адсорбировать некоторые красители.
Опыт. На фарфоровую пластинку (предметное стекло или пробирку) поместите 1-2 капли анализируемого на катион Mg2+ раствора и добавьте 1-2 капли щелочного раствора реактива. Появляется синяя окраска или синий осадок. Если раствор имеет сильнокислую реакцию, то появляется желтая окраска. В данном случае надо добавить несколько капель щелочи.
Условия проведения опыта.
1. Реакцию необходимо проводить в щелочной среде при рН>10.
2. Реакции мешает наличие солей аммония.
Частные реакции катиона Sb3+
Гидролиз. При действии воды на соли сурьмы они подвергаются гидролизу в большей степени, чем соли висмута:
SbCl3 +H2O «SbOCl¯ +2HCl
Опыт. Несколько капель раствора соли сурьмы разбавьте водой - выпадает белый осадок хлористого стибила или хлористого антимонила.
Условия проведения опыта.
1. рН среды должен быть не меньше 3-4. В избытке кислоты осадок может не выделиться.
2.Нагревание способствует выпадению осадка
3.Наличие винной кислоты в растворе препятствует выпадению осадка (в отличие от соединений висмута).
2. Тиосульфат натрия Na2S2O3 дает с катионом Sb3+ при нагревании красный осадок сероокиси сурьмы (III) Sb2O2S2:
2SbCl3 +2Na2S2O3 + 3H2O ® Sb2OS2¯ +2H2SO4 + 4NaCl +2HCl
2Sb3+ +2S2O32- + 3H2O ® Sb2OS2 +2SO42-+ 4NaCl +6H+
При наличии ионов Bi3+ выпадает черный осадок, который будет маскировать окраску сероокиси сурьмы.
Опыт. В пробирку налейте 2-3 капли раствора хлорида сурьмы (III), добавьте каплю серной кислоты и 5-6 капель воды, бросьте кристалик тиосульфата натрия и нагрейте. Выпадает красный осадок сероокиси сурьмы.
Условия проведения опыта.
1. Избыток серной кислоты разлагает реактив с образованием оксида серы (IV) SO2 и серы.
2. Наличие катионов Сu2+, Hg2+ и др., образующих труднорастворимые сульфиды, мешает проведению реакции.
3. Восстановление иона Sb3+до металлической сурьмы. Восстановить катионы Sb3+ до металлической сурьмы можно металлами, стоящими в ряду напряжения левее сурьмы.
Опыт. На хорошо очищенную наждачной бумагой цинковую, алюминивую или железную пластинку нанесите каплю подкисленного соляной кислотой анализируемого раствора. После некоторого времени поверхность пластины под каплей становится черной (выделение металлической сурьмы).
3Zn +2SbCl3 ® 2Sb¯ + 3ZnCl2
Условия проведения опыта.
1. Раствор, содержащий ионы Sb3+, должен иметь реакцию при рН=1-2.
2. Испытуемый раствор не должен содержать сильных окислителей.
3. Почернение пластины происходит через 2-3 минуты.
Частные реакции катиона Sb5+
1. Гидролиз. При разбавлении растворов солей сурьмы водой образуется белый осадок (основная соль сурьмы), растворимый в избытке соляной кислоты:
[SbCl6]- + 2H2O ® SbO2Cl¯ + 5Cl- + 4H+
2. Гидроксиды натрия, калия и аммиак дают с катионом Sb5+ белый осадок метасурьмяной кислоты:
[SbCl6]- + 5ОН- ® HSbO3¯ +6Cl- + 2H2O
3. Металлы – цинк, олово, магний, железо – действуют на катион Sb5+ так же, как и на катион Sb3+.
4. Метиловый фиолетовый в солянокислых средах с катионом дает фиолетовое окрашивание.
Опыт. В пробирку возьмите 2-3 капли анализируемого раствора, 2-3 капли соляной кислоты и 1-2 капли раствора нитрита натрия NaNO2. Затем добавьте 3 капли насыщенного раствора мочевины и слегка нагрейте. 2 капли приготовленного раствора поместите в пробирку и налейте 1 мл водного раствора реагента. При наличии Sb5+ раствор приобретает фиолетово-синюю окраску.
Условия проведения опыта.
1. Для окисления ионa Sb(III) добавляют раствор нитрита натрия (лучше брать кристаллический)
2. Для удаления избытка иона NO2 - добавляется насыщенный раствор мочевины.
3. Необходимо проведение контрольного опыта.
Опыт. В пробирку налейте 2-3 капли дистиллированной воды, добавьте 2-3 капли хлороводородной кислоты (d=1,19), 1-2 капли раствора нитрита натрия и 3 капли насыщенного раствора мочевины и слегка нагрейте.
После этого 2 капли приготовленного раствора поместите в пробирку и добавьте 2 мл водного раствора реагента. Раствор не должен иметь фиолетовой окраски.
Контрольная задача
ТЕМА: Анализ смеси катионов пятой группы
При систематическом ходе анализа катионов пятой группы учитывается некоторые особенности их соединений: гидролизуемость солей висмута и сурьмы, растворимость основных солей сурьмы в винной кислоте, нерастворимость оксида марганца в разбавленной азотной кислоте, растворимость гидроксида магния в растворе хлорида аммония.
Открытие катионов Fe2+, Fe3+.
Катионы Fe2+ обнаружают раствором гексациано-(III) феррата калия, а катионы Fe3+ - раствором гексациано-(II) феррата калия в солянокислой среде в присутствии катионов пятой группы.
Открытие катионов Sb3+, Bi3+.
При наличии осадка его растворяют в соляной кислоте, доводят рН раствора до 4-6. Затем добавляют пятикратный объем дистиллированной воды. Образовавшийся осадок основных солей сурьмы и висмута фильтруют, обрабатывают его раствором винной кислоты (1н). Основные соли и гидроксид сурьмы при этом растворяют в винной кислоте – производные висмута остаются в осадке. В полученном виннокислом растворе открывают сурьму (III) любой характерной реакцией, лучше сероводородной водой. Осадок, содержащий основные соли висмута, промывают дистиллированной водой и растворяют в концентрированной соляной кислте. Катионы висмута открывают хлоридом олова(II) в щелочном растворе или другими частными реакциями.
Открытие катионов Mg2+, Mn2+, Fe3+.
Фильтрат, содержащий катионы Fe2+, Mg2+, Mn2+, Fe3+ обрабатывают раствором гидроксида натрия или калия, добавляют перекись водорода, нагревают и фильтруют. Полученный осадок гидроксида железа (III), оксида марганца и гидроксида магния обрабатывают раствором хлорида аммония для растворения гидроксида магния. Оставшийся осадок гидроксида железа (III), оксида марганца обрабатывают разбавленной азотной кислотой для растворения гидроксида железа (III). В полученном растворе открывают катионы Fe3+ характерными реакциями.
Дата добавления: 2016-01-05; просмотров: 23; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
