Все соли ртути ядовиты! 2 страница
К четвертой группе относятся катионы Al3+, Cr3+, Zn2+, As+3, As+5, Sn2+, Sn4+. Алюминий, находясь в начале третьего малого периода Периодической системы Д.И. Менделеева, имеет законченные двух- и восьмиэлектронные слои внешней оболочки. Другие элементы в средней части четвертого большого периода, у них происходит достройка третьего электронного слоя от 8 до 18 электронов.
Хром является переходным элементом. Он находится в первой половине четвертого периода, в конце четвертого ряда и имеет несколько отличные свойства от всех остальных катионов этой группы. Он обладает выраженной способностью к комплексообразованию. Гидратированный гидроксид хрома по своим свойствам очень близок к гидратированному гидроксиду алюминия.
Цинк расположен во второй половине четвертого большого периода и имеет законченный 18-электронный слой.
Алюминий и цинк обладают постоянной, а остальные элементы переменной степенью окисления.
Групповым реагентом на катионы IV группы является гидроксид натрия или гидроксид калия (в избытке). Образующиеся гидроксиды амфотерны, т.е. способны диссоциировать в растворе и по типу основания, и по типу кислоты. Наблюдается также сложное явление диссоциации в связи с тенденцией к отщеплению молекулы воды:
Ме3+ + 3ОН- «Ме(ОН)3 «Н2О + Н+ + МеО2-
Первая схема соответствует диссоциации в растворе гидроксида цинка, а третья схема отвечает диссоциации гидроксидов алюминия и хрома.
|
|
|
Кислота подавляет диссоциацию гидроксида по кислотному варианту и связывает ионы ОН- в практически недиссоциированные молекулы воды. Поэтому равновесие смещается слева направо:
Al(OH)3 + 3HCl ® AlCl3 + 3H2O
Al(OH)3 + 3H+ ® Al3+ + 3H2O
Сильная щелочь подавляет диссоциацию по типу основания и одновременно связывает ионы Н+ в Н2О:
H3CrO3 + NaOH ® NaCrO2 + 2H2O
Хроматы и алюминаты устойчивы только в присутствии избытка гидроксидов. Большинство солей катионов IV группы подвергаются гидролизу, например:
Sn2+ +2H2O «Sn(OH)2 + 2H+
Al2(CO3)3 + 3H2O ® 2Al(OH)3¯ +3CO
2ZnCO3 + 2H2O ® (ZnOH)2CO3¯ +H2CO3
Гидроксиды NaOH, КOH со всеми катионами IV группы (исключая мышьяк) образуют гидроксиды, растворяющиеся в избытке реагента:
CrCl3 + 3NaOH ® Cr(OH)3¯ + 3NaCl
Cr(OH)3 + NaOH ® NaCrO2 + 2H2O
Опыт. Проверьте действие гидроксидов на катионы IV группы.
Возьмите пять пробирок и внесите в каждую по 1 капле раствора соответствующей соли (AlCl3, CrCl3, ZnCl2, SnCl2, Na2HАsO4), добавьте по 1 капле раствора гидроксида натрия или гидроксида калия, перемешайте стеклянной палочкой, отметьте образование и цвет осадков, напишите уравнения химических реакций.
Налейте в каждую из них по 2-3 капли раствора гидроксида натрия или гидроксида калия, перемешайте стеклянной палочкой и проверьте растворение осадков в избытке реактива.
|
|
|
Обратите внимание на то, что гидроксид хрома в присутствии катионов Zn2+ не рстворяется в избытке гидроксида натрия вследствии образования цинката хрома Cr(ZnO2)3 (или Cr2O3 × 3ZnO). Это явление носит название соосаждения и может быть использовано при анализе.
Растворимые карбонаты Na2CO3, K2CO3, (NH4)2CO3 осаждают катионы Al3+, Cr3+, Sn2+, Sn+4 в виде соответствующих гидроксидов, катионы Zn2+ в виде основных солей. As+3, As+5 осадка не образуют:
2AlCl3 + 3Na2CO3 ® Al2(CO3)3 + 6NaCl
Al2(CO3)3 + 3H2O ® 2Al(OH)3¯ +3CO2
Основные соли цинка растворяются в аммиаке в присутствии хлорида аммония NH4Cl.
Проведите реакции карбоната натрия с катионами Cr3+, Al3+, Zn2+, Sn2+, As3+.
Частные реакции катиона Al3+
1. Раствор аммиака осаждает катион Al3+:
Al3+ + 3OH- ® 2Al(OH)3
Гидроксид алюминия не растворяется в растворах солей аммония. Если алюминий находится в виде алюмината, то для осаждения его аммиаком необходимо разрушить алюминат, действуя какой-либо минеральной кислотой:
NaAlO2 + 4HCl ® AlCl3 + NaCl + 2H2O
AlO2- + 4H+ ® Al3+ + 2H2O
AlCl3 + 3NH4OH ® Al(OH)3¯ +3NH4Cl
Al3++ 3OH- ® Al(OH)3
2. Ализарин и некоторые его производные образуют в аммиачной среде с гидроксидом алюминия труднорастворимое соединение ярко-красного цвета, называемое алюминиевым лаком. Реакцию выполняют капельным методом.
|
|
|
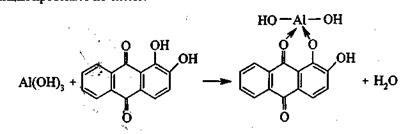
Опыт. На полоску фильтровальной бумаги нанесите 1-2 капли раствора хлорида алюминия, затем подержите 1-2 минуты над склянкой с концентрированным раствором аммиака.
Катион Al3+ осаждается в виде гидроксида Al(OH)3. На полученное влажное пятно поместите каплю спиртового раствора ализарина и снова подержите в парах аммиака, при этом ализарин окрашивается в красновато-фиолетовый цвет, так как образуется ализаринат аммония. Для разрушения маскирующей окраски подсушите бумажку над пламенем горелки, окраска становится бледно-желтой, а пятно ализаринового лака приобретает розово-красный цвет. Присутствие катионов Cr3+, Zn2+, Sn2+, Fe3+ мешает открытию катиона Al3+ таким способом; определение катиона Al3+ в этом случае проводят следующим образом: на полоску фильтровальной бумаги помещают каплю раствора гексацианоферрата калия K4[Fe(CN)6], а затем в центр пятна вносят каплю исследуемого катиона Al3+ раствора. После этого получают пятно, состоящее из окрашенной центральной части и водянистого бесцветного кольца. Осадок содержит катионы Zn2+, Sn2+ и частично катион Cr3+, а катион Al3+ содержится в периферической части. Это пятно выдерживают над парами аммиака, который осаждает катион Al3+ в виде гидроксида. Затем пятно перечеркивают капилляром, содержащем ализарин, снова обрабатывают парами аммиака и высушивают, держа бумажку высоко над пламенем горелки. При наличии катиона Al3+ внешняя часть кольца в тех местах, которые перечеркнуты ализарином, окрашивается в оранжево-красный цвет. Проделайте эту реакцию.
|
|
|
3. Алюминон дает с катионом Al3+ внутрикомплексную соль, имеющую красную окраску.
Опыт. Возьмите 4-5 капель испытуемого раствора, поместите в пробирку и добавьте 2-3 капли 2 Н раствора уксусной кислоты и 4-5 капель раствора алюминона. Пробирку со смесью нагрейте на водяной бане, перемешайте, добавьте раствор аммиака до щелочной реакции, а затем 3-4 капли 2 Н раствора карбоната аммония (NH4)2CO3. В этом случае имеется катион Al3+, выдает красный осадок или появляется красная окраска.
Условия проведения опыта.
1. Ионы Fe3+ и Bi3+ мешают проведению этой реакции.
2. Реакция протекает при рН = 8,5 – 9,5.
4. Реакция на катион Al3+ сухим путем.
Очень разбавленный раствор нитрата кобальта Co(NO3)2 дает с катионом Al3+ алюминат кобальта Сo(AlO2)2 имеющий синий цвет, называемый тенаровой синью:
2Al2(SO4)3 + 2Co(NO3)2 ® 2Co(AlO2)2 + 6SO3 +4NO2 + O2
Опыт. Возьмите полоску фильтровальной бумажки, смочите ее раствором и разбавленной азотной кислотой, подержите в токе теплого воздуха, смочите разбавленным раствором нитрата кобальта, а затем сожгите. При наличии катиона алюминия, пепел, который получается при сжигании, имеет темно-синюю окраску. Проведению этой реакции мешают катионы Zn2+, Cr3+, Cu2+, Ni2+.
Частные реакции катиона Cr3+
Хром образует два ряда устойчивых солей: соли оксида хрома и соли хромовой и двухромовой кислот. Растворы солей, содержащие катион Сr3+, имеют зеленую или фиолетовую окраску; растворы, имеющие хромат-ион CrO42- - желтую; дихромат-ион CrО72-- оранжевую.
1. Водный раствор аммиака образует с катионом Сr3+ oсадок гидроксида хрома Cr(OH)3 серо-зеленого (или серо-фиолетового) цвета:
CrCl3 + NH4OH ® Cr(OH)3¯ + 3NH4Cl
Cr3+ + 3OH- ® Cr(OH)3
2 Гидроксид натрия дает также осадок гидроксида хрома:
CrCl + 3NaOH ® Cr(OH)3¯ + 3NaCl
Cr3+ + 3OH- ® Cr(OH)3
При избытке гидроксидов натрия и калия гидроксид хрома растворяется с образованием хромита NaCrO2, имеющего красивую ярко-зеленую окраску:
Cr(OH)3 + NaOH ® NaCrO2 +2H2O
Cr(OH)3 + OH- «CrO2- +2H2O
Хромит натрия в отличие от алюмината натрия NaAlO2 гидролизуется водой с образованием гидроксида хрома:
нагр.
NaCrO2 +2H2O «Cr(OH)3¯ + NaOH
CrO2- +2H2O «Cr(OH)3¯ + OH-
Опыт. Налейте в первую пробирку 3-4 капли раствора хлорида хрома CrCl3, а во вторую 3-4 капли раствора хлорида алюминия AlCl3, в каждую добавьте 10-12 капель 2 Н раствора гидроксида натрия и нагрейте. Обратите внимание, что в первой пробирке образовавшийся вначале осадок гидроксида хрома при дальнейшем добавлении щелочи растворяется, а при нагревании выпадает в виде серо-зеленой массы. Во второй пробирке выпавший осадок гидроксида алюминия растворяется в избытке гидроксида натрия, но при нагревании осадка не образуется. Опишите условия проведения реакции.
Реакция соосаждения. Гидроксиды натрия и калия при действии на катион Cr3+ в присутствии катиона Zn2+ образуют осадок цинката хрома, нерастворимого в избытке осадителя.
Проделайте данный опыт, взяв 3 капли раствора CrCl3 и 3 капли ZnCl2, перемешайте стеклянной палочкой и добавьте 10-12 капель гидроксида натрия. Опишите результаты и напишите уравнения реакции.
3. Реакции окисления катиона Cr3+в CrO42- могут протекать в щелочной и кислой средах.
Окисление в щелочной среде можно проводить пероксидом водорода Н2О2 или пероксидом натрия Na2O2. Последовательный ход процесса:
CrCl3 + 3NaOH ® Cr(OH)3¯ +3NaCl
Cr3+ + 3OH- ® Cr(OH)3
Cr(OH)3 + NaOH ® NaCrO2 + 2H2O
2NaCrO2 + 3H2O2 +2NaOH ® 2Na2CrO4 + 4H2O
2CrO2- + 3H2O2 +2OH- ® 2CrO42- + 4H2O
Опыт. Налейте в пробирку 3-4 капли раствора соли хрома (III), добавьте 2-3 капли раствора пероксида водорода и 4 капли раствора гидроксида натрия. Содержимое пробирки нагрейте в течении 3-4 минут. В присутствии ионов СrО42- раствор над осадком окрасится в желтый цвет. После охлаждения осадок отфильтруйте и к фильтрату добавьте азотной кислоты до появления оранжевой окраски. Затем прилейте 6-8 капель смеси эфира с изоамиловым спиртом и 2-3 капли раствора пероксида водорода. Смесь перемешайте. Проявление интенсивно-синей окраски верхнего слоя указывает на образование надхромовой кислоты Н2CrO6 (CrO5).
Условия проведеия реакции.
1. Окисление Cr3+до CrO4 - должно протекать в щелочной среде.
2. Превращение CrO42 - в Н2CrO6 протекает в кислой среде.
Обнаружение хрома этой реакцией можно проводить в присутствии катионов всех аналитических групп.
Окисление катиона Cr3+ в кислой среде перманганатом калия KМnO4 протекает до аниона Cr2O72-:
5Cr2(SO4)3 + 6KMnO4 + 11Н2O ® 5H2Cr2O7 + 6MnSO4 + 3K2SO4 + 6H2SO4
10Cr3+ + 6MnO4- + 11H2O ® 5Cr2O72- + 6Mn2+ + 22H+
При этой реакции малиновая окраска анионов MnO4- может исчезнуть и появиться бурый осадок гидроксида двуокиси марганца MnO(OH)2 или марганцоватистой кислоты H2MnO3. Выпадение осадка объясняется взаимодействием избытка перманганата калия с образовавшейся солью – сульфатом марганца MnSO4. Реакция лучше идет при нагревании.
2KMnO4 + 3MnSO4 + 7H2O ® 5MnO(OH)2 + K2SO4 + 2H2SO4
2MnO4- + 3Mn2+ + 7H2O ® 5MnO(OH)2 + 4H+
Опыт. Налейте в пробирку 4-5 капель раствора сульфата хрома Cr2(SO4)3, 3-4 капли раствора серной кислоты и 10 капель 0,1 н раствора перманганата калия. Пробирку со смесью нагрейте несколько минут на водяной бане. Обратите внимание на изменение окраски - малиновый цвет раствора переходит в оранжевый.
Окисление катиона Сr3+ в дихромат-ион Cr2O72 -персульфатом аммония (NH4)2S2O8 в кислой среде протекает с образованием дихромат-иона
Cr2(SO4)3 + 3(NH4)2S2O8 + 7H2O® (NH4)2Cr2O7 +2(NH4)2SO4 + 7H2SO4
2Cr3++ 3S2O82- + 7H2O® Cr2O72- +6SO42- +14H+
Условия проведения опыта.
1. Реакцию проводят в достаточно кислой среде при рН= 1-2.
2. Нагревание ускоряет протекание реакции.
3. Ионы-восстановители мешают протеканию реакции.
Опыт. В пробирку возьмите 5-6 капель раствора персульфата аммония (NH4)2S2O8, прибавьте каплю 2 н раствора серной кислоты и каплю раствора нитрата серебра (катализатор), а затем 2-3 капли раствора сульфата хрома Cr2(SO4)3 или нитрата хрома Cr(NO3)3. (Хлорид хрома брать нельзя!) Пробирку нагрейте на водяной бане. После нагревания раствор приобретает оранжевый цвет вследствие образования аниона Cr2O72-.
Если этот раствор охладить и добавить к нему 2-3 капли пероксида водорода и смесь изоамилового спирта с эфиром и быстро взболтать, то верхний слой (смесь эфира и изоамилового спирта) окрашивается в синий цвет вследствии образования пероксида хрома CrO5 или надхромовой кислоты Н2CrO6:
K2Cr2O7 + 4 H2O2 + H2SO4® 2CrO5 + K2SO4+ 5H2O
Cr2O72- + 4H2O2 + 2H+ ® 2H2CrO6 + 3H2O
Реакция образования перекиси хрома СrO5 очень чувствительная и позволяет открывать катион Cr3+ и анионы CrO42-, Cr2O72- в присутствии катионов всех аналитических групп.
Условия проведения опыта.
1. Реакцию можно проводить только в кислой среде при рН =2-3.
2. H2CrO6 неустойчива в водных растворах, поэтому реакция проводится в присутствии смеси изоамилового спирта и эфира, в которой она хорошо растворима.
3. Реакция окисления хрома протекает в присутствии катализатора – ионов Ag+.
Частные реакции катиона Zn2+
Раствор аммиака дает с катионом Zn2+ белый осадок гидроксида цинка Zn(OH)2, растворимый в избытке реагента, с образованием комплексного соединения – аммиаката цинка [Zn(NH3)4](OH)2:
ZnCl2 + 2NH4OH ® Zn(OH)2¯ +2NH4Cl
Zn(OH)2 + 4NH4OH ® [Zn(NH3)4](OH)2 + 4H2O
1. Карбонаты щелочных металлов и аммония образуют белый осадок основной соли:
2ZnCl2 + 2Na2CO3 + H2O ® Zn2(OH)2CO3¯ + 4NaCl + CO2
2Zn2+ + 2CO32- + H2O ® Zn2(OH)2CO3 + CO2
Состав этой соли зависит от температуры и концентрации раствора.
2. Сероводород образует с катионом цинка белый осадок сульфида цинка:
ZnCl2 + H2S «ZnS¯ +2HCl
Zn2+ + H2S «ZnS +2H+
Опыт. Налейте в пробирку 3-4 капли раствора хлорида цинка, добавьте 2-3 капли раствора ацетата натрия CH3COONa и 5-7 капель сероводородной воды. Наблюдайте за образованием осадка. Проверьте рН раствора универсальной индикаторной бумажкой. При какой величине рН осадок сульфида цинка ZnS будет растворяться?
Условия проведения опыта
1. Реакция протекает лучше в уксуснокислой среде.
2. Присутствие окислителей мешает проведению реакции.
3. Гексациано-(II)феррат калия K4[Fe(CN)6] образует с катионом Zn2+ белый осадок двойной соли:
3ZnSO4 + 2K4[Fe(CN)6] ® K2Zn3[Fe(CN)6]2¯ +3K2SO4
3Zn2+ + 2[Fe(CN)6]4-- +2K+ ® K2Zn3[Fe(CN)6]2
Эта реакция позволяет отличить катион Zn2+ от катиона Al3+.
4. Раствор дифенилкарбазона (дитизона) в хлороформе или четыреххлористом углероде дает с катионом цинка внутрикомплексную соль красного цвета. Эта соль окрашивает в щелочной среде не только хлорофомный слой, но и верхний – водный, что позволяет открывать данной реакцией катион в присутствии других катионов.

Опыт. Налейте в пробирку 2-3 капли анализируемого раствора, добавьте 5 капель 2 н раствора гидроксида натрия NaOH. Выпавший осадок (если он образуется) отцентрифугируйте. Каплю центрифугата поместите на предметное стекло или в маленькую фарфоровую чашечку и обработайте 2-3 каплями раствора дитизона в хлороформе, перемешайте до тех пор, пока весь раствор не испарится. При наличии катиона цинка водный раствор приобретает розовую или красную окраску. При отсутствии его можно наблюдать появление желтой окраски, вызванной образованием дитизоната натрия.
Если окрашивание наблюдается только в слое растворителя, то это еще не говорит о присутствии катиона цинка.
5. Микрокристаллоскопическая реакция. На предметное стекло поместите каплю исследуемого раствора, подкисленного уксусной кислотой СН3СООН, прибавьте каплю раствора тетрародано-(II) меркурата аммония (NH4)2[Hg(SCN)4], рассмотрите кристаллы тетрародано-(II) меркурата цика Zn[Hg(SCN)4 ] под микроскопом. Кристаллы из нейтральных или щелочных растворов имеют вид крестов и дендридов, а из подкисленных – вид треугольников или клиньев. Если анализируемые растворы очень разбавлены, то каплю такого раствора выпаривают на предметном стекле, а сухой остаток обрабатывют каплей реактива.
Условия проведения опыта.
1. Испытуемый раствор необходимо подкислить уксусной кислотой.
2. Реакцию следует проводить с растворами умеренной концентрации.
3. Наличие катионов Cu2+, Ni2+, Cd2+ и др. мешает открытию катионов Zn2+.
4. В присутствии катионов Со3+ осадок окрашивается в синий цвет.
Частные реакции катионa Sn2+
Олово дает два ряда соединений, в которые входят катионы Sn2+и Sn4+.
1. Восстановление катионом Sn2+ солей висмута и ртути. Если к щелочному раствору солей, содержащих катион Sn2+ прилить небольшое количество раствора нитрата висмута или хлорида ртути, появляется черный бархатистый осадок металлического висмута или ртути:
SnCl2 + 4KOH ® K2SnO2 + 2KCl + 2H2O
Sn2+ + 4OH- ® SnO22- + 2H2O
2Bi(NO3)3 + 3K2SnO2 + 6KOH ® 2Bi¯ + 3H2O + 6KNO3 + 3K2SnO3
2Bi3+ + 3SnO22- + 6OH- ® 2Bi + 3H2O + 3SnO32-
HgCl2 + K2SnO2 +2KOH ® Hg¯ + K2SnO3+ 2KCl + H2O
Hg2+ + SnO22- +2OH- ® Hg¯ + SnO32- + H2O
Опыт. В пробирку налейте 4 капли раствора, содержащего катион Sn2+, прибавьте 6-7 капель 2 н раствора гидроксида натрия и отцентрифугируйте осадок, если он получится. 2-3 капли центрифугата поместите в пробирку и добавьте 1-2 капли раствора нитрата висмута Bi(NO3)3. При наличии в растворе катиона Sn2+ выпадает черный бархатистый осадок висмута.
Условия проведения опыта.
1. К анализируемому раствору прибавляют гидроксид натрия до образования Na2SnO2.
2. Если в исследуемом растворе присутствуют ионы Sb, то открытие катиона Sn2+ проводят в присутствии анилина.
Опыт. На полоску фильтровальной бумаги нанесите каплю раствора нитрата висмута Bi(NO3)3, высушите, нанесите каплю исследуемого раствора и затем одну каплю анилина.
При наличии в растворе катионов Sn2+ через некоторое время на бумаге появляется темное пятно. Открытие катиона Sn2+ с анилином можно производить в присутствии катионов всех аналитических групп.
Проделайте описанные реакции и напишите их уравнения.
2. Сероводородная вода в кислых растворах дает с катионом Sn2+ осадок темно-коричневого цвета – сульфид олова SnS:
SnCl2 + H2S ® SnS¯ + 2HCl
Sn2++ H2S ® SnS + 2H+
Частные реакции катиона Sn+4
1. Металлический магний и металлическое железо восстанавливают Sn+4 до Sn+2:
Mg + [SnCl6]2-® Mg2+ + Sn2++ 6Cl-
Fe + [SnCl6]2-® Fe2+ + Sn2++ 6Cl-
Ион [SnCl6]2- образуется в ходе реакции:
Sn(OH)4 + 6HCl ® H2[SnCl6] + 4H2O
Опыт. В пробирку налейте 4-5 капель раствора хлорида олова (IV) SnCl4, добавьте 2 капли концентрированной соляной кислоты и бросьте две стружки металлического магния, нагрейте 3-4 минуты на водяной бане. К полученному раствору добавьте 7-8 капель раствора щелочи и отцентрифугируйте осадок. 2-3 капли раствора станнита натрия Na2SnO2 перенесите в пробирку и добавьте 1-2 капли раствора нитрата висмута; при нагревании в анализируемом растворе катиона Sn2+ выпадает черный осадок висмута.
Условия проведения опыта.
1. Магний берется химически чистым.
2. Перед добавлением раствора нитрата висмута смесь обрабатывают раствором гидроксила натрия до образования Na2SnO2.
2. Сероводород дает с Sn4+ желтый осадок SnS2:
H2[SnCl6] + 2H2S ® SnS2¯ + 6HCl
[SnCl6]2- + 2H2S® SnS2 +6Cl- +4H+
Осадок SnS2 растворяется в концентрированной соляной кислоте.
Частные реакции катиона As+3 и As+5
(Соединения мышьяка ядовиты! Осторожно!)
1. Раствор йода окисляет арсенит-анион AsO33- до арсенит-аниона AsO43-, при этом раствор йода обесцвечивается:
AsО33- + I2 + H2O «AsО43- + 2H+ +2I-
Опыт. В пробирку налейте 3-4 капли раствора арсенита натрия Na2AsO3, прибавьте немного порошкообразного гидрокарбоната натрия, перемешайте стеклянной палочкой, затем добавьте 2-3 капли раствора йода. Обратите внимание на обесцвечивание раствора.
Условия проведения опыта.
1. Для смещения равновесия в сторону образования ионов необходимо связать ионы водорода при помощи гидрокарбоната натрия NaHCO3.
2. Раствор йода следует добавлять постепенно по каплям
Иодид калия КI окисляется в кислой среде арсенат-анионами до свободного йода, окрашивающего в присутствии крахмала раствор в темно-синий цвет:
AsO43- + 2I- + 2H+«As33- + I2 + H2O
Опыт. Налейте в пробирку 3-4 капли раствора арсената натрия Na3AsO4, 1-2 капли концентрированной соляной кислоты, добавьте 3-4 капли крахмального клейстера и 4 капли раствора иодида калия и перемешайте. Появляется темно-синее окрашивание.
Условия проведения опыта.
1. Реакцию необходимо проводить в кислой среде при рН=2-3.
2. Для проведения реакции необходимо брать свежеприготовленный раствор KI.
3. Водород в момент выделения восстанавливает As+3 и As+5 в мышьяковистый водород AsH3. Последующие взаимодействия мышьяковистого водорода с нитратом серебра и хлоридом ртути HgCl2 дают темное пятно металлического серебра или ртути.
Опыт. В пробирку поместите 2г химически чистого цинка и прилейте 6-7 мл 5 н раствора соляной кислоты и 10 капель исследуемого раствора. В верхнюю часть поместите тампон из ваты, увлажненный раствором ацетата свинца (для поглощения следов сероводорода). Отверстие пробирки закройте фильтровальной бумагой, пропитанной 0,01 н раствором нитрата серебра. При наличии ионов As(III) и As(V) появляется черное пятно. При этом протекает следующая реакция:
AsH3 + 6Ag + 3H2O ® H2AsO3 +6Ag¯ +6H+
Условия проведения опыта.
1. Реакцию можно проводить в кислой среде с цинком и в щелочной среде с алюминием.
2. Применяемые реактивы должны быть химически чистыми.
3. Открытию мышьяка этой реакцией мешают ионы Sb3+.
4. При необходимости определить ионы мышьяка в присутствии ионов сурьмы следует реакцию вести в щелочном растворе в присутствии алюминия.
Дата добавления: 2016-01-05; просмотров: 27; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
