Определение содержания железа в рудах
Этапы определения:
1)подготовка пробы руды для титрования
2) титрование анализируемого раствора железа (II) раствором K2Cr2O7
3)расчет граммового и процентного содержания железа в руде
В основе определения железа (II) лежит реакция: 6Fe2++Cr2O72-+14H+→6Fe3++2Cr3++7H2O
В процессе титрования повышается концентрация ионов Fe3+ , следовательно, возрастает потенциал системы
Fe3+/ Fe2+, что приводит к преждевременному изменению окраски индикатора. Поэтому в титруемый раствор добавляют H3PO4, которая связывает Fe3+ в бесцветный комплекс и понижает потенциал системы.
Ход анализа:
Подготовка пробы руды для титрования. Точную навеску анализируемого материала (0,7-1г) помещают в жаростойкий стакан ёмкостью 300 мл, прибавляют 40 мл HCl(1:4), закрывают часовым стеклом и растворяют при нагревании на песочной бане или на электроплитке с асбестом. Затем добавляют 2-5 мл азотной кислоты и продолжают нагревание. Растворение считается законченным, когда на дне стакана остается серовато-белый осадок, состоящий в основном из кремниевой кислоты. Выпаривают раствор досуха, остаток обрабатывают 10 мл концентрированной HCl и снова выпаривают раствор. Операцию выпаривания с концентрированной HСl повторяют 2 раза, затем добавляют 4 мл концентрированной HCl и разбавляют горячей водой примерно до 50 мл. Раствор отфильтровывают через фильтр с белой лентой в мерную колбу ёмкостью 200 или 250 мл. Хорошо промывают фильтр горячей 0,05 моль/л HCl, охлаждают, разбавляют водой до метки и перемешивают.
|
|
|
Титрование анализируемого раствора железа (II) раствором K2Cr2O7. Аликвотную часть раствора 10,0 мл пипеткой переносят в коническую колбу, добавляют 5 мл концентрированной HCl. Закрывают колбу маленькой воронкой, вносят в колбу 3-4 гранулы металлического цинка, нагревают на песчаной бане или электроплитке с асбестом до обесцвечивания раствора и растворения цинка. Охлаждают содержимое колбы под струёй воды, добавляют 3-4 мл серной кислоты, снова охлаждают, вводя 5 мл фосфорной кислоты, 15-20 мл воды, 2-4 капли раствора дифениламина и медленно титруют раствором дихромата калия до появления синей окраски раствора.
Расчет граммового и процентного содержания железа в руде. Титрование повторяют несколько раз. Из трех сходящихся результатов (отличных не более чем на 0,1 мл) вычисляют среднее знаение объёма титранта. Расчет граммового содержании железа ведут по формуле:
mFe,г=C( K2Cr2O7)·
K2Cr2O7)·  (K2Cr2O7)·K(K2Cr2O7)·Mэкв(Fe) ·P·10-3
(K2Cr2O7)·K(K2Cr2O7)·Mэкв(Fe) ·P·10-3
Расчет процентного содержании железа в руде ведут по формуле:
ωFe= 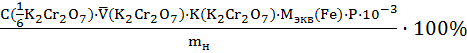
Дата добавления: 2016-01-05; просмотров: 149; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
