МІСЬКА ОЛІМПІАДА З ХІМІЇ. 2002 рік
г) 0 +6 +2 -2
4Zn + 5H2SO4 = 4ZnSO4 + H2S + 4H2O

 Zn0 -2℮ → Zn+2 4 - відновник
Zn0 -2℮ → Zn+2 4 - відновник
8
S+6 + 8℮ → S-2 1 – окисник
6. Щоб виділити мідь спочатку на всю суміш подіяти концентрованою нітратною кислотою: Fe + HNO3(к) ≠ пасивує
Cu + 4HNO3(к) = Cu(NO3)2 + 2NO2 + 2H2O
Ag + 2HNO3(к) = AgNO3 + NO2 + H2O
S + 4HNO3(к) = SO2 + 4NO2 + 2H2O
Залишились в розчині Cu(NO3)2 та AgNO3, прожарити
2AgNO3 = 2Ag + 2NO2 + O2
2Cu(NO3)2 = 2CuO + 4NO2 + O2
Подіяти хлоридною кислотою:
Ag + HCl ≠
CuO + 2HCl = CuCl2 + H2O
Відновити мідь з розчину при допомозі заліза:
CuCl2 + Fe = FeCl2 + Cu
Й клас
1. Дано: Розв'язок:
 m(р-ну фенолу в 1. х 0,08 моль
m(р-ну фенолу в 1. х 0,08 моль
бензені) = 141 г. 2С6Н5ОН +2Na → 2C6H5ONa + Н2
V(С2Н4) = 1,68 л.. 2 моль 1 моль
W(С6Н5ОН) - ? 0,08моль х t,Ni 
2. C2H4 + H2 → C2H6
1моль 1 моль
ν(C2H4) =  =
=  = 0,08 моль
= 0,08 моль
ν(Н2) = х = 0,08 моль
ν(С6Н5ОН) = х =  = 0,16 моль
= 0,16 моль
m(С6Н5ОН) = ν · М = 0,16 моль · 94 г/моль = 15,04 г.
w(С6Н5ОН) =  =
=  = 0,11 або 11%
= 0,11 або 11%
Відповідь: 11%С6Н5ОН
2. Дано: Розв'язок:
 V(газу) = 20 л. 1. х 0,005 моль
V(газу) = 20 л. 1. х 0,005 моль
КОН 2КОН + СО2 = К2СО3 +Н2О
m(К2СО3) = 0,69 г. 1 моль 1 моль
m(КНСО3) = 2 г. х = 0,005 моль (СО2)
φ(СО2) - ? у 0,02моль 
2. КОН + СО2 = КНСО3 у = 0,02 моль (СО2)
1моль 1 моль
ν(К2СО3) = 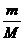 =
=  = 0,005 моль
= 0,005 моль
МІСЬКА ОЛІМПІАДА З ХІМІЇ. 2002 рік
ν(КНСО3) = 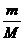 =
=  = 0,02 моль
= 0,02 моль
ν(СО2) = х + у = 0,005 + 0,02 = 0,025 моль
V(СО2) = ν · Vm = 0,025 моль · 22,4 л/моль = 0,56 л.
φ(СО2) =  = 0,28 або 2,8%
= 0,28 або 2,8%
Відповідь: 2,8%СО2
 3. Дано: Розв'язок:
3. Дано: Розв'язок:
m(СuSO4) = 300 г.
w(СuSO4) = 19,1% 1. Записуєм рівняння електролізу даного розчину:
m(КСl) = 300 г. х (27-х)
w(КСl) = 28,3% СuSO4 + 2 КСl → Сu + Сl2 + K2SO4
електроліз 64г 71г
w(SO42-) = 6% 2. Знаходимо масу розчину після електролізу.
m(р-ин, що виділи- 57,3г х 
лись на електродах -? СuSO4 ↔ Сu2+ + SO42-
К-сть електрики - ? 160г 96г
m(СuSO4) = 300г · 0,191 = 57,3 г.
х =  = 34,38г (SO42-)
= 34,38г (SO42-)
m(розчину після електролізу) =  = 573 г.
= 573 г.
3. Тоді виділилось на електродах 600 г – 573 г = 27 г речовин (Cu, Cl2 )
Нехай m (Cu) = х г, тоді m (Cl2) = (27 – х) г
За рівнянням  ( Cl2) :
( Cl2) :  ( Cu) = 1 : 1
( Cu) = 1 : 1
 ( Cu) =
( Cu) =  моль;
моль;  ( Cl2) =
( Cl2) =  моль.
моль.
 ; х = 12,8 г ( Cu), тоді m (Cl2) = 27 – 12,8 = 14,2 г
; х = 12,8 г ( Cu), тоді m (Cl2) = 27 – 12,8 = 14,2 г
4.Знаходимо кількість електрики, що пропущено через розчин.
Згідно законам Фарадея :
Q =  =
=  = 38600 Кл (електрики)
= 38600 Кл (електрики)
Відповідь : 12,8 гCu, 14,2 г Cl2; 38600 Кл електрики.
 4. Дано: Розв'язок:
4. Дано: Розв'язок:
m(суміші) = 25 г. 1. x z1
V(NaOH) = 65,37мл СН3―С=О
W(NaOH) = 20% | + NaOH → CH3―COONa + C2H5OH
ρ(NaOH) = 1,22г/мл О―С2Н5
V(Н2SO4) = 50мл 88г 40г
С(Н2SO4) = 1 моль/л 25 - x z2
W(естерів в розчині)-? Н―С=О 
| + NaOH → H―COONa + C2H5OH
О―С2Н5
74г 40г
Z1 =  =0,4545x Z2=
=0,4545x Z2=  =13,5135 – 0,54x
=13,5135 – 0,54x
МІСЬКА ОЛІМПІАДА З ХІМІЇ. 2002 рік.
2. x 0,05моль
2NaOH + Н2SO4 = Na2SO4 + 2H2O
2 моль 1моль
ν(Н2SO4) = 0,05л · 1 моль/л = 0,05 моль
ν(NaOH)надлишок = х = 0,1 моль
ν(NaOH)що дано за умовою = 65,37мл · 1,22г/мл · 0,2 : 40г/моль = 0,4 моль
ν(NaOH)що пішов на гідроліз = 0,4 моль – 0,1 моль = 0,3 моль
m(NaOH) = 0,3 моль · 40 г/моль = 12г
3. Тоді : Z1 + Z2 = 12г
0,4545х + 13,5135 – 0,54х = 12
х = 17,7г –це маса етилетаноату.
m(етилметаноату) = 25 – 17,7 = 7,3г
w(етилетаноату) =  = 0,708 або 70,8%
= 0,708 або 70,8%
w(етилметаноату) = 29,2%
Відповідь: 29,2% етилметаноату та 70,8% етилетаноату.
 . 5. Дано: Розв'язок:
. 5. Дано: Розв'язок:
V(НCl) = 48,35мл 1.m(р-ну НCl) = V · ρ = 48,35мл · 1,035г/мл = 50,04225г
w(HCl) = 7,3% m(НCl) = 50,04225г · 0,073 = 3,65г
ρ(HCl) = 1,035г/мл m(Н2О) = 50,04 – 3,65 = 46,39г
V(NaOH) = 91,75мл 2. m(р-ну NaOH) = 91,75мл · 1,09г/мл = 100,0075г
w(NaOH) = 11,2% m(NaOH) = 100,0075 · 0,112 = 11,2г
ρ(NaOH) = 1,09г/мл m(Н2О) = 100 – 11,2 = 88,8г
N(Н2О в розчині)-? 3. 11,2г 3,65г х 
NaOH + НCl = NaCl + Н2О
40г 36,5г 18г
ν(NaOH) = 0,28 моль; ν(НCl) = 0,1 моль
NaOH - дано в надлишку, розрахунки за НCl
х = m(Н2О) =  =1,8г
=1,8г
4. m(води в розчині) = 46,4г + 88,8г + 1,8г = 137г
ν(Н2О) =  = 7,6моль
= 7,6моль
N(Н2О) = ν · NА = 7,6моль · 6,02 · 1023 = 45,752 · 1023 молекул води.
Відповідь:45,752 · 1023 молекул води.
МІСЬКА ОЛІМПІАДА З ХІМІЇ. 2003 рік
ХІМІЯ
ТЕКСТИ ЗАДАЧ МІСЬКОЇ ОЛІМПІАДИ З ХІМІЇ
Й клас
1.Маса восьми літрів деякого газу ( н. у. ) становить 5,72 г. Визначте молярну масу цього газу. Обчисліть масу однієї молекули цього газу. ( 3 бала )
2. Відношення мас Карбону і Гідрогену в метані 3:1. Обчисліть масові частки елементів у метані. ( 3,5 бала )
3. Елемент Х та У утворюють сполуку ХУО3, в якій масова частка Оксигену складає 47,5 %, причому відносна атомна маса елемента Х на 25 більша, ніж елемента У. Складіть формулу речовини. ( 4,5 бала )
4. У скляному циліндрі, зануреному вінцями у воду, спалили 1 г фосфору. Фосфор, який залишився після спалювання, мав масу 0,783 г. Який об'єм повітря ( н.у.) був у циліндрі ?
( 4 бала )
5. Речовина складу Na2СO3·хH2O містить 16,08 % Na. Чому дорівнює х ? Наведіть розв'язок.
( 5,5 балів )
6. При розчиненні в хлоридній кислоті 1,82 г суміші алюмінію з невідомим металом, який стоїть в електрохімічному ряді напруг металів після водню, виділилось 0,672 л водню. Щоб окислити цю суміш, було використано 0,56 л кисню. Який метал було взято? Визначте масову частку метала в суміші. ( 6 балів )
Й клас
1. При гасінні негашеного вапна СаО водою маса продукту збільшується. Чи все негашене вапно вступило в реакцію, якщо маса його збільшилась на 30% ? ( 3 бала )
2.Речовина складається з атомів елементів А і В, які знаходяться в одному періоді , і має формулу АВ2. Леткі водневі сполуки А і В містять відповідно 25% і 11,11% Гідрогену. Визначіть речовину АВ2. ( 4,5 бали )
3.Закінчіть схему перетворень речовин, здійсніть перетворення:


 ВаО → ? → ?
ВаО → ? → ?
Х Х Х



SO3 → ? → ? де х – одна і та ж речовина. ( 5,5 бала )
4. а)При пропусканні сульфур ( ІV ) оксиду через розчин сірководню спостерігається помутніння через те, що випадає в осад сірка. Складіть рівняння реакцій та розставте коефіцієнти методом електронного балансу.
б) Допишіть рівняння реакції; підберіть коефіцієнти методом електронного балансу:
НNO2 → НNO3 + ….? + ….? ( 5,5 балів )
5. До якого об’єму потрібно розбавити 500мл 20% розчину NaCl (  ), щоб одержати розчин з масовою часткою 4,5% (
), щоб одержати розчин з масовою часткою 4,5% (  )? ( 6 балів )
)? ( 6 балів )
6.Над 10 г розжарених залізних ошурок пропустили водяну пару. Ошурки прореагували повністю. Об’єм одного із продуктів реакції – водню – при н.у. склав 5,3 л. Визначте формулу другого продукту реакції.
( 6 балів )
Дата добавления: 2018-02-18; просмотров: 1221; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
