МІСЬКА ОЛІМПІАДА З ХІМІЇ. 2003 рік.
3.  Дано : Розв'язок:
Дано : Розв'язок:
m ( Ni пластинки) = 18,9 г х 45,5 - х
m ( FeCl3 розчину) = 455 г 3Ni + 2FeCl3 = 3 NiCl2 + 2Fe
W1 ( FeCl3 ) = 0,1 3 моль 2 моль 3 моль 2 моль
 W2 (FeCl3) = W( NiCl2) 177 г 325 г 390 г 112 г
W2 (FeCl3) = W( NiCl2) 177 г 325 г 390 г 112 г
m (пластинки після реакції ) - ? 1. Знаходимо масу FeCl3 в розчині.
m(FeCl3) = m (розчину) · W(FeCl3)
m(FeCl3) = 455 г · 0,1 = 45,5 г
2. m1 (FeCl3), що прореагував позначимо через х, тоді
m2 (FeCl3), що залишилася в розчині буде ( 45,5 - х ).
За умовою після реакції W2 (FeCl3) = W( NiCl2), тоді
m2 (FeCl3) = m2 (NiCl2) = 45,5 - х
3. Знаходимо m1 (FeCl3), що прореагував за рівнянням
реакції.
Х· 390 г = 325 · ( 45,5 – х )
Х = 20,68 г (FeCl3), що прореагував
4. Знаходимо зміну маси пластинки.
|
|
|
Δm (за рівнянням ) = 177 г – 112 г = 65 г
325 г(FeCl3) -------- Δm ( за рівнянням) 65 г
20,68 г (FeCl3) ----- Δm ( за умовою ) Х
Х = 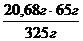 = 4,136 г
= 4,136 г
5. Знаходимо m пластинки після реакції.
m (пластинки після реакції) = 18,9 г – 4,136 г = 14,764 г
Відповідь : m пластинки після реакції дорівнює 14,764 г.
 4. Дано : Розв’язок :
4. Дано : Розв’язок : 
m (CuSO4) = 300г CuSO4 + 2 KCl ≠
W (CuSO4) = 19,1 %
m ( KCl ) = 300г 1. Схема електролізу даного розчину:
W ( KCl ) = 28,3 % CuSO4  Cu2+ + SO42- ; KCl
Cu2+ + SO42- ; KCl  K+ + Cl-
K+ + Cl-
 Електроліз Н2О
Електроліз Н2О

 W ( SO4 ) = 6% К- : Cu2+, K+ А+ : SO42-, Cl-
W ( SO4 ) = 6% К- : Cu2+, K+ А+ : SO42-, Cl-
m(речовин, що виділились Cu2+ + 2ê = Cu0 2Cl- - 2ê = Cl20
 на електродах) - ?
на електродах) - ?
х 17-х
|
|
|
CuSO4 + 2 KCl  → Cu + Cl2 + K2SO4
→ Cu + Cl2 + K2SO4
1 моль 1 моль
64 г 71 г
2. Знаходимо масу розчину після електролізу.
А) знаходимо масу CuSO4 в розчині.
m(CuSO4) = 300 г · 0,191 = 57,3 г
б) знаходимо масу сульфат-іонів в розчині.
57,3 х
CuSO4  Cu2+ + SO42- х = 57,3 г · 96 г : 160 г = 34,38 г.( SO42- )
Cu2+ + SO42- х = 57,3 г · 96 г : 160 г = 34,38 г.( SO42- )
1 моль 1 моль
|
|
|
160 г 96 г
в) Знаходимо масу розчину після електролізу
m ( розчину) =  ; m ( розчину) =
; m ( розчину) =  = 573 г
= 573 г
МІСЬКА ОЛІМПІАДА З ХІМІЇ. 2003 рік
4. Тоді виділилось на електродах 600 г – 573 г = 27 г речовин (Cu, Cl2 )
Нехай m (Cu) = х г, тоді m (Cl2) = (27 – х) г
За рівнянням  ( Cl2) :
( Cl2) :  ( Cu) = 1 : 1
( Cu) = 1 : 1
 ( Cu) =
( Cu) =  моль;
моль;  ( Cl2) =
( Cl2) =  моль.
моль.
 ; х = 12,8 г ( Cu), тоді m (Cl2) = 27 – 12,8 = 14,2 г
; х = 12,8 г ( Cu), тоді m (Cl2) = 27 – 12,8 = 14,2 г
4.Знаходимо кількість електрики, що пропущено через розчин.
Згідно законам Фарадея :
Мекв(речовини) · Q
|
|
|
 m = ; Мекв(Сu)= 32 г/моль
m = ; Мекв(Сu)= 32 г/моль
F
Q =  =
=  = 38600 Кл (електрики)
= 38600 Кл (електрики)
Відповідь : 12,8 гCu, 14,2 г Cl2; 38600 Кл електрики.
- Речовини розташовані в порядку зростання кислотності:
СН3 ─ СН ─ СН3; Н2S ; C6H5OH ; HI.
|
ОН
 6. Дано: Розв'язок:
6. Дано: Розв'язок:
V(НCl) = 48,35мл 1.m(р-ну НCl) = V · ρ = 48,35мл · 1,035г/мл = 50,04225г
w(HCl) = 7,3% m(НCl) = 50,04225г · 0,073 = 3,65г
ρ(HCl) = 1,035г/мл m(Н2О) = 50,04 – 3,65 = 46,39г
V(NaOH) = 91,75мл 2. m(р-ну NaOH) = 91,75мл · 1,09г/мл = 100,0075г
w(NaOH) = 11,2% m(NaOH) = 100,0075 · 0,112 = 11,2г
ρ(NaOH) = 1,09г/мл m(Н2О) = 100 – 11,2 = 88,8г
N(Н2О в розчині)-? 3. 11,2г 3,65г х 
NaOH + НCl = NaCl + Н2О
40г 36,5г 18г
ν(NaOH) = 0,28 моль; ν(НCl) = 0,1 моль
NaOH - дано в надлишку, розрахунки за НCl
х = m(Н2О) =  =1,8г
=1,8г
4. m(води в розчині) = 46,4г + 88,8г + 1,8г = 137г
ν(Н2О) =  = 7,6моль
= 7,6моль
N(Н2О) = ν · NА = 7,6моль · 6,02 · 1023 = 45,752 · 1023 молекул води.
Відповідь:45,752 · 1023 молекул води.
МІСЬКА ОЛІМПІАДА З ХІМІЇ. 2004 рік
ХІМІЯ
ТЕКСТИ ЗАДАЧ МІСЬКОЇ ОЛІМПІАДИ З ХІМІЇ
Й клас
1. Маса молекули води 2,99 10-26 кг. Яка маса води кількістю речовини 1моль? (3 бали).
2.Три пробірки наповнені киснем, воднем, вуглекислим газом. Треба визначити, який газ міститься в кожній з них. В якій послідовності і чому саме так слід проводити дослідження? Опишіть дослідження. (3 бали).
3.Визначте формулу сполуки Феруму з Сульфуром, якщо під час реакції деякої її маси з киснем утворюється 20 г ферум (IIІ) оксиду(Fe2O3) і 16 г сірчистого газу (SO2). (4,5 бала).
4.Порошок магнію в результаті нагрівання на повітрі частково окиснився, при цьому його маса збільшилась на 10%. Обчисліть молярне співвідношення кількості металу, який не прореагував, і утвореного оксиду. (6 балів).
5.Одна із сполук Арсену (миш'яку) з Сульфуром (мінерал реальгар) мас відносну молекулярну масу 428 і містить однакові кількості атомів кожного з елементів. Знайдіть формулу сполуки. Чи є ця формула найпростішою? (5 балів).
6.а) Запишіть замість літер X і Z відповідні хімічні формули:
t0C t0C
1) 2H2 + X = 2H2O 2) H2S + I2 = S + 2Z
t0C t0C
3) 2F2 + 2H2O = O2 + 4Z 4) 4NH3 + 3O2 = 2X + 6H2O
б) виходячи з рівняння хімічної реакції 4, обчисліть молярну масу речовини X знайдіть число молекул і атомів у речовині X (ви визначили її формулу раніше) кількістю 2 моль.
Балів).
Й клас
1. Під час зневоднення кристалогідрату натрій сульфіту його маса зменшилась у 2 рази. Знайти формулу кристалогідрату. (3,5 бали).
2. Порошок магнію в результаті нагрівання на повітрі частково окиснився, при цьому його маса збільшилась на 10%. Обчисліть молярне співвідношення кількості металу, який не прореагував, і утвореного оксиду. (6 балів).
3. Посудину, з якої заздалегідь викачали повітря і зважили, наповнили газом А і повторно зважили. Наважка газу становила 0,02г. Газ А відкачали і посудину заповнили карбон (IV) оксидом. Наважка газу становила 0,440г. Визначити відносну молекулярну масу газу А, об'єм посудини та масу повітря, що заповнює посудину. (5 балів).
4. При обробці хлоридною кислотою 11,9г суміші двох металів, які проявляють в сполуках валентність II і III, виділився газ об'ємом 8,96л (н.у.). Визначте, які метали взято, якщо відносна атомна маса першого металу приблизно в 2,41 рази більша відносної атомної маси другого, а їх атомне співвідношення в суміші складає 1:2. (7 балів)
5. Закінчити рівняння реакцій, скласти електронний баланс:
а) H2S + SO2 → S + Н2О
б) HNO3 →NO2 + О2 + Н2О
в) РН3 +О2 → P2O5 + Н2О
Бали)
6. Маса 2,35∙1023 молекул газу Х2 становить 12,5г. Виведіть формулу газу. Вкажіть тип хімічного зв'язку між атомами у молекулі цього газу. Запишіть ізотопи хімічного елемента, який входить до складу молекули цього газу. (5 балів).
Дата добавления: 2018-02-18; просмотров: 1093; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
