ТЕКСТИ ЗАДАЧ МІСЬКОЇ ОЛІМПІАДИ З ХІМІЇ
Й клас
1. При каталітичному окисненні амоніаку надлишком кисню в кінцевому результаті одержується нітратна кислота і вода. Обчисліть масову частку кислоти, розчиненій у воді, що утворилася в результаті реакцій.
2. Дано розчин ортофосфатної кислоти об’ємом 300мл ( густиною 1,05 г/мл), який добули розчинивши 31г фосфору в воді. Після чого через утворений розчин пропустили 33,6л амоніаку. Знайти масові частки солей в добутому розчині після пропускання амоніаку.
3. Газ, який добули дією надлишку розчину хлоридної кислоти на кальцій карбонат масою 40 г., поглинули розчином натрій гідроксиду. В результаті реакції утворився натрій карбонат. Обчисліть об'єм розчину з масовою часткою натрій гідроксиду 20% і густиною 1,22 г/мл, який витратили на поглинання газу, що утворився.
4. При нагріванні 4,8 г. оксиду деякого металу в водні утворилось 1,62 г. води. При нагріванні цього металу в хлорі утворюється трихлорид. Який оксид був відновлений?
5. Методом електронного балансу підібрати коефіцієнти в схемах окисно-відновних реакцій:
а). Fe(OH)2 + H2O + O2 →
б). Ag + H2SO4(к) →
в). FeCl2 + HNO3 + HCl → NO + …. + ….
г). Zn + H2SO4(к) → H2S + …. + ….
6. Дано зразок міді, який містить домішки заліза, срібла та сірки. Виділити з нього чисту мідь за допомогою хімічних перетворень. Записати відповідні рівняння реакцій.
Й клас
1. Визначте масову частку фенолу у бензеновому розчині масою 141 г., якщо водень , що виділився при дії на нього надлишку металічного натрію, повністю прореагував з 1,68 л. етилену (н.у.).
2. При пропусканні 20 л. газу через розчин, який містить калій гідроксид, утворилося 0,69 г. карбонату та 2,00 г. гідрокарбонату калію. Визначити процентний вміст діоксиду Карбону в газі.
3. До 300 г 19,1 % розчину купрум ( ІІ ) сульфату додали 300 г 28,3 % розчину калій хлориду і отриманий розчин піддали електролізу з інертними електродами. Після електролізу масова доля сульфат - іонів дорівнювала 6 % Розрахуйте маси продуктів, які виділилися на електродах, та кількість електрики, що пропущено через розчин.
4. Для гідролізу 25 г. суміші етилових ефірів мурашиної та оцтової кислот до них було додано 65,37 мл. 20% розчину натрій гідроксиду (густина 1,22 г/мл). Надлишок лугу після закінчення гідролізу був нейтралізований 50 мл. 1М розчину сульфатної кислоти. Визначте масові долі ефірів у вихідній суміші.
5. До 48,35 мл 7,3% хлоридної кислоти (ρ= 1,035 г/мл) додали 91,75 мл 11,2% розчину натрій гідроксиду (ρ= 1,09 г/мл). Скільки молекул води міститься у одержаному розчині?
МІСЬКА ОЛІМПІАДА З ХІМІЇ. 2002 рік.
РОЗВ'ЯЗКИ ЗАДАЧ МІСЬКОЇ ОЛІМПІАДИ З ХІМІЇ
Й клас
-
 а)Дано: Розв'язок:
а)Дано: Розв'язок:
V(Н2О) = 36 мл 1. m = ρ · V; ρ(Н2О) = 1 г/мл
m (Н2О) = 1 г/мл · 36 мл = 36 г.
 ν(Н2О) - ? 2. ν =
ν(Н2О) - ? 2. ν = 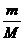 ; М(Н2О)=18 г/моль
; М(Н2О)=18 г/моль
N(Н2О)- ? ν(Н2О)= 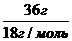 = 2 моль
= 2 моль
3. N = ν · NА; NА = 6,02 · 1023 частинок.
N(Н2О)= 2 моль · 6,02 · 1023 = 12,04 · 1023 молекул.
Відповідь: 2 моль; 12,04 · 1023 молекул.
б)  Дано: Розв'язок:
Дано: Розв'язок:
m(1 молекули) = М(речовини) – це маса 1 моль речовини.
5,33 · 10-23г 1 моль будь-якої речовини містить 6,02 · 1023 частинок.
 М(простої речовини) - ? Тоді: 1 молекула - 5,33 · 10-23г
М(простої речовини) - ? Тоді: 1 молекула - 5,33 · 10-23г
Формулу - ? 6,02 · 1023 - х
х = 5,33 · 10-23г · 6,02 · 1023 : 1 = 32
М = 32 г/моль – це О2 – кисень.
Відповідь: кисень – О2
- Є суміш № 1: S, Cu, ZnCl2 та cуміш № 2: S, Cu, AgNO3. Яку із них можна розділити фізичними методами, а яку – ні і чому?
Розв'язок:
Суміш №1 розділяють фізичним методом: її занурюють у воду. Мідь осідає на дно, сірка збирається на поверхні (флотація), цинк хлорид дуже добре розчиняється у воді. В суміші №2 мідь взаємодіє з розчином арґентум нітрату, тому розділити фізичними методами неможливо.
-
 Дано: Розв'язок:
Дано: Розв'язок:
m(р-ни) = 0,68 г. 1. SО2 → S
m(Н2О) = 0,36 г. 64 г. 32 г. х = 32 г. · 1,28 г. : 64 г. = 0,64 г. (S)
m(SО2) = 1,28 г. 1,28 г. х
 Формула - ? 2. Н2О → 2Н
Формула - ? 2. Н2О → 2Н
18 г. 2 г. х = 0,36 г. · 2 г. : 18 г. = 0,04
0,36 г. х
3. m(О) = 0,68 – 0,64 – 0,04 = 0
Т.ч., до складу речовини входить Гідроген та Сульфур.
4. Складаємо атомний фактор:
Н : S = 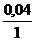 :
: 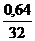 = 0,04 : 0,02 = 2 : 1 Формула - Н2 S
= 0,04 : 0,02 = 2 : 1 Формула - Н2 S
Відповідь: Н2 S
-

 Дано: Розв'язок:
Дано: Розв'язок:
Mg на повітрі Нехай маса Mg, до реакції 100 г, тоді 10% - це 10 г Оксигену, тому щ
окиснився що маса суміші збільшилась за рахунок окиснення.
m(Mg) > на 10% Отже маса суміші (MgO та Mg) після реакції – 110 г.
10г. х
 ν(Mg) до ν(MgO) За рівнянням: 2Mg + О2 = 2 MgO х = 10 · 80 : 32 = 25г (MgO)
ν(Mg) до ν(MgO) За рівнянням: 2Mg + О2 = 2 MgO х = 10 · 80 : 32 = 25г (MgO)
1 моль 2 моль
32г. 80г.
Тоді в 110 г суміші буде 25г. MgO і 110 – 25 = 85 г Mg
ν(Mg) = 85 : 24 = 3,4 моль; ν(MgO) = 25 : 40 = 0,625 моль
ν(Mg) : ν(MgO) = 3,4 : 0,625 = 17 : 5
Відповідь: 17 моль Mg до 5 моль MgO.
МІСЬКА ОЛІМПІАДА З ХІМІЇ. 2002 рік
 5. Дано: Розв'язок:
5. Дано: Розв'язок:
Мінерал : К2О; Нехай є 100 г. мінералу, тоді m(Аl2O3)= 18,5 г.; m(К2О) = 16,6%;
Аl2O3; SiO2 m(SiO2) = 64,9 г.
w(К2О) = 16,6% Складаємо атомний фактор:
w(Аl2O3) = 18,5% ν К2О : ν Аl2O3 : ν SiO2 =  :
:  :
:  = 0,18 : 0,18 : 1,08 =1 : 1 : 6
= 0,18 : 0,18 : 1,08 =1 : 1 : 6
 Формула мінералу- ? Формула : К2О · Аl2O3 · 6SiO2 .
Формула мінералу- ? Формула : К2О · Аl2O3 · 6SiO2 .
Відповідь: К2О · Аl2O3 · 6SiO2 .
6.  Дано: Розв'язок:
Дано: Розв'язок:
Е3О4 w(О) = 100% - 72,4% = 27,6%
w(Е) = 72,4% w =  ; → Мr =
; → Мr =  ;
;
 Е - ? Мr =
Е - ? Мr = 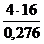 = 232
= 232
М(Е3О4) = 3 · Ar(E) + 4 ·Ar(O)
232 = 3 · х + 4 · 16
х = 56
Ar(Fe)= 56
Відповідь: елемент – Ферум.
Й клас
-


 Дано: Розв'язок:
Дано: Розв'язок:
Mg на повітрі Нехай маса Mg, до реакції 100 г, тоді 10% - це 10 г Оксигену, тому щ
окиснився що маса суміші збільшилась за рахунок окиснення.
m(Mg) > на 10% Отже маса суміші (MgO та Mg) після реакції – 110 г.
10г. х
 ν(Mg) до ν(MgO) За рівнянням: 2Mg + О2 = 2 MgO х = 10 · 80 : 32 = 25г (MgO)
ν(Mg) до ν(MgO) За рівнянням: 2Mg + О2 = 2 MgO х = 10 · 80 : 32 = 25г (MgO)
1 моль 2 моль
32г. 80г.
Тоді в 110 г суміші буде 25г. MgO і 110 – 25 = 85 г Mg
ν(Mg) = 85 : 24 = 3,4 моль; ν(MgO) = 25 : 40 = 0,625 моль
ν(Mg) : ν(MgO) = 3,4 : 0,625 = 17 : 5
Відповідь: 17 моль Mg до 5 моль MgO.
-
 Дано: Розв'язок:
Дано: Розв'язок:
m(Me)= 4,14г. 1. Знаходимо, що це за метал.
4,14 г. 4,8г. 8,94 г.
m(Me2Ox)= 8,94 Ме + О2 = Ме2Ох
m(Me)=15,3г. з H2O х 8 г \екв.
ν(Н2) - ? Згідно з законом збереження маси речовин m(О2) = 8,94 г. – 4,14 г 
m(О2) = 4,8 г.
Відповідно до закону еквівалентів
m (Ме) : Екв.(Ме) = m(О2) : Екв.(О2)
Екв.(Ме) = m(О2) · Екв.(О2) : m (Ме) = 4,14 · 8 : 4,8 = 6,9 г\екв.
За формулою: Екв = Аr : n
Аr(Me) = Eкв.(Ме) · n
Якщо метал одновалентний, то Аr(Me) = 6,9 · 1 = 6,9; Аr(Li)=6,9
Якщо метал двовалентний, то Аr(Me) = 6,9 · 2 = 13,8; не існує
Якщо метал тривалентний, то Аr(Me) = 6,9 · 3 = 20,7; не існує.
Таким чином цей метал Літій.
Дата добавления: 2018-02-18; просмотров: 1345; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
