МІСЬКА ОЛІМПІАДА З ХІМІЇ. 2003 рік.
m2(р-ну) = 115,2г : 0,045 = 2560г
4. Знаходимо об’єм розчину.
V = m : 
V( р-ну) = 2560г : 1,027г/мл = 2492,7 мл або 2,5 л.
Відповідь : 2,5 л. розчину NaCl.
 6. Дано: 1. Знаходимо ν залізних ошурок.
6. Дано: 1. Знаходимо ν залізних ошурок.
m (Fe) = 10 г
Н2О ν = m ׃ M; ν(Fe)= 10г׃56г/моль = 0,18 моль
V (H2) = 5,3 л
 Формулу - ? 2. Знаходимо ν водню.
Формулу - ? 2. Знаходимо ν водню.
ν = V ׃ Vm; ν(Н2) = 5,3л ׃ 22,4л/моль = 0,24моль
3. Знаходимо співвідношення кількості речовин заліза і водню.
ν(Fe) ׃ ν(H2) = 0,18моль ׃ 0,24моль = 3моль ׃ 4моль
4. Записуємо можливі рівняння реакції і порівнюємо кількості речовин
заліза і водню:
Fe + H2O (пари) = FeO + H2 ν(Fe) ׃ ν(H2) = 1моль ׃ 1моль
2Fe + 3H2O(пари) = Fe2O3 + 3H2 ν(Fe) ׃ ν(H2) = 2моль ׃ 3моль
|
|
|
3Fe + 4H2O(пари) = Fe3O4 + 4H2 ν(Fe) ׃ ν(H2) = 3моль ׃ 4моль
З порівняння кількості речовин заліза і водню видно, що другим продуктом
реакції є Fe3O4
Відповідь: Fe3O4
Й клас
 1. Дано Розв’язок
1. Дано Розв’язок
m (KBr) = 1,6 г
m (Br2 і Cl2) = 6г 2КBr + Cl2 → 2KCl + Br2
m (залишку) = 1,36 г 2 моль 1моль 2 моль
 238 г 71 г 149 г
238 г 71 г 149 г
W(Cl2) - ? Δ m за рівнянням = 238 – 149 = 89 г
Δ m за умовою = 1,6 – 1,36 = 0,24 г
1. Знаходимо m (Cl2) за рівнянням реакції.
71 г Cl2 → Δ m =89 г
х г Cl2 →Δ m 0,24 г
х =  =0,19 г (Сl2 )
=0,19 г (Сl2 )
2. Знаходимо W (Cl2) ?
|
|
|
W = 
W (Cl2) = 

Відповідь: 3,2 % ( Cl2 )
 2. Дано: Розв’язок:
2. Дано: Розв’язок:
HCl 1.Знаходимо масу силіцію.
Mg2Si 30 г х
M (SiO2) = 30 г SiO2 + 2C → Si + 2CO
 60 г 28г
60 г 28г
V (газу) - ?
МІСЬКА ОЛІМПІАДА З ХІМІЇ. 2003 рік
х = 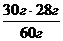 =14 г (Si)
=14 г (Si)
2. Знаходимо масу магній силіциду.
14г х
2Mg + Si → Mg2Si
28 г 76 г
х =  = 38г (Мg2Si )
= 38г (Мg2Si )
|
|
|
3.Знаходимо об’єм газу, що виділиться.
38 г х
Mg2Si + 4 HCl = 2MgCl2 + SiH4
76 г 22,4 л
х =  =11,2 л (SiH4)
=11,2 л (SiH4)
Відповідь: 11,2 літра SiH4
3. . Дано: 1. Знаходимо ν залізних ошурок.
m (Fe) = 10 г
Н2О ν = m ׃ M; ν(Fe)= 10г׃56г/моль = 0,18 моль
V (H2) = 5,3 л
 Формулу - ? 2. Знаходимо ν водню.
Формулу - ? 2. Знаходимо ν водню.
ν = V ׃ Vm; ν(Н2) = 5,3л ׃ 22,4л/моль = 0,24моль
3. Знаходимо співвідношення кількості речовин заліза і водню.
ν(Fe) ׃ ν(H2) = 0,18моль ׃ 0,24моль = 3моль ׃ 4моль
|
|
|
4. Записуємо можливі рівняння реакції і порівнюємо кількості речовин
заліза і водню:
Fe + H2O (пари) = FeO + H2 ν(Fe) ׃ ν(H2) = 1моль ׃ 1моль
2Fe + 3H2O(пари) = Fe2O3 + 3H2 ν(Fe) ׃ ν(H2) = 2моль ׃ 3моль
3Fe + 4H2O(пари) = Fe3O4 + 4H2 ν(Fe) ׃ ν(H2) = 3моль ׃ 4моль
З порівняння кількості речовин заліза і водню видно, що другим продуктом
реакції є Fe3O4
Відповідь: Fe3O4
4.
+3 +5 +2 -2 0 -1 0
а) 3HNO2 → HNO3 + 2NO + H2O б) H2S + I2 = 2 HI + S



 - 2 ĕ -2ĕ
- 2 ĕ -2ĕ
N+3 → N+5 1 - відновник S-2 → S0 1 - відновник
+1ĕ 2 +2ĕ 2
N+3 → N+2 2 - окисник I20 → 2I- 1 - окисник
0 +4 +2 +3
в) Zn + 2SO2 = ZnS2O4

 -2ĕ
-2ĕ
Zn0 → Zn+2 1 - відновник
+1ĕ 2
S+4 → S+3 2 – окисник
МІСЬКА ОЛІМПІАДА З ХІМІЇ. 2003 рік
 5. Дано 1. Знаходимо масу добутого розчину.
5. Дано 1. Знаходимо масу добутого розчину.
m (P2O5) = 14,2 г m2 (розчину) = m1(розчину) + m (P2O5) ;
m1 (розчину H3PO4) = 135,8 г m2 (розчину) =14,2 г + 135,8 г = 150 г
W1 (H3PO4) = 49 % 2. Знаходимо масу кислоти , яка утвориться при
 розчиненні P2O5 в розчині кислоти.
розчиненні P2O5 в розчині кислоти.
W2 (H3PO4) - ? 14,2г х
P2O5 + 3H2O = 2 H3PO4
142г 196г
х =  = 19,6 г(H3PO4)
= 19,6 г(H3PO4)
3. Знаходимо масу кислоти в виданому розчині.
135,8г розчину ----- 100%
х г H3PO4 ----- 49%
m1 (H3PO4) =  = 66,542 г
= 66,542 г
4. Знаходимо масу кислоти в утвореному розчині.
m2 (H3PO4) = 66,542 + 19,6 = 86,142 г
5. Знаходимо масову частку кислоти в утвореному
розчині.
W2 (H3PO4) = 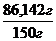 . 100 % = 57, 428 %
. 100 % = 57, 428 %
Відповідь: 57,428 %
 6. Дано: Розчинення одновалентного металу може відбуватися
6. Дано: Розчинення одновалентного металу може відбуватися
І за декількома рівняннями в залежності від активності
m( Ме ) = 5,4 г металу та концентрації кислоти.
V( р-ну Н2SO4) = 3,55мл 1. 
 ( Н2SO4) = 1,73 г/мл 5,4г 4,9г
( Н2SO4) = 1,73 г/мл 5,4г 4,9г
 W (Н2SO4) = 80% 2Ме + Н2SO4 → Ме2 SO4 + Н2
W (Н2SO4) = 80% 2Ме + Н2SO4 → Ме2 SO4 + Н2 
Ме - ? 2∙Аr(Ме) 98г
m(р-ну Н2SO4)= V∙  = 3,55мл ∙ 1,73 г/мл = 6,1415г
= 3,55мл ∙ 1,73 г/мл = 6,1415г
m( Н2SO4 чистого)= m(р-ну)∙W = 6,1415г ∙ 0,8 = 4,9г
Аr(Ме) =  = 54 – такого одновалентного металу не існує.
= 54 – такого одновалентного металу не існує.
2. 5,4г 4,9г
2Ме + 2Н2SO4 → Ме2 SO4 + 2Н2О + SO2
2∙ Аr(Ме) 196г
Аr(Ме) =  = 108 – Аr ( Аg ) = 108, тоді цей метал - срібло.
= 108 – Аr ( Аg ) = 108, тоді цей метал - срібло.
Відповідь: срібло - Аg.
Й клас
1. Розв’язок :
А – легко-кипляча рідина із приємним запахом – це естер.
С – це речовина, що використовують для зберігання біопрепаратів – формальдегід.
 , він може утворюватись при окисненні спирту СuO.
, він може утворюватись при окисненні спирту СuO.
МІСЬКА ОЛІМПІАДА З ХІМІЇ. 2003 рік
O
t ║
СН3ОН + СuО → Н―С―Н + Сu + H2O
В - СН3ОН, М (СН3ОН ) = 32 г/моль, метанол, трохи важчий за повітря.
 Тоді речовина А - метилметаноат.
Тоді речовина А - метилметаноат.


 2. Дано : Розв’язок :
2. Дано : Розв’язок :
С6Н5СOOH 1.Знаходимо С ( Н+) в розчині С6Н5СООН
C6H4NO2COOH 0,0025 моль х
 С = 0,1 моль/л С6Н5СOOH
С = 0,1 моль/л С6Н5СOOH  С6Н5СOO- + Н+
С6Н5СOO- + Н+
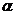 (C6H5COOH)=2,5% 1 моль 1 моль-іон
(C6H5COOH)=2,5% 1 моль 1 моль-іон
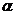 (C6H4NO2COOH)=22,9%
(C6H4NO2COOH)=22,9%  ; n =
; n = 
 C( H+ ) - ? n (продисоційованих)=
C( H+ ) - ? n (продисоційованих)= 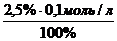 = 0,0025 моль/л
= 0,0025 моль/л
Відношення констант дисоціації -? С ( Н+) = С (С6Н5СOOH) = 0,0025моль/л
2.Знаходимо константу дисоціації С6Н5СOOH.
[ Н+] · [С6Н5СOO-]
 К = ;
К = ;
[С6Н5СOOH ]
С (С6Н5СOOH)= 0,1 моль/л – 0,0025моль/л = 0,0975моль/л(концентрація
непродисоційованих молекул С6Н5СOOH)
К1=  0,000064моль/л (С6Н5СOOH)
0,000064моль/л (С6Н5СOOH)
3. Знаходимо С ( Н+) в розчині С6Н4NO2COOH.

n(продисоційованих)=  = 0,0229 моль/л
= 0,0229 моль/л
С ( Н+) = С (С6Н4NO2COOH) = 0,0229 моль/л
4. Знаходимо константу дисоціації С6Н4NO2COOH.
С (непродисоційованих С6Н4NO2COOН) = 0,1моль/л – 0,0229моль/л = 0,0771моль/л
К2 =  = 0,0068 моль/л (С6Н4NO2COOH)
= 0,0068 моль/л (С6Н4NO2COOH)
5. Знаходимо відношення констант дисоціації.
К1 : К2 =  = 0,0094.
= 0,0094.
Відповідь : 0,000064моль/л; 0,0068моль/л; 0,0094.
Дата добавления: 2018-02-18; просмотров: 958; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
