Электролиз водного раствора хлорида натрия
Электролиз водного раствора хлорида натрияв промышленности используют для получения хлора, водорода и гидроксида натрия.
В настоящее время в промышленности используют два способа электролиза - диафрагменный и ртутный. Основной процесс в том и другом способах - электролиз насыщенного раствора поваренной соли. В обоих методах анодные процессы подобны; их основной продукт - газообразный хлор. Катодные же процессы различны.
При диафрагменном способе применяют стальной катод, к которому подают раствор хлорида натрия. Часть хлорида натрия превращается в гидроксид натрия, и выделяется водород. Хлорид натрия отделяют от гидроксида натрия при упаривании раствора. При этом из-за снижения растворимости он выпадает в осадок. Товарный продукт - раствор гидроксида натрия концентрацией 42-50 %(мас.) содержит 2-4 %(мас.) хлорида натрия.
В ртутном электролизе катод из ртути. Ионы натрия, разряжаясь на нем, образуют натриевую амальгаму. В отдельном аппарате – разлагателе - амальгама натрия разлагается водой, образуя водород и раствор гидроксида натрия. В разлагателе сразу может быть получен раствор гидроксида натрия с товарной концентрацией 42-50 %(мас), не содержащий примесей хлорида натрия.
Раствор поваренной соли (рассол) перед электролизом подвергается очистке. Рассол очищают от солей кальция и магния. Очистка производится осаждением примесей строго дозированными осадительными реактивами: суспензией соды и известковым молоком.
|
|
|
Осаждение примесей происходит по реакциям:
Mg2++ Са(ОН)2 = Са2+ + Mg(OH)2↓
Са2+ + Na2CО3 = 2 Na+ + CaCО3↓
Помимо химической очистки рассол освобождают от механических примесей отстаиванием и фильтрованием.
Диафрагменное производство (рис. 9.1) включает следующие стадии:
1) приготовление и очистка рассола. На этой стадии растворяют твердую поваренную соль и очищают рассол от ионов кальция и магния. Подготовленный рассол направляют на электролиз;
2) электролиз;
3) выпаривание электролитических щелоков. На этой стадии слабые растворы едкого натра и хлорида натрия, полученные при электролизе, упаривают до товарной концентрации по гидроксиду натрия. Выпадающую при этом соль отделяют от раствора, растворяют в воде и передают на стадию приготовления рассола, где этот рассол присоединяется к рассолу, приготовленному из свежей соли;
4) вывод сульфатов. На эту стадию поступает хлорид натрия, полученный на последней ступени выпаривания электролитических щелоков и содержащий повышенное количество сульфатов. Из соли выделяют сульфат натрия в виде товарной продукции. Очищенный раствор соли передают на стадию приготовления рассола;
|
|
|
5) охлаждение и сушка хлора;
6) охлаждение и сушка водорода.
Реакции, протекающие в диафрагменном электролизере, зависят от материалов и конструкций электролизеров, концентрации рассола, рН среды, плотности тока, температуры и содержания кислородсодержащих ионов.
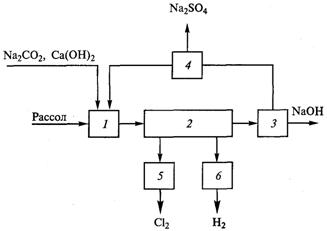 Рис. 9.1. Структурная схема диафрагменного метода:
Рис. 9.1. Структурная схема диафрагменного метода:
1- приготовление и очистка рассола; 2 - электролиз; 3 - выпаривание электролитических щелоков; 4 - вывод сульфидов: 5 - охлаждение, осушка и компрессирование хлора; 6 - охлаждение, осушка и компрессирование водорода.
В промышленных электролизерах анод выполняется из графита, катод - из железа.
На железном катоде основной процесс - выделение водорода:
2 Н+ + 2ē = Н2
2 Н2О + 2ē = Н2 + 2 OH-
Разряд ионов натрия невозможен, так как равновесный потенциал разряда иона натрия на железном катоде в нейтральном насыщенном растворе хлорида натрия значительно выше (-2,71 В), чем у водорода (-0,415 В).
Основная реакция на графитовом аноде:
2 Сl- + 2ē = С12
Кроме этой реакции на аноде протекают побочные реакции:
2 OH- - 2ē = 0,5 О2 + Н2O Н2O - 2ē = 0,5 О2 + 2 Н+
Равновесный электродный потенциал разряда гидроксид-ионов в нейтральном насыщенном растворе хлорида натрия равен +0,82 В, а ионов хлора +1,32 В. Следовательно, на аноде с малым перенапряжением должен бы в первую очередь выделяться кислород.
|
|
|
Как известно из теоретической электрохимии, параллельные электродные реакции проходят с такими частными плотностями тока, которые дают одинаковый потенциал электрода. Поэтому можно записать:
φа = φ (С12) + ψ(С12) = φ (О2) + ψ (О2) (9.12)
где: φа - потенциал анода, В; φ (С12), φ (О2) - равновесные потенциалы выделения хлора и кислорода определяются по формуле Нернста и зависят от концентрации (активности) ионов хлора или гидроксида, а также от температуры; ψ (С12), ψ (О2) — перенапряжение хлора и кислорода; величина перенапряжения увеличивается с ростом плотности тока.
Перенапряжение для выделения хлора снижается с повышением температуры в большей мере, чем у кислорода. При повышении плотности тока процесс на аноде также сдвигается в сторону выделения хлора. Как видно из рис. 9.2, с повышением плотности тока потенциал выделения хлора возрастает в меньшей мере, чем у кислорода. На аноде могут разряжаться гипохлорит-ионы. В результате выделяется кислород:
|
|
|
3 СlO- + 3 Н2O - 6ē = ClO3- + 1,5 О2 + 2 Сl- + 3 Н2
Наличие гипохлоритных ионов вызвано частичным гидролизом хлора.
При диафрагменном электролизе вместе с хлором всегда выделяется кислород. Нормальный уровень выделения кислорода определяется установленным технологическим режимом (материалом анодов, плотностью тока, температурой, составом рассола и др.). Важнейшее условие при этом — нормальная кислотность анолита (раствор находящегося в анодном пространстве).

Рис. 9.2. Анодные поляризационные кривые на графите при 250 °С в 22.6 % (мас.) растворе хлорида натрия:
1- выделение хлора; 2 - выделение кислорода.
Наличие в электролите гипохлорит- и гипохлорат-ионов может вызвать протекание побочных реакций на катоде:
СlO3- + 3 Н2 = 3 Н2O + Сl- СlO- + Н2 = Н2O + Сl-
Повышение щелочности анолита увеличивает интенсивность выделения кислорода на аноде. Поэтому процесс электролиза в диафрагменных электролизерах строят таким образом, чтобы в максимальной степени снизить электролитический перенос иона гидроксида к аноду. Это удается достигнуть за счет применения фильтрующей диафрагмы.
Фильтрующую диафрагму выполняют в виде пористой перегородки, разделяющей катодное и анодное пространства. Она препятствует смешиванию продуктов электролиза. Через нее непрерывно проходит поток анолита из анодного пространства к катоду.
Протекаемость диафрагмы и степень превращения (ориентировочно) контролируют по концентрации гидроксида натрия в католите (электролите, находящемся в катодном пространстве). Практически у современных промышленных электролизеров предельному значению степени превращения соответствует концентрация гидроксида натрия в католите 140-150 г/л. Когда концентрация щелочи превышает его значение, ход электролиза отклоняется от нормы.
Данные, показывающие зависимость выхода по току от концентрации щелочи, приведены на рис. 9.3. Наблюдается снижение выхода по току при работе с католитом, имеющим концентрацию щелочи выше 150 г/л.
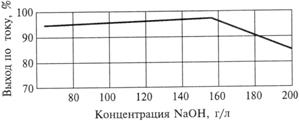
Рис. 9.3. Зависимость выхода по току от концентрации гидроксида натрия в католите
Повышенные температуры электролиза и конденсации хлорида натрия в электролите понижают растворимость хлора, что сокращает вероятность протекания побочных реакций, а следовательно, увеличивает выход потоку. Кроме того, повышение температуры увеличивает электропроводность электролита, благодаря чему снижается напряжение на ванне. Таким образом, уменьшается расход электроэнергии, поэтому электролиз растворов хлорида натрия проводят при температурах 70 - 80 °С.
Промышленные электролизеры с фильтрующей перегородкой широко применяются в промышленности.
Схема современного диафрагменного электролизера представлена на рис. 9.4. Корпус электролизера 7 разделен на две полости: анодное 4и катодное 5 пространства. В анодном пространстве размещены аноды из графита. Анодное и катодное пространства разделены диафрагмой, основанием для крепления которой служит катод 3. Диафрагма покрывает катод со стороны, обращенной к аноду. В анодное пространство подают рассол - насыщенный раствор поваренной соли.
Уровень анолита выше верхней границы диафрагмы. В газовом пространстве над уровнем анолита собирается хлор, образовавшийся на аноде. Отсюда хлор отводится в коллектор. Анолит вследствие разности уровней жидкости в анодном и катодном пространствах протекает сквозь диафрагму.
На катоде восстанавливается водород, а анолит, перетекающий к катоду, меняет состав и обогащается гидроксид-ионами. Католит содержит поваренную соль, гидроксид натрия и небольшую примесь хлората натрия. Он отводится из катодного пространства через сливную трубку 9; ее устройство позволяет регулировать уровень раствора в электролизере. В газовом пространстве над уровнем католита собирается водород, направляемый затем в коллектор.
 Католит, вышедший из электролизера, иначе называемый электролитическим щелоком, содержит гидроксид натрия 110-120 г/л и хлорид натрия 170-180 г/л.
Католит, вышедший из электролизера, иначе называемый электролитическим щелоком, содержит гидроксид натрия 110-120 г/л и хлорид натрия 170-180 г/л.
Рис. 9.4. Схема диафрагменного электролизер:
1- анод; 2 - диафрагма; 3 - катод; 4 - анодное пространство; 5 – катодное пространство; 6 - капельница; 7- корпус электролизера; 8 - крышка; 9 -сливная трубка для католита
Отношение концентрации гидроксида натрия к концентрации хлорида натрия в католите определяется важным показателем технологического режима - степенью превращения (Х) хлорида натрия приэлектролизе. Так называют отношение числа молей хлорида натрия, превратившихся в гидроксид натрия, к числу молей хлорида натрия, поступивших на электролиз.
Степень превращения вычисляют по формуле:
Х= 1,46 · CNaOH / [CNaCl + l,46 CNaOH] (9.13)
Процессы, протекающие в электролизерах, и их технические показатели во многом зависят от функционирования диафрагмы. Чтобы диафрагма могла выполнять свои функции, она должна удовлетворять следующим требованиям:
- быть достаточно плотной и прочной, чтобы обеспечивать полное разделение газовых продуктов и исключать смещение анолита и католита;
- иметь низкое электрическое сопротивление, чтобы избежать потери напряжения в диафрагме;
- обладать достаточно низким гидравлическим сопротивлением;
- быть химически стойкой к кислотам и щелочам, чтобы диафрагма работала продолжительный срок;
- иметь близкие свойства и однородность на всех участках.
Лучший материал для диафрагмы - хризолитовый асбест.
Основное требование к материалу анода - наибольшее перенапряжение выделению кислорода, чем хлора.
Еще не найден материал, абсолютно стойкий к процессам совместного электрохимического выделения хлора и кислорода. На практике стремятся к тому, чтобы применяемые материалы разрушались с относительно небольшой скоростью.
Предпочтение отдается материалам с низким удельным электросопротивлением, так как чем ниже сопротивление, тем ниже падение напряжения в аноде и тем равномернее распределение по нему плотности тока. Практически можно использовать платину, графит и магнетит. Лучшая по всем показателям (кроме стоимости) - платина. В промышленности аноды изготавливают исключительно из искусственного графита.
Ртутный метод электролиза водного раствора хлорида натрия содержит те же стадии, что и диафрагменный, за исключением выпаривания (рис. 9.5). Приготовление и очистка рассола в этом производстве имеют особенности и по технологической схеме отличаются от соответствующей стадии диафрагменного производства. Это связано с особыми требованиями к анолиту, возвращаемому на электролиз.
Анолит после электролиза содержит 260-270 г/л хлорида натрия, около 0,6 г/л растворенного хлора, около 5 мг/л кальция, магния, тяжелых металлов, примеси графитовой пыли.
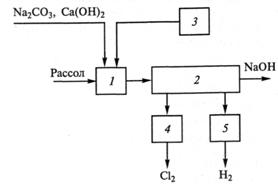
Рис. 9.5. Структурная схема электролиза водного раствора хлорида натрия с ртутным катодом:
1- подготовка и очистка рассола; 2- электролиз: 3 - дехлорирование и очистка анолита; 4 - охлаждение, сушка и компрессирование хлора: 5 - охлаждение, сушка и компрессирование водорода.
Для удаления хлора из анолита последовательно применяют подкисление, вакуумирование, отдувку воздухом, разрушение остатков хлора восстановителями. Подкисляют анолит соляной кислотой. Вакуумирование проводят при давлении 400-450 мм.рт.ст.
Реакции, протекающие на аноде в электролизерах с ртутным катодом, аналогичны реакциям, рассмотренным для диафрагменных электролизеров.
Катодный процесс в электролизерах с ртутным катодом коренным образом отличается от такового в диафрагменном электролизере, в котором на стальном катоде разряжаются ионы водорода.
В ртутных электролизерах выделение водорода на катоде является побочным и вредным процессом. Его развитие сдерживается счет того, что на ртутном катоде или на катоде из амальгамы натрия водород выделяется с большим перенапряжением.
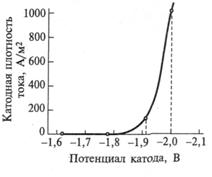
Характерная поляризационная кривая этого процесса приведена на рис. 9.6. На рисунке видно, что интенсивное выделение водорода наступает при потенциалах катода, более отрицательных, нежели – 1.9 В. Однако при меньшем отрицательном потенциале на ртутном катоде возникает другая электродная реакция - образование ртутной амальгамы натрия, на которую и затрачивается основная часть тока.
Металлический натрий в момент выделения реагирует с ртутью, образуя интерметаллическое соединение NaHgn (растворенное в ртути амальгама натрия). При этом работа, необходимая для восстановления иона натрия, снижается на величину энергии, выделяемой при образовании амальгамы. Потенциал образования амальгамы натрия φк = -1.80 В.
Изменение потенциала выделения веществ в электрохимическом процессе за счет возникновения вторичной реакции на электроде называется деполяризацией. За счет деполяризации возможно выделение натрия на ртутном катоде в виде амальгамы по реакции:
Na+ + n Hg + ē = NaHgn
Этот процесс проходит практически без перенапряжения.
Основная побочная реакция на катоде:
 2 H+ + 2e- = H2
2 H+ + 2e- = H2
Рис. 9.6. Поляризационная кривая
выделения водорода на ртути
На катоде проходят и другие побочные процессы. Амальгама натрия реагирует с хлором, растворенным в анолите, по уравнениям:
NaHgn + Сl2 = Na++ CI- + nHg Hg + Cl2 = Hg2++ 2 Cl-
Под действием воды амальгама разлагается, выделяя щелочь:
NaHgn + 2 Н2O = Н2 + Na+ + 2 ОН- + nHg
Реакция в разлагателе состоит из двух сопряженных реакций:
2 Н2O + е- = Н2 + 2 ОН- NaHgn – е- = Na+ + n Hg
Электролитический процесс в электролизере с ртутным катодом проходит в две стадии. На первой стадии, подвергая электролизу водный раствор хлорида натрия, получают хлор и крепкую амальгаму натрия. Амальгама, полученная после электролиза, содержит 0.3-0.5 % натрия. На второй стадии амальгаму обрабатывают очищенной водой. Часть амальгамы разлагается с образованием гидроксида натрия и водорода. Слабую амальгаму ртутным насосом повторно подают на электролиз.
Проведение процесса в две стадии позволяет получить в электролизерах с ртутным катодом раствор гидроксида натрия с очень малыми примесями хлорида натрия.
Схема электролизера с ртутным катодом представлена на рис. 9.7. Он состоит из трех основных частей: электролитической ванны 9, разлагателя 12 и ртутного насоса 10.

Рис. 9.7. Схема электролизера с ртутным катодом:
1 - амальгама; 2 - выходной карман электролизера; 3 - крышка электролизера; 4 - анод; 5 - анодный токопровод и его уплотнение; 6 - анолит; 7 - пространство для сбора хлора; 8 - входной карман электролизера; 9 - электролитическая ванна; 10 - ртутный насос; 11 - насадка разлагателя; 12 - разлагатель; 13- раствор гидроксида натрия.
В электролитическую ванну 9непрерывно поступают насыщенный раствор хлорида натрия и слабая амальгама. Из электролизера отводятся хлор совместно с водяными парами и крепкая амальгама Отдельно от амальгамы отводят обедненный в результате электролиза раствор хлорида натрия с растворенным в нем хлором.
В разлагатель 12непрерывно подают крепкую амальгаму и очищенную воду. Отводятся водород с водяными парами, раствор гидроксида натрия в воде и слабая амальгама.
Ртутные электролизеры рассчитаны на работу с высокой плотностью тока (5000-10 000 А/м2). С повышением плотности улучшается выход потоку. Кроме того, снижается (при одной и той же токовой нагрузке) расчетная поверхность катода, следовательно, уменьшается необходимое количество ртути.
В настоящее время распространены горизонтальные электролизеры. Они представляют собой наклонный желоб прямоугольного сечения, по дну которого самотеком течет амальгама. Желоб покрыт крышкой 3, на которой укреплены графитовые плоские анодные плиты 4. Расстояние между электродами 3-5 мм. Плиты располагают так тесно, чтобы площадь рабочей поверхности анодов приближалась к площади поверхности катода. Каждая анодная плита имеет токоподвод, выведенный через крышку электролизера. В месте прохода токоподвода через крышку имеется уплотнение 5, препятствующее выходу хлора в атмосферу.
В процессе электролиза графит разрушается. В результате увеличивается межэлектродное расстояние и растет напряжение электролиза. Поэтому в современных конструкциях аноды снабжают устройством, позволяющим регулировать межэлектродное расстояние.
Для этого применяют устройства двух различных типов. Первый тип рассчитан на опускание каждого анода в отдельности, второй - на опускание одновременно целой группы анодов.
Поверх слоя амальгамы в электолизере в том же направлении движется анолит 6.
Над слоем анолита образуется газовое пространство 7. В нем собирается выделившийся хлор. Хлор и анолит отводятся из электролизера либо совместно, либо раздельно.
Вторая стадия электрохимического процесса проходит в разлагателе. Горизонтальные разлагатели имеют вид стального, герметично закрытого желоба, устанавливаемого с уклоном. На дне разлагателя укладывают графитовые плиты 12. Поток амальгамы самотеком движется по его дну. Противотоком к амальгаме движется раствор едкого натра и отводится вместе с водородом в конце разлагателя.
КОНТРОЛЬНЫЕ ВОПРОСЫ К ТЕМЕ 9.2
9-1. Какие существуют промышленные способы электролиза водного раствора хлорида натрия?
9-2. Назовите основные стадии диафрагменного способа электролиза.
9-3. Какая реакция протекает на катоде при диафрагменном способе электролиза? Какие побочные реакции могут протекать на катоде при диафрагменном способе электролиза?
9-4. Какое основное вещество выделяется на аноде при диафрагменном способе электролиза? Какое побочное вещество выделяется на аноде при диафрагменном способе электролиза?
9-5. В чем заключаются особенности электролиза водного раствора хлорида натрия с ртутным катодом? Какова роль диафрагмы в диафрагменном электролизере?
ЗАДАЧИ К ТЕМЕ 9.2
9-1. Вытекающий из диафрагменного хлорного электролизера щелок содержит 130 кг/м3 щелочи. Ванна работает с нагрузкой 25 кА, выходом по току для CI2 и NaOH 96 %, а для водорода 98 %. Рассчитайте: а) суточную производительность ванны по хлору и водороду (по массе и объему) и по щелочи; б) объем щелока, вытекающего за 1 ч из ванны. Условия нормальные.
9-2. Сколько часов должен работать электролизер БГК-17-25 для получения хлора объемом 800 м3, если выход по току составляет 96 %, сила тока 30 кА? Условия нормальные.
9-3. Рассчитайте теоретическое значение (В) напряжения разложения при электролизе водного раствора хлорида натрия. Концентрация анолита 270 кг/м3, католита 120 кг/м3.
9-4. Рассчитайте коэффициент использования энергии для электролизера, снабженного железным катодом, где теоретическое напряжение разложения 2.16 В, а практическое 3.55 В при электролизе водного раствора хлорида натрия. Выход по току 93 %.
9-5. Определите выход по току для электролизера БГК-17-50, где в течение суток при силе тока 40 кА было получено 9821 м3 электролитического щелока, содержащего 140 кг/м3 едкого натра.
9-6. В диафрагменном способе получения едкого натра процесс электролиза заканчивают, когда массовая доля едкого натра в растворе достигает 10 %. Рассчитайте, какая массовая доля хлорида натрия подверглась электролизу, если первоначальная концентрация рассола была 310 кг/м3, а плотность 1.197 т/м3.
9-7. Определите степень превращения для католита, содержащего 120 кг/м3 едкого натра, если первоначальное содержание хлорида натрия составило 293 кг/м3. Потерями в производстве пренебречь.
9-8. Определите дополнительный расход электроэнергии на получение водорода массой 1 т, вызываемый перенапряжением выделения газа h = 0.2 В.
9-9. Вычислите расход энергии на получение хлора массой 1 т в электролизере БГК-17-50, если сила тока на зажимах 25 кА, напряжение 3.6 В, выход по току 96 %.
9-10. Определите выход по току для электролизера фирмы «Хукер», в котором получается 225 м3/ч католита, содержащего 135 кг/м3 едкого натра. Электролизер работает с нагрузкой 40 кА.
9-11. Определите недельную потребность предприятия в железнодорожных цистернах грузоподъемностью 50 т для перевозки жидкого хлора, если на предприятии действуют 3 серии электролизеров БГК-17-50, по 68 штук в каждой серии. Нагрузка электролизера 50 кА, выход по току 96 %.
9-12. Рассчитайте теоретический расход электроэнергии для получения едкого натра массой 1 т и хлора массой 1 т в диафрагменном электролизере, если теоретическое напряжение разложения раствора хлорида натрия равно 2.2 В.
9-13. Вычислите расход энергии на производство 1 т едкого натра в электролизере с ртутным катодом типа «Сольве» V-200, если напряжение на электродах составляет 4.56 В, выход по току 96 %, сила тока 190 кА.
9-14. В цехе электролиза имеется 66 ванн с ртутными катодами. От источника постоянного тока на них подается напряжение 250 В при силе тока 30 кА. Определите производительность такого цеха в сутки по щелоку с концентрацией едкого натра 140 кг/м3 и хлору при выходе по току 96 %; напряжение на каждой ванне и расход энергии на 1 т хлора и 1 т едкого натра (в отдельности).
9-15. По днищу ртутного электролизера, имеющего длину 10 м, ширину 1,5 м, протекает ртуть слоем 5 мм. При входе в электролизер массовая доля натрия в ртути равна 0.01 %, а на выходе 0.2 %. Выход по току 95 %. Катодная плотность тока 5000 А/м2. Определите массу 40 %-ного раствора едкого натра, которую можно получить с 1 м2 ртутного катода, и линейную скорость течения ртути. Изменением плотности ртути при образовании амальгамы пренебречь.
9-16. Определите выход по энергии для ртутного, электролизера Р-101, если здесь: потенциал анода -1.42 В; потенциал катода 1.84 В; напряжение на ванне 3.55 В; выход по току 93.7 %.
9-17. Рассчитайте объемную скорость циркуляции ртути в хлорном электролизере, если в поступающей ртути массовая доля натрия равна 0.015 %, а в выходящей из электролизера 0.21 %. Выход по току натрия равен 97 %, нагрузка электролизера 25 кА.
9-18. В горизонтальном разлагателе, куда поступает в час 23 т амальгамы натрия, выделился водород объемом 56 м3. Определите массовую долю натрия в амальгаме (при н. у.).
9-19. Проектная годовая мощность одного из предприятий по производству соляной кислоты составляет 80 тыс. т продукта с массовой долей хлороводорода 34 %. Обеспечит ли это предприятие хлором и водородом цех с 84 ваннами типа Р-ЗО, работающий по графику предприятия? Выход по току 96 %, нагрузка одного электролизера 30 кА. Выход кислоты составляет 95 % от теоретического.
9-20. Диафрагменный хлорный электролизер имеет следующие показатели работы: выход по току хлора 95 %; выход по току водорода 99 %; нагрузка 20 кА. Какую массу соляной кислоты с массовой долей хлороводорода 35 % можно получить из всего произведенного хлора за 30 дней работы электролизера? Какой объем водорода в м3 должен произвести электролизер для получения этой массы кислоты, если объемная доля водорода на 5 % больше против стехиометрии?
Дата добавления: 2018-02-18; просмотров: 7520; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
