Рівняння стану ідеального газу
Рівн́яннястáнуідеáльногогáзу — формула, що встановлює залежність між тиском, молярним об'ємом і абсолютною температурою класичного ідеального газу.
 - рівняння клапейрона
- рівняння клапейрона
PVмол=RT(R=8.31дж/моль*Куніверсальнагазова стала)
PV= 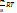 р-ння Клепейрона-Менделеєва(μ-молярна маса)
р-ння Клепейрона-Менделеєва(μ-молярна маса)
Стала Больцмана
Ста́лаБо́льцмана (k або kB) — фізична стала, що визначає зв'язок між температурою та енергією.
K=R/NA=1.38*1023Дж/К
P=nKT-залежністьтискувідтемператури(р-ння стану ідеального газу)
P= 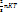 - внутрішняенергія та тиск
- внутрішняенергія та тиск
Ступінь свободи – це незалежні координати, які визначають положення тіла в просторі за часом.
Абсолютна температура- базується на кінетичній теорії Кельвіна визначає як відсутність поступального руху молекул. 
Абсолютна температура є міроюсередньоїкінетичноїенергії
поступальногоруху молекул тіла (термодинамічноїсистеми).
Імовірність та флуктуації. Розподіл молекул ідеального газу за їх швидкостями. Барометрична формула. Розподіл Больцмана.
Імовірність – це можливість .
Флуктуація – неочікуваний процес.
Барометрична формула — формула, за якою визначають залежність тиску або густини газу від висоти. 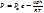
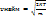 . тиск на будь-якій висоті= тиску на рівні моря.
. тиск на будь-якій висоті= тиску на рівні моря.
P=nkT(n-концентр молекул,k-стала величина,T-темпер)
n=n0e* 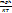 -розподіл Больцмана
-розподіл Больцмана
Зіткнення молекул. Середня довжина вільного пробігу молекул. Поведінка газів в умовах низького тиску.
|
|
|
Середня довжина вільного пробігу – це середня довжина, яка проходить молекула, або атом до наступного зіткнення.
Фізичний вакуум – відсутність молекул.
Технічний вакуум – це співвідношення між довжиною вільного пробігу та концентрацією молекул.
Вакуум технічний поділяється: середню довжину вільного
Термодинаміка
Теплота та робота. Внутрішня енергія системи. Перше начало термодинаміки
Перше начало термоди – це (закон термодинаміки) закон збереження енергії для термодинамічного процесу.
Тепло – передача енергії або тепла може відбуватися двома методами або здійснення роботи або теплообміну.
Якщо передача енергії відбувається в зовнішній силі – це робота.
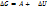
Кількість тепла іде на виключення роботи і змінні внутрішньої енергії. При сталому тиск змінює об’єм.
Внутрішня енергія – показник внутрішньої енергії є температура.
dA=PdV
Двигун – використовує будь-якої енергії для виконання роботи.
Ізопроцеси в газах . теплоємність газів
1)T=const – ізотермічний процес
Внутрішня енергія незмінна, а зовнішня іде лише на виконання роботи.Q=A
2)P=const ізобарний
Змінна енергія Q=PVΔ+U
3)V=constізохорний
Робота не виконується,зовн енергія іде на зміну внутр. Енергії
|
|
|
4)Адіабатичний процес – це процес за якого теплообміну немає, а зовн енергія відсутня
Q=0, A=-U,P=Vγ=const
γ-відношення теплоємності при сталому тиску до теплом.при сталому об’ємі
Теплоємність-величина, яка визначає, яку к-сть енергії треба підвести до тіла, щоб змінити його t на1C
С-теплоєм =  =1дж/кг*К
=1дж/кг*К
1)Питома теплоєм. – С=dQ/dtпоказує яку к-сть тепла потрібнопідвести до одиниці к-стьречовини, щобt ↑ на 1С
2)Молярна теплоєм.-показує, яку к-сть речовини потрібно надати 1 молю речовини, щобt ↑ на 1С. 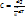
Cмол=Cμ – зв’язок між молярн та питомтеплоєм.
Р-ння теплового балансу
Форма,розмір,об’єм –сталі для тверд тіла
К-сть теплі для тверд тіла залежить від:
1)нагрівання Q=CmT
2)Плавлення-процес переходу від твердого до рідкого стану.енергія іде на розривання молекул зв’язків. Q=λm
3)кристалізація-процес оборотний до плавлення
λ питома теплотплавл- це к-сть енергії,яку треба надати одиниці маси твердого тіла при t плавл,щоб перевести його з тверд стану в рідкий
К-сть теплі для рідин залежить від(V=const)
1)випаровування-може відбуватися при будь якій t,тільки від відкритої поверхні
2)кипіння-пароутворення по всьому об’єму
3)пароутворення-прямий процес переходу з рідк стану в газоподQ=nm(n-питома теплота пароутв,m-маса)
|
|
|
4)Конденсація-перехід з газопод в рідк стан
n-питома теплота пароутв – це к-сть тепла,яку треба надати одиниці маси рідини (при t кипіння)щоб перетворити з рідкого в газопод стан
питома теплота згорання-к-сть тепла,яка виділяється при згоранні одиниці маси пальногоQ=mK(K-к-сть тепла)
Тіла, нагріті до певної температури, віддають холоднішим тілам деяку кількість теплоти. Знаючи початкові температури, маси всіх тіл і питомі теплоємності, можна обчислити невідому теплоємність твердого тіла, виходячи з так званого рівняння теплового балансу, яке формулюється так: кількість теплоти Q1, яку віддає більш нагріте тіло, дорівнює кількості теплоти, що її набуває менш нагріте тіло Q2.
Питома теплоємності плавлення - це кількість енергії, яку потрібно надати одиниці маси твердого тіла при температурі плавлення, щоб перевести його з твердого стану в рідкий.
Пароутворення – перехід з рідкого в газоподібний
Конденсація – перехід з газоподібного стану в рідкий.
Випаровування можливе при будь-які температурі, тільки при відкритої поверхні.
Кипі́ння— процес переходу рідини до пари, який характеризується, на відміну від випаровування, тим, що утворення пари відбувається не тільки на поверхні, але й в усій масі рідини. Кипіння можливе, якщо тиск насиченої пари рідини дорівнює внутрішньому тиску.
|
|
|
Питома теплоємності пароутворення – це кількість енергії або тепла яку потрібно на лати одиниці маси рідини.
Рівння теплового балансу – складається з кінетичної та потенціальної енергії.
Вн́утрішняене́ргія тіла (позначається як E або U) — повна енергія термодинамічної системи за винятком її кінетичної енергії як цілого і потенціальної енергії тіла в полі зовнішніх сил. Внутрішня енергія складається з кінетичної енергії хаотичного руху молекул, потенціальної енергії взаємодії між ними і внутрішньомолекулярної енергії.
Температура – це ознака внутрішньої енергії.
Дата добавления: 2018-02-18; просмотров: 998; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
