Метаболические кислоты и продукция бикарбонатов
КИСЛОТНО-ОСНОВНОЕ СОСТОЯНИЕ
Кислотно-основное состояние является одним из важнейших компонентов гомеостаза.
Метаболическая активность организма обеспечивается четкой регуляцией кислотно-основного равновесия, отражением которого является рН внеклеточных жидкостей. Возбудимость мембран, активность ферментных систем, течение химических реакциий зависят от баланса кислот и оснований. Оптимальный режим функционирования физиологических процессов реализуется только в ограниченном диапазоне колебаний значений рН. Многие факторы, в том числе и патологические, могут изменять концентрацию ионов Н+ во внеклеточных жидкостях.
Взаимодействие кислот и оснований и их влияние на рН крови описывает уравнение Гендерсона-Гассельбаха:
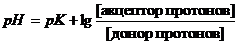
где К – константа диссоциации, которая определяет способность отдавать протоны.
Так как К и соответственно рК постоянны при определенной температуре, то

рН – один из самых «жестких» параметров крови. Его колебания крайне незначительны: от 7,36 до 7, 44; рН артериальной крови составляет 7,35-7,45; венозной – 7,32 – 7,42. Отклонение рН за эти границы рассматривается как нарушение КОС. Даже слабо выраженные изменения этого показателя приводят к существенным сдвигам окислительно-восстановительных процессов, изменению активности ферментов, проницаемости клеточных мембран и другим нарушениям, опасным для нормального функционирования организма. Жизнеспособность человека сохраняется при рН крови от 6,8 до 7,7.
|
|
|
Концентрация ионов водорода поддается влиянию многочисленных факторов:
1. экзогенных (пищевые продукты);
2. эндогенному образованию физиологических продуктов обмена веществ, как результат жизнедеятельности клетки или образования молочной кислоты при мышечной деятельности;
3. эндогенному образованию нефизиологических кислот, например, при хроническом брожении в кишечнике вследствие дисбактериоза, или в результате постоянного патологического образования кислоты при дисфункции органов, например, при диабете;
4. выведению кислот и щелочей в результате обменной деятельности почек и кишечника;
5. выделению углекислоты через легкие;
6. эндогенному физиологическому образованию большого количества соляной кислоты в обкладочных клетках желудка, что оказывает доминирующее влияние на КОС организма;
7. уровеню оксигенации крови и состоянию гемодинамики;
8. интенсивности метаболических процессов и др.
Химия кислот и оснований
Понятие кислоты и основания было введено в медицинскую практику Bronsted в 1923 году. В соответствии с предложенным им определением кислотой является вещество, способное отдавать ион водорода, а основанием – вещество, способное присоединять ион водорода. При добавлении кислоты к воде, она обратимо диссоциирует, образуя Н+ и анионы (Аˉ); например, Н+ + Аˉ. Степень до которой диссоциирует кислота и действует как донор иона Н+ определяется силой или слабостью кислоты. Сильные кислоты, такие как серная кислота, диссоциируют полностью; слабые кислоты, такие как уксусная кислота, диссоциируют только в ограниченных пределах. Вышесказанное верно и для оснований и их способности диссоциировать и акцептировать ион водорода. Большинство кислот и оснований организма - слабые кислоты и основания; наиболее значимые - угольная кислота (Н2СО3), которая является слабой кислотой, образующейся из двуокиси углерода (СО2), и бикарбонат (НСО3ˉ ), который является слабым основанием.
|
|
|
Кислотность или щелочность раствора зависит от концентрации в нем протонов, причем концентрация может изменяться на несколько порядков величин. Концентрация Н+ ионов в жидкостях организма не сопоставима с таковой для других ионов. Например, концентрация ионов натрия (Na+) приблизительно в 1 миллион раз выше, чем концентрация Н+. Поскольку концентрация ионов водорода очень низка, (в норме концентрация водородных ионов в циркулирующей крови при рН=7,4 составляет 40´10-9 ммоль/л), то ее обычно выражают в единицах рН (power Hydrogene – сила водорода). рН представляет собой отрицательный десятичный логарифм (р) концентрации ионов Н+ в миллиэквивалентах на литр; значение рН, равное 7,0 соответствует концентрации ионов Н+ в 10ˉ7 (0,0000001) эквивалентов на литр (mEq/L).
|
|
|

рН обратно связан с концентрацией ионов Н+; низкий рН свидетельствует о высоком содержании ионов Н+, высокий рН – о низком уровне ионов Н+.
Точно определить рН во внутриклеточной жидкости невозможно; по данным, полученным с помощью большинства существующих методов, эта величина в среднем составляет 6,9. Концентрация ионов водорода неравномерна не только в цитоплазме, но и в пределах органелл одной клетки.
Константа диссоциации (К) используется для описания степени, до которой кислота и основание диссоциируют. рКа - отрицательный десятичный логарифм константы диссоциации для кислоты. Он равен значению рН, при котором кислота диссоциирована на 50%. Использование отрицательного десятичного логарифма для констант диссоциации позволяет выражать рН в положительных значениях. Каждая кислота в водном растворе имеет определенный рК, незначительно варьирующий при изменении температуры и рН. При нормальной температуре тела, рКа для НСО3ˉ буферной системы внеклеточной жидкости составляет 6,1.
|
|
|
Все кислоты, основания и соли в растворах диссоциируют на разноименно заряженные ионы. Определенная группа веществ может диссоциировать в зависимости от рН среды. Эти вещества называют амфотерными электролитами или амфолитами. В щелочном растворе они ведут себя как кислоты и являются донорами Н+, в кислом растворе способны связывать Н+ и проявляют свойства оснований. К амфолитам относятся белки крови человека. Реакция крови человека слабощелочная, поэтому белки ведут себя как слабые кислоты.
Обмен кислот и оснований в организме тесно связан с обменом воды и электролитов. Все эти процессы объединены законом электронейтральности и изоосмолярности. Электронейтральность плазмы сохраняется благодаря постоянному равновесию катионов и анионов. Это означает, что изменение концентрации одного из ионов неизбежно влечет за собой адекватные сдвиги в концентрации других ионов (катионов или анионов). Например, уменьшение содержания хлора приводит либо к увеличению концентрации другого аниона (чаще бикарбоната), либо к соответствующему уменьшению (выведению из организма) катиона натрия.

Рис.1. Ионный состав плазмы.
Для плазмы крови закон электронейтральности проявляется в том, что концентрация катионов и анионов равна, составляя соответственно по 155 ммоль/л. Следовательно, суммарно Росм плазмы равно 310 ммоль/л. Из общего количества катионов плазмы на долю натрия приходится 142 ммоль/л. В группе анионов 103 ммоль/л составляют ионы хлора (слабое основание). Бикарбонат и белки представляют собой сильные буферные основания. На их долю приходится соответственно 27 моль/л и 15 ммоль/л.
В норме концентрация бикарбоната (НСО3ˉ) в плазме крови в 20 раз выше, чем угольной кислоты (Н2СО3). Именно при таком соотношении НСО3ˉ и Н2СО3 сохраняется рН, равный 7,4. Если изменяется концентрация бикарбоната или углекислоты, меняется их соотношение и происходит сдвиг рН в кислую (ацидоз) или щелочную (алкалоз) сторону. В этих условиях нормализация рН происходит за счет действия ряда компенсаторных регуляторных механизмов, восстанавливающих прежнее соотношение кислот и оснований в плазме крови, а также в различных органах и тканях.
Разность между измеряемыми концентрациями основных катионов (натрий и калий) и анионов (хлор и бикарбонат) плазмы называется анионным интервалом (АИ). Анионный интервал – показатель, в значительной степени отражающий количество образованных и/или задержанных в организме нелетучих кислот.

В норме АИ составляет 16±4 мэкв/л. Увеличение АИ чаще всего связано с накоплением органических кислот (ацидоз) или с гиперпротеинемией. Уменьшение АИ происходит при гипопротеинемии. АИ – косвенная анионов в сыворотке, которые не изменяются при рутинном лабораторном анализе.

Рис.2. Анионный интервал при ацидозе вследствие избытка органических кислот и избытке хлора. Неизмеряемые анионы, такие как фосфаты, сульфаты и органические кислоты, увеличивают АИ вследствие замещения гидрокарбоната. Это подразумевает отсутствие изменения содержания Na+.

Существует несколько вариантов определения АИ, в частности, без добавления в формулу концентрации ионов калия. В этом случае АИ в норме будет равен 12±4 мэкв/л.
При метаболическом ацидозе органические анионы накапливаются одновременно с эквивалентным количеством ионов водорода. Так, при диабетическом кетоацидозе накапливаются ацетоацетат и b-оксимасляная кислота, при лактоацидозе накапливается лактат. При этом электронейтральность поддерживается за счет снижения количества бикарбоната. Существенное увеличение АИ наблюдается при отравлениях метанолом, этиленгликолем. Большинство видов метаболического ацидоза возникает в результате снижения уровня бикарбоната плазмы без соответствующего повышения концентрации ионов хлора, что сопровождается повышением АИ.
В то же время при почечном канальцевом ацидозе, связанном с потерей бикарбоната, происходит повышение в плазме ионов хлора и АИ будет в пределах нормы. Поэтому расчет АИ имеет диагностическое значение. Хотя в клинических условиях причину метаболического ацидоза можно установить с помощью обычных анализов, тем не менее расчет АИ может быть полезен при анализе комплексных нарушений КОС.
Метаболические кислоты и продукция бикарбонатов
Кислоты постоянно образуются в организме как побочные продукты метаболических процессов. Физиологически эти кислоты подразделяются на две группы: летучая кислота Н2СО3 и все другие нелетучие кислоты.
Различие между двумя типами кислот связано с тем, что Н2СО3 находится в равновесии с летучим газом СО2, который выводится из организма через дыхательные пути. Концентрация Н2СО3, таким образом, определяется внешним дыханием. Нелетучие кислоты (например, серная, соляная, фосфорная) не элиминируются через легкие, амортизируются в организме белками или внеклеточными буферами, такими как НСО3ˉ , а затем экскретируются почками.
Дата добавления: 2018-02-15; просмотров: 1185; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
