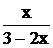Примеры решения типовых задач. Задача № 1.Составление выражения константы равновесия с учетом числа прореагировавших моль вещества
Задача № 1.Составление выражения константы равновесия с учетом числа прореагировавших моль вещества
Пусть протекает реакция:
СО + 2Н2 Û СН3ОН
Запишем выражение для констант равновесия через парциальные давления и концентрации (Кр и Кс),
 ;
;  ,
,
где РСН3ОН, РСО, РН2 – равновесные парциальные давления;
ССН3ОН, ССО, СН2 – равновесные концентрации этих веществ.
В данном случае необходимо использовать методические приемы, направленные на нахождение равновесных парциальных давлений и концентраций.
Будем считать, что общий объем системы равен V, а общее давление в смеси – Р. В начальный момент времени было взято:
а) а моль СО; в моль Н2
б) а моль СО; в моль Н2 d соль СН3ОН
в) исходные вещества взяты в стехиометрических количествах, а продукты реакции в начальный момент отсутствуют и реакция идет слева направо до установления в системе равновесия.
Тогда задачу можно записать следующим образом, учитывая при этом, что
 ; Рi = P . xi; xi =
; Рi = P . xi; xi =  ,
,
где Ci – концентрация веществ;
` Pi – парциальное давление;
xi – мольная доля вещества;
ni – число моль вещества.
Для случая а) При смешении а моль СО и в моль Н2 реакция пойдет слева направо до установления в системе равновесия
| СО + 2Н2 Û СН3ОН | |||
| 1. Исходное число моль: (ni исх) | А | в | 0 |
| 2. Число моль вещества, прореагировавших к моменту равновесия (ni прореаг.) | Х | 2х | х |
| 3. Число моль вещества к моменту равновесия (ni (равн)) | а – х | в – 2х | х |
| 4. Равновесные концентра- ции Ci (равн) = ni (раван)/V | 
| 
| 
|
| 5. Суммарное число моль в состоянии равновесия åni равн | а – х + в – 2х + х = а + в – 2х | ||
6. Мольная доля вещества
при равновесии
xi равн = 
| | ||
| 7. Равновесные парциаль- ные давления веществ в смеси Рi равн = хi равн . Р | | ||
8. Составим выражения для Кр и Кс:

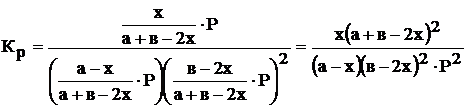
Для случая б) Из начальных условий нельзя определить в какую сторону пойдет реакция. Поэтому предположим, что реакция пойдет вправо
| СО + 2Н2 Û СН3ОН | |||
| 1. Исходное число моль: (ni исх) | А | в | d |
| 2. Число моль вещества, прореагировавших к моменту равновесия: (ni прореаг.) | Х | 2х | х |
| 3. Число моль вещества в состоянии равнове- сия (ni (равн)) | а – х | в – 2х | d + х |
| 4. Равновесные концентрации Ci (равн) = ni (раван)/V | 
| 
| 
|
| 5. Суммарное число моль в состоянии равнове- сия åni равн | а – х + в – 2х + d + х = а + в + d – 2х | ||
6. Мольная доля вещест ва
при равновесии
xi равн = 
| | ||
| 7. Равновесные парциаль- ные давления веществ в смеси Рi равн = хi равн . Р | | ||
8. Составим выражения для Кр и Кс:
 ;
;

Для случая в)
| СО + 2Н2 Û СН3ОН | |||
| 1. Исходное число моль: (ni исх) | 1 | 2 | 0 |
| 2. Число моль вещества, прореагировавших к моменту равновесия (ni прореаг.) | х | 2х | Х |
| 3. Число моль вещества к моменту равновесия (ni (равн)) | 1 – х | 2 – 2х | Х |
| 4. Равновесные концентра- ции Ci (равн) = ni (раван)/V | 
| 
| 
|
| 5. Суммарное число моль в состоянии равновесия åni равн | 1 – х + 2 – 2х + х = 3 – 2х | ||
6. Мольная доля вещества
при равновесии
xi равн = 
| | ||
| 7. Равновесные парциаль- ные давления веществ в смеси Рi равн = хi равн . Р | | ||
8. Составим выражения для Кр и Кс:
 ;
;

Задача № 2. Рассчитать константы равновесия Кр, Кс и состав равновесной смеси с учетом степени диссоциации для реакции:
СН3ОН Û СО + 2Н2
Пусть начальное число моль СН3ОН равно «а», а степень диссоциации СН3ОН при общем давлении Р равно «a».
Решение. Для написания выражения для Кр и Кс данной реакции необходимо знать равновесные и парциальные давления и концентрации.
Покажем решение этой задачи также в общем виде:
| СН3ОН Û СО + 2Н2 | |||
| 1. Исходное число моль: (ni исх) | а | 0 | 0 |
| 2. Число моль в равновес- ном состоянии с учетом a: (ni (равн)) | а(1 – a) | аa | 2аa |
| 3. Равновесные концентра- ция при общем объеме V: Ci (равн) = ni (раван)/V | 
| 
| 
|
| 4. Суммарное число равно- весных моль: åni равн | а(1 – a) + аa + 2аa = а(1 + 2a) | ||
5. Мольная доля вещества
при равновесии
xi равн = 
| | ||
| 6. Равновесные парциаль- ные давления компонен- тов Рi равн = хi равн . Р | | ||
7. Составим выражения для Кр и Кс:

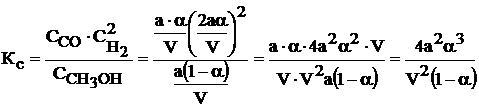 .
.
Задача № 3.При температуре Т = 2773 К вода частично диссоциирует на кислород и водород. 1 м3 получившейся смеси при этих условиях весит 0,7757 кг; степень диссоциации равна 4,1%. Определите Кр и Кс для реакции.
Решение:
2 Н2О = 2 Н2 + О2
Концентрация до реакции n H2O/V 0 0
В состоянии равновесия nH2O(1-a)/V nH2Oa /V nH2Oa /2V
где n H2O = m H2O / M H2O = 0,7757 / 18 = 0,0431.
Подставляем значения равновесных концентраций в выражения константы равновесия:
Kc = C(H2)2 . C(O2) /C(H2O)2 = a3 . n H2O /2(1-a)2V =
=(0,041)3 . 0,7757 / 2(1-0,041)2 .18 = 1,614.10-6 моль/м3
Kp = Kc . RT = 1,614 .10-6 .8,314 .103 .2773 = 37,215 Н/м2.
Задача № 4. Константа равновесия Кр реакции N2O4 = 2 NO2 при Т = 336,2 К равна 1,27 . 105 Н/м2. Определите состав равновесной смеси в мольных процентах, если давление равновесной смеси при указанных условиях р = 1,01 . 105 Н/м2.
Решение:
Количество N2O4, которое было до реакции, примем за 1, тогда:
N2O4 = 2 NO2
до реакции 1 0
в состоянии равновесия 1-a 2a
Из закона Дальтона следует, что p(N2O4) = pN(N2O4) = p(1-a) /(1+a);

p(NO2) = pN(NO2) = p(2a /1+a) или p(NO2) = p - p(N2O4);
Kp = p2(NO2) / p(N2O4) = 4pa2 / (1-a2),
oткуда мольные проценты компонента смеси будут равны:
N(N2O4)(%) = 1-a / (1+a) . 100 = 0,512 . 100/1,488 = 34,40%.
N(NO2) = 100 – N(N2O4)(%) = 65,60 %.
Задача № 5.При Т = 676 К константа равновесия реакции: MgCO3 = MgO + CO2 равна Кр = 1,0133 .105 Н/м2. Найдите уравнение зависимости Кр от температуры, если известно, что при Т = 298 К тепловой эффект реакции DН298 = 118,031 . 106 Дж/кмоль, а DСр = 11,22.103 – 1,759 ; Т – 14,32 . 108 / Т2.
Решение:
Кр = p(MgO) . p(CO2) / p(MgCO3).
При каждой температуре давление насыщенного пара есто величина постоянная, поэтому p(MgO) / p(MgCO3), так же как и Кр’, зависит только от температуры, тогда константу равновесия данной реакции можно выразить так; Кр = р(СО2). Согласно уравнению изобары Вант-Гоффа:
Lg Kp = - DHo / 2,303 RT + (Da /R) lg T + (Db /4,606 R) T +(Dc /13,818 R) T2 +
+ (Dc’ /4,606 R) T- 2 + I.
DHo находим по уравнению Кирхгоффа:
DНо = DНо + DаТ +(Db/2) T2+ (Dc/3) T 3- Dc’/T.
По известному тепловому эффекту при температуре 298 К определяем:
DНо = 118,031 .106 – 11,220 .103 . 298 + (1,759 .2982 /2) – (14,32 .108/298) =
= 109,960 .106 Дж/кмоль.
Постоянную I определяем по Кр реакции при Т = 676 К:
lg 1,0133 .105 = - (109,960 .106 / 2,033 .8,314 . 103 . 676) + (11,22 . 103 lg 676 / 8,314 . 103) – (1,759 . 676 / 4,606 . 8,314 . 103) – (14,34 . 108 / 4,606 . 8,314 . 103 . ×676) + I,
Откуда I = 9,5959.
Таким образом, зависимость Кр от Т будет выражена уравнением:
lg p(CO) = - 5742,2 / T + 1,349 . lgT – 0,0459 . 10- 3T – 0,374 / T2 + 9,5959.
Задача № 6. Зависимость константы равновесия реакции
CO (г) + H2O (г) = СО2 (г)
от температуры определяется эмпирическим уравнением [9]

Найти стандартную теплоту реакции при 25оС, используя уравнение изобары химической реакции и закон Гесса. Результаты расчетов сопоставить.
Р е ш е н и е. Заменим десятичный логарифм на натуральный в уравнении  :
:

Продифференцируем это равенство по температуре
 .
.
Сопоставляя полученное выражение с (I.93), получим
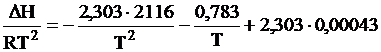 ,
,
Отсюда 
При Т = 298оК

Определим теперь теплоту рассматриваемой реакции с помощью стандартных теплот образования, заимствованных из таблиц термодинамических величин (приложение 1). 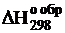 для газообразных CO, H2O, CO2 соответственно равны: -26416, -57793, -94052 кал/моль. Используя следствие из закона Гесса, получим
для газообразных CO, H2O, CO2 соответственно равны: -26416, -57793, -94052 кал/моль. Используя следствие из закона Гесса, получим

Задача № 6. Определите при Т = 600 К и равновесном давлении р = 0,5 . 105 Н/м2 степень термической диссоциации SO3. Реакция протекает по уравнению:
2 SO3 = 2 SO2 + O2.
При указанной температуре DG0600 = 82,274 .106 Дж/кмоль.
Решение:
Из уравнения DG0Т = - RT ln Kp находим Kp:
-lg Kp = DG0Т / 2,303 RT = 82,274 . 106 / (2,303 . 8,314 . 103. 600) = 7,161,
откуда Кр = 6,902 . 10- 8.
Обозначим степень диссоциации через a и примем исходное количество SO3 за единицу. Находим константу равновесия Кр:
2 SO3 = 2 SO2 + О2
до реакции 1 0 0
в состоянии равновесия 1- a a a / 2
Тогда, исходя из закона Дальтона, находим парциальное давление:
рi = p . Ni ; p (SO3) = p(1-a) / (1+a); p(SO2) = p a / (1+a/2);
p(O2) = a / 2 (1+a /2); Kp = p2(SO2) . p(O2) / p2(SO3) = pa3 / 2 (1-a)2 (1+a/2).
При малом значении Кр степень термической диссоциации также будет малой величиной, которой можно пренебречь в знаменателе. Тогда: Кр. » р a3/2 или
 .
.
Задача № 7.
А) На основании стандартных данных для исходных веществ и продуктов реакции, приведенных в справочнике, рассчитайте константу равновесия Кр для реакции при Т = 350 К:
PbSO4 = PbO + SO3.
Решение:
Задачу следует решать по уравнению Шварцмана – Темкина, согласно которому:
DG0 = - RT ln Kp = DH298 - TDS298 – T(Mo Da + M1 Db + M2 Dc + M - 2 Dc’),
где Mo = lg T/298,2 – 1 + 298,2 / T;
Mn = Tn / n (n+1) + (298,2)n+1 / (n+1)T – (298,2)n / n, при n ¹0.
Так как при расчете DG0 стандартное состояние принято р = 1 атм., то при расчете Кр давление равновесной смеси также надо взять в атм.
В таблице сведены необходимые справочные данные:
Таблица
| Вещество | DН298.10- 6 Дж/кмоль | S298.10- 3 Дж/кмоль .град | Дж/кмоль.град | Т = 350 К | ||||
| а.10- 3 | b | с’.10- 8 | Мо | М1.10- 3 | М2.105 | |||
| SO3 (г) | - 395,461 | 256,416 | 57,362 | 26,880 | -13,063 | 0,0196 | 0,0065 | 0,0184 |
| PbO (тв.тел.) | - 218,017 | 69,504 | 44,382 | 26,748 | - | |||
| PbSO4 (тв.) | - 916,953 | 147,382 | 45,889 | 129,797 | 16,790 | |||
DH298 = (DH298)(SO3) + (DH298)(PbO) – (DH298)(PbSO4) = (395,461 – 218,017 +
+ 916,953) . 106 = 304,236 .106 Дж/кмоль;
DS298 = S298 (SO3) + S298 (PbO) – S298 (PbSO4) = (256,416 + 69,504 –
- 147,382) . 103 = 178,538 .103;
Da = a (SO3) + a (PbO) – a (PbSO4) = (57,362 + 44,382 – 45,889) . 103 =
= 49,365 . 103;
Db = b (SO3) + b (PbO) – b (PbSO4) = 26,880 + 26,748 – 129,797 = -76,169;
Dc’ = c’(SO3) + c’(PbO) – c’(PbSO4) = (- 13,062 – 16,790) . 108 = - 29,852 . 108;
DG0 = 304,236 . 106 – 350 . 178,358 . 103 – 350 (0,0196 . 55,855 . 103 –
- 0,0065 . 103 . 76,169 – 0,0184 . 10-5 . 29,852 . 108) = 241,561.108 Дж/кмоль
DG0Т = - 2,303 RT lg Kp;
Откуда lg Kp = 241,561 . 106 / (2,303 . 8,314 . 103 . 350) = - 36,041;
Kp = p (SO3) = 1,099 . 10- 36 Н/м2.
б) Установите закон изменения константы равновесия с температурой. Рассчитайте ее величину при 773 К.
Согласно закону изменения константы равновесия с температурой и поскольку реакция эндотермическая, Кр уменьшается с ростом температуры, то есть К773< К298
Закон изменения Кр с температурой можно вывести из уравнения Вант – Гоффа: d ln Kp / dT = Δ H0T / RT2.
Изменение энтальпии в зависимости от температуры выражается уравнением: Δ H0T = Δ H0298 + ∫T298 Δ Cp dT.
Будем считать, что Δ Cp постоянна в таком интервале температур, в котором не происходит изменения фазового состояния реагентов или продукта:
Δ Cp = Cp (NH3) – ½ Cp (N2) – 3/2 Ср (Н2);
Δ Cp = 8,52 – ½ (6,96) – 3/2 (6,89) = - 5,29 кал/моль.К,
откуда Δ Н0Т = Δ Н0298 + Δ Ср (Т - 298);
Δ Н0Т = - 11040 – 5,29 (Т - 298) кал/моль.
В частности, для температуры 773 К
Δ Н0Т = - 13540 кал/моль.
Запишем уравнение Вант-Гоффа:
d ln Kp / dT = Δ H0298 + Δ Cp (Т- 298) / RT2;
d ln Kp = Δ H0298 + Δ Cp (Т- 298) / RT2 dT.
Интегрирование этого уравнения приводит к следующим результатам:
∫T298 d ln Kp = Δ H0298 – 298 Δ Cp / R ∫T298 dТ / Т2 + Δ Cp / R ∫T298 dТ / Т
ln KpT / Kp298 = - Δ H0298 – 298 Δ Cp / R (1/T – 1/298) + Δ Cp / R ln Т / 298.
Перейдя к десятичным логарифмам и подставляя численные значения в приведенное ниже уравнение, получим:
ln KpT / Kp298 = - 11040 – 298 (- 5,29) / 2,30 . 1,99 (1/Т – 1/298) + 2,66 lg 298 –
- 2,66 lg T;
а поскольку lg Кр298 = 2,98, можно записать закон изменения Кр с температурой в виде: lg КрТ = 2070 / Т – 2,66 lg Т + 2,56.
Итак, для Т = 773 К
lg Кр773 = 2070 / 773 – 2,66 lg 773 + 2,56 = - 2,44;
Кр773 = 3,6 . 10 – 3.
Задача № 8.Константа равновесия реакции 2 HI = H2 + I2 выражается уравнением вида:
ln K = a – b / T
Показать, что теплота диссоциации не зависит от температуры.
Решение:
d ln Kp / dT = DН / RT2; DН = RT2 d ln Kp / dT;
d DН / dT = 2 RT d ln Kp / dT + RT2 d2 ln Kp / dT2
d DН / dT = 0, если 2 d ln Kp / dT + T d2 ln Kp / dT2 = 0.
Выражения типа ln K = a – b / T дают в этом случае действительно нуль.
Задача № 9.
При 550 0С и 1 атм фосген диссоциирует на 80 % по уравнению:
COCl2 = CO + Cl2
Определить Кр и Кс (Обозначения: a - степень диссоциации, р – общее давление).
Решение:
p = p(Cl2) + p (CO) + p (COCl2)
COCl2 = CO + Cl2
1 - a a a
Kp = p (CO) . p (Cl2) / p (COCl2) ; p (Cl2) = p (CO) = p a / 1+a;
n = 1 - a + 2a = 1 + a;
p (COCl2) = p 1 - a / 1 + a;
Kp = (p a /1 + a)2 /p (1 - a /1 + a) = p2 a2 (1 + a) / (1 + a2) p(1 - a) =
= pa 2 / 1 - a 2 = 1 . 0,82 / 1 – 0,64 = 0,64 / 0,36 = 1,78;
Kc = Kp (RT)Dn = Kp / RT = 1,78 / 0,082 . 823 = 2,64 . 10-2;
Dn = 1.
Задача № 10. Показать, как влияет температура и давление на выход конечных веществ, т. е. продукта реакции:
Н2 (г) + ½ О2 (г) = Н2О (г).
Решение:
1) Как известно, эта реакция является экзотермической (∆H < 0). Согласно уравнению изобары Вант-Гоффа, d ln Kp/ dT = ∆H/ RT2 в этом случае d ln Kp/ dT < 0, т. е. увеличение температуры уменьшает Кр, а, следовательно уменьшает выход продуктов реакции.
2) Согласно уравнению Планка-Ван-Лаара, d ln Kx/ dp = - ∆n/ p.
Для данной реакции: ∆n = 1- (1+ 1/2) = - ½ < 0.
Поэтому d ln Kx/ dp > 0 , т. е. с ростом давления возрастает Кх (для продукта реакции).
Задача № 11. На примере синтеза аммиака рассмотрим расчет некоторых термохимических характеристик.
Определите величины DG0Т и константу равновесия Кр при 298 К для реакции синтеза аммиака.
½ N2 (г) + 3/2 H2 (г) = NH3 (г).
Термодинамические данные (справочные) приведены в таблице.
Таблица
| Вещество | D Н f0298, ккал/моль | S0298, кал/моль . К | Ср, кал/моль . К |
| N2 | 0 | 45,77 | 6,96 |
| H2 | 0 | 31,21 | 6,89 |
| NH3 | - 11,04 | 46,01 | 8,52 |
В калориях универсальная газовая постоянная R = 1,99 кал/моль.К
DG0T = D Н 0298 – 298 DS0298
Изменение стандартной свободной энергии соответствующей реакции. Вычислим из табличных данных:
DS0298 = DS0298 (NH3 (г)) – ½ S0298 (N2) – 3/2 S0298 (H2);
DS0298 = 46,01 – ½ (45,77) – 3/2 (31,21) = - 23,69 кал/моль . К.
Следовательно,
DG0298 = D Н 0298 – Т DS0298 = - 11,040 – 298 (- 23,69) = - 3980 кал/моль;
DG0298 = - 3980 кал/моль.
Константа Кр этого равновесия выраажается соотношением:
Кр = p (NH3) / p1/2 (N2) . p3/2 (H2);
Поскольку ln Kp = - DG0T / RT ; lg Kp = - DG0T / 2,303 RT.
Определить степень диссоциации (распада) молекул водорода на атомы при температуре 3500 К в зависимости от давления. Константа равновесия при этой температуре и давлении р = 105 Па.
Решение:
Составим таблицу для расчета равновесных концентраций, учитывая, что из 1 моля Н2 получаем 2 атома Н.
Н2 = 2 Н
Взято 1 -
Ушло - -
Получено - 2х
Равновесие 1 – х 2х
Сумма числа молей в системе: å n = 1 + x.
Вычисляем парциальные давления реагирующих газов:
pi = pобщ . xi;
p (H2) = p 1 – x / (1 + x);
p (H) = 2x / (1 + x.)
Подставляем полученные значения парциальных давлений в выражение константы равновесия реакции:
Kp = (4 x2 . p2 / (1 + x)2) / (1 - x)(1 + x) . p = 4 x2 . p2 (1 + x) / (1 + x)2 .
. (1 - x) p = 4 x2 p / 1 – x2
Определяем из этого уравнения ч, так как это и будет степень диссоциации молекулярного водорода:

Степень диссоциации a = 25,82 %.
Задача № 12. При температуре 1000 К смешали 2 моля СО2(г) и 4 моля Н2О(пар). Определить состав равновесной газовой смеси, если константа равновесия равна 0,72.
СО + Н2О = СО2 + Н2;
Kf = Kp = p (CO2) p (H2) / p (CO) p (H2O) = 0,72.
Решение:
Составим таблицу для расчета равновесных концентраций, учитывая,
что коэффициенты уравнение все равны 1.
Таблица
| вещество | взято | пошло в реакцию | получено | в состоянии равновесия |
| СО | 2 | х | - | 2 – х |
| Н2О | 4 | х | - | 4 – х |
| СО2 | - | х | х | |
| Н2 | - | х | х |
Подставляем данные графы "в состоянии равновесия" в выражение константы: Kf = х2 / (2 - х) (4 - х) = 0,72.
Решаем полученное уравнение: 0,28 х2 + 4,32 х – 5,67 = 0.
Корнями этого уравнения будут: х1 = 1,225; х2 = - 16,675.
Корень х2 отбрасывается, т. к. он лишен физического смысла – нельзя получить больше того, что взяли.
Подставляем значение х1 в таблицу и получаем, что в момент равновесия газовая смесь будет содержать:
| вещество | взято | пошло в реакцию | получено | в состоянии равновесия |
| СО | 2 | 1,225 | 0,775 | 12,9 % |
| Н2О | 4 | 1,225 | 2,775 | 46,3 % |
| СО2 | - | - | 1,225 | 20,4 % |
| Н2 | - | - | 1,225 | 20,4 % |
| Всего: | 6,0 | 100 % |
Дата добавления: 2018-02-15; просмотров: 11548; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!