ЭНТРОПИЯ И ЕЕ СВОЙСТВА. ОПРЕДЕЛЕНИЕ САМОПРОИЗВОЛЬНОСТИ И РАВНОВЕСИЯ ПРОЦЕССОВ В ИЗОЛИРОВАННЫХ СИСТЕМАХ
Физическим смыслом понятия энтропии является мера хаоса в системе; мера той энергии, которая рассеивается в виде тепла и не превращается в работу ("связанная энергия"). Энтропия является функцией состояния системы и не зависит от пути перехода. Ее изменение определяется только начальным и конечным состоянием. Размерность энтропии (СИ):  . Энтропия зависит от массы тела и в ходе процесса она суммируется (аддитивная величина), т.е. обладает экстенсивными свойствами.
. Энтропия зависит от массы тела и в ходе процесса она суммируется (аддитивная величина), т.е. обладает экстенсивными свойствами.
Согласно второму закону термодинамики изменение энтропии в квазистатическом (равновесном) процессе
 (2.1.1)
(2.1.1)
т.е. изменение энтропии происходит под действием энергии, передаваемой в виде теплоты и равно приведенной теплоте  .
.
Следствием второго закона термодинамики являются соотношения
dQнеобр < dQобр (2.1.2)
dWнеобр < dWобр
Т.е. работа любого необратимого процесса всегда меньше работы обратимого процесса между теми же начальным и конечным состояниями системы. Поэтому работу в обратимых процессах называют максимальной работой
Wобр = Wmax (2.1.3)
Чем меньше работа по сравнению с максимальной, тем более необратим процесс. Процессы, которые происходят без совершения работы, являются полностью необратимыми.
Теплота в необратимом процессе также меньше, чем в обратимом.
Таким образом, для необратимых (нестатических) процессов
dS >  (2.1.4)
(2.1.4)
Свойства энтропии.
1)Энтропия – функция состояния; она имеет ту же размерность, что и теплоемкость: 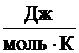
2) Энтропия– понятие вероятностное, поэтому и второй закон термодинамики имеет статистический характер, энтропия связана с термодинамической вероятностью в формуле Больцмана:
S = kℓnW, (2.1.5)
где k – постоянная Больцмана; k = 1,38 × 10-23 Дж/K;
w – термодинамическая вероятность – число микросостояний, при помощи которых реализуется данное макросостояние.
Уравнение Больцмана можно представить и в другом виде:
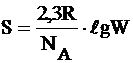 , (2.1.6)
, (2.1.6)
где R – универсальная газовая постоянная; R = 8,31441 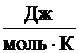 ;
;
NA – число Авогадро; NA = 6,02204 × 1023 моль – 1.
3) Энтропия – экстенсивное свойство системы, зависящее от количества вещества в системе
Увеличение массы в n раз во столько же раз увеличивает энтропию.
4) Энтропия зависит от агрегатного состояния вещества.
5) S– величина аддитивная
S = S1 + S2 + … Sn.
Вычисление энтропии:
Изменение энтропии в химической реакции равно разности между энтропией продуктов реакции и энтропией исходных веществ
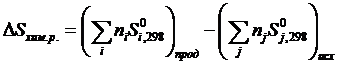 (2.1.7)
(2.1.7)
Если проводить расчет энтропии в условиях, отличных от стандартных, то:
 (2.1.8)
(2.1.8)
Объединив I и II начала термодинамики, получим фундаментальное уравнение термодинамики (уравнение Гиббса) для закрытых систем:
dU £ TdS – pdV –dW/ (2.1.9)
где W/' – все виды работ, совершаемые системой.
Уравнение (9) для закрытых систем, не способных совершать полезную работу:
dU £ TdS – PdV (2.1.10)
Если считать, что вся сообщаемая системе энергия идет на приращение внутренней энергии и на работу, совершаемую системой, то фундаментальное уравнение для равновесных процессов примет вид:
dU = TdS –– dW/' (2.1.11)
Уравнения (2.1.9 – 2.1.11) представляют собой различные варианты фундаментального уравнения термодинамики и позволяют связать изменение внутренней энергии системы с возможностью протекания равновесного и самопроизвольного процессов.
Изменение энтропии вычисляют по следующим уравнениям:
1. Изменение энтропии при нагревании n молей любого вещества от температуры Т1 до Т2 при P = const рассчитывается по формуле
 . (III,2)
. (III,2)
Если зависимость СР от температуры описывается выражением
Cp = a + bT + сT2,
то
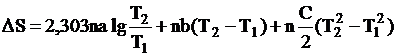 , (III,3)
, (III,3)
2. Изменение энтропии при фазовом переходе рассчитывается по формуле
 , (III,4)
, (III,4)
где ΔН – теплота фазового перехода одного моля вещества; Т – абсолютная температура фазового перехода.
3. Изменение энтропии при переходе n молей идеального газа из одного состояния в другое вычисляется по уравнениям:
 , (III,5)
, (III,5)
или
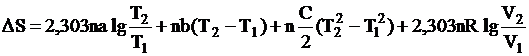 ,
,
 , (III,6)
, (III,6)
или
 ,
,
 , (III,7)
, (III,7)
где V1, P1, T1 и V2, P2, T2 – объем, давление, температура, характеризующие начальное и конечное состояние идеального газа соответственно; СР и СV – соответственно истинные мольные теплоемкости идеального газа при постоянных давлении и объеме:  .
.
4. Изменение энтропии в процессе диффузии при смешении газов (при Р = const и Т = const), т.е. в изотермно-изобарном процессе, вычисляются по уравнению
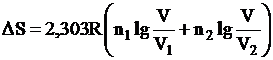 (III,8)
(III,8)
или
 , (III,9)
, (III,9)
где n1, n2 – число молей первого и второго газа; N1 и N2 – мольные доли обоих газов; V1 и V2 – начальные объемы обоих газов; V – конечный объем смеси газов (V = V1 + V2).
5. Вычисление изменения энтропии по электрохимическим данным по уравнению
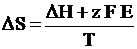 , (III,10)
, (III,10)
где Н – тепловой эффект химической реакции; F – число Фарадея; Е – электродвижущая сила (э.д.с.) электрохимического момента, в котором протекает данная реакция; z – число электронов, участвующих в элементарном акте электродной реакции.
Второй закон термодинамики имеет статистический характер. Он характеризует переход системы из менее вероятного состояния к более вероятному. Это следует из статистического характера энтропии, которая связана с термодинамической вероятностью системы уравнением Больцмана:
S = klnw
Дата добавления: 2018-02-15; просмотров: 5695; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
