Примеры решения типовых задач. Задача № 1. Для реакции: СН3ОН(г) + 3/2 О2 (г) = СО2 (г) + 2 Н2О(г)
Задача № 1. Для реакции: СН3ОН(г) + 3/2 О2 (г) = СО2 (г) + 2 Н2О(г)
определить величину D Ср.
Решение:
Воспользуемся справочными данными о средней теплоемкости веществ.
| Средняя теплоемкость, Дж/моль*К | Вещество | |||
| СО2 (г) | Н2О(г) | О 2 (г) | CH3OH(г) | |
| Ср | 37,129 | 33,572 | 29,372 | 49,371 |
DСр = [ 37,129 + 2. 33,572] - [ 49,371 + 3/2 . 29,372 ] = 10,844 Дж/(К · моль)
Задача № 2.Пользуясь приложением 1, найти стандартную теплоту реакции гидрирования бензола, протекающей в газовой фазе при 1000оК.
Р е ш е н и е. В приложении 1 находим все необходимые для решения задачи исходные данные



Стандартная температура этой реакции, согласно закону Гесса, равна

Разность сумм соответствующих коэффициентов в температурной зависимости теплоемкости продуктов реакции и исходных веществ

Согласно (I.87), стандартная теплота реакции гидрирования бензола при 1000оК равна

Пример 1. Определить зависимость теплового эффекта реакции
2Н2 (г) + СО (г) = СН3ОН (г)
от температуры при постоянном давлении, если стандартные теплоты образования для СО (г) и СН3ОН (г) соответственно равны –110,5 и –201,2 кдж/моль, а зависимость мольной теплоемкости реагентов от температуры описывается следующими уравнениями:
 = 27,28 + 3,26 · 10-3 Т + 0,502 · 105 Т-2 дж/моль·град
= 27,28 + 3,26 · 10-3 Т + 0,502 · 105 Т-2 дж/моль·град
 = 28,41 + 4,10 · 10-3 Т - 0,46 · 105 Т-2 дж/моль·град
= 28,41 + 4,10 · 10-3 Т - 0,46 · 105 Т-2 дж/моль·град
 = 15,28 + 105,2 · 10-3 Т – 3,104 · 105 Т2 дж/моль·град
= 15,28 + 105,2 · 10-3 Т – 3,104 · 105 Т2 дж/моль·град
Вычислить тепловой эффект этой реакции при 500°К и постоянном давлении.
Решение. 1. Определяем ΔСР по уравнению (II,14)
|
|
|
Δа = 15,28 – 28,41 – 2 · 27,28 = - 67,69,
Δb = 105,2 · 10-3 – 4,10 · 10-3 – 2 · 3,26 · 10-3 = 94,58 · 10-3,
Δc = -31,04 · 10-6,
Δc΄ = 0,46 · 105 – 2 · 0,502 · 105 = - 0,5544 · 105,
отсюда ΔСР = - 67,69 + 94,58 · 10-3 Т – 31,04 · 10-6 Т2 – 0,544 · 105 Т-2
2. Определяем тепловой эффект реакции при стандартных условиях для температуры 298°К на основании первого следствия из закона Гесса, пользуясь теплотами образования веществ, входящих в данную реакцию
ΔН298 = - 201,2 + 110,5 = - 90,7 кдж или –90700 дж.
1. Выражаем тепловой эффект, как функцию температуры по уравнению (II,15)

2. Определяем ΔНо по значению ΔН при 298°К:


3. Определяем ΔН при 500°К:

Значение ΔН при 500°К можно рассчитать по формуле (II,15), подставляя Т1 = 298°К и Т2 = 500°К, получим:

Пример 2. Мольная теплота метилового спирта при 25°С составляет 37,4 кдж/моль. Определить теплоту испарения метилового спирта при 50°С, если мольная теплоемкость жидкого и газообразного метилового спирта соответственно равны 81,6 и 43,9 дж/моль·град. Считать теплоемкость в интервале температур 25 – 50° практически постоянной.
Решение: Согласно уравнению (II,11)

 ,
,
или 36,46 кдж/моль.
Задача № 3. Определите тепловой эффект при Т = 500 К реакции образования газообразного ацетона из метана и диоксида углерода:
|
|
|
2 СН4 + СО2 = СН3СОСН3 (г)+ Н2О + Qp ,
а также составьте уравнение зависимости теплового эффекта от температуры для указанной реакции. Необходимые данные возьмите из справочника.
Решение:
Как известно, зависимость теплового эффекта от температуры дается уравнением Кирхгоффа:
DН = DН0 + DаТ + Db/2Т2 + Dc/3Т3 - Dc'/T.
Для определения Dа, Db, Dc и Dc' необходимо знать зависимость от температуры, выраженную уравнением:
Ср = а + bТ + сТ2 или Ср = а + bТ + c'/Т2
для исходных веществ и продуктов реакции.
Для нахождения DН0 необходимо зна4ь тепловой эффект реакции при какой-либо температуре, который обычно определяется на основании стандартных теплот образования соединений из простых веществ.
Необходимые для решения задачи данные берем из справочника:
| Вещество | DН298. 106 Дж/ кмоль | a*10-3 | B | c'*108 | с*103 | Температурный интервал |
| Дж/кмоль * град | ||||||
| Н2О(г) | -242,000 | 30,146 | 11,305 | - | - | 273-2000 |
| СН3СНОСН3(г) | -216,796 | 22,489 | 201,926 | - | -63,576 | 298-1500 |
| СО2 | -393,796 | 44,173 | 9,044 | -8,541 | - | 298-2500 |
| СН4 | -74,901 | 17,484 | 60,502 | - | - | 240-1500 |
ΔН298 = [ (ΔН298(Н2О) + ΔН298(СН3СОСН3)) – (ΔН298(СО) +
+2ΔН298(СН4))] = [(-242,00 – 216,796) – (393,796 – 2 . 74,901)]=
= 84,752 . 106 Дж/кмоль.
|
|
|
Согласно уравнению Кирхгофа:
ΔНт = ΔН0 + ΔаТ + Δb/2 . Т2 + Δс/3 . Т3 - Δс'/Т,
или:
ΔНт = ΔН298+ Δа(Т-298) + Δb/2(Т2 - 2982) + Δс/3(Т3 - 2983) –
- Δс'/(1/Т – 1/298).
Следовательно:
ΔН0 = ΔН298 - Δа . 298 - Δb/2 . 2982 - Δс/3 . 2983 + Δс'/298;
Δа = ∑а прод .реак. - ∑а исх. веществ = [ (30,146 + 22,489) –
- (44,173 + 2 . 17,484)] . 103 = - 26,512 . 103.
Δb/2 = ½(∑b прод .реак. - ∑b исх. веществ) = ½ . [(11,305 + 201,926)- (9,044 + 2 . 60,502)] = 41,591.
Δс/3 = 1/3 . (∑с прод .реак. - ∑с исх. веществ) = 1/3 . (-63,567 +2 . 1,118) . 10-3 =
= -61,340 . 10-3/3 = -20,446 .10-3.
Δс' = -(-8,541) . 108 = 8,541 . 108.
ΔН0 = 84752 . 103 + 26,512 . 103 . 298 – 41,591 . 2982 +
+21,934 . 10-3 . 2983 + 8,541 . 108/298 = 97486,4 . 103 Дж/кмоль
Зависимость теплового эффекта реакции от температуры выразится уравнением:
ΔНт = 97486,4 . 103 –26,512 . 103 . Т +41,591 . Т2 – 20,446 . 10-3 . Т3 – 8,541 . 108/Т.
ΔН500 = 97486,4 . 103 –26,512 . 103 . 500 +41,591 . 5002 –
– 20,446 . 10-3 . 5003 – 8,541 . 108/500 = 92179,4 . 103 Дж/кмоль.
Задача № 4.Рассчитать тепловой эффект при Т = 500 К образования газообразного ацетона из метана и оксида углерода.
Решение:
Зависимость теплового эффекта от температуры представлена уравнением Кирхгофа:
DН = DН0298 + Dа Т + Db/2 T2 + Dc/3 T3
Для определения Dа, Db, Dс необходимо знать зависимость теплоемкости от температуры для исходных веществ и продуктов реакции, выражаемую уравнением:
|
|
|
Ср = а + bТ + сТ2
Для нахождения Dа, Db, Dс необходимо знать тепловой эффект реакции при какой-либо температуре, который обычно определяется на основании стандартных теплот образования соединений из простых веществ по уравнению:
DН0298 = ∑ DН0298 (прод) - ∑ DН0298 (исх)
Из справочника берем данные, необходимые для решения задачи и сводим их в таблицу:
| Вещество | DН298 . 10-6 Дж/ Кмоль | а . 10-3 | B | с . 103 |
| Дж/кмоль . град | ||||
| Н2О | -242,000 | 30,146 | 11,305 | - |
| СН3СОСН3 | -216,796 | 22,489 | 201,926 | -63,576 |
| СО2 | -393,796 | 44,173 | 9,044 | - |
| СН4 | -74,901 | 17,484 | 60,502 | - 1,118 |
DН0298 = [DН0298 (Н2О) + DН0298 (СН3СОСН3)] - [DН0298 (С2О) + 2 +
+ DН0298 (СН4)] = [(- 242 – 216,796) – (393,796 – 2 . 74,901)] .
. 106 = 84,752 . 106 Дж / кмоль
DН0500 = DН0298 + Dа (500 - 298) + Db/2 (5002 - 2982) + Dс/3 (5003 –2983)
Dа = ∑ а (прод) - ∑ а (исх)
Db/2 = ½ (∑b (прод) - ∑ b (исх))
Dс/3 = 1/3 (∑с (прод) - ∑ с (исх))
Dа = [(30,146 + 22,489) – (44,173 + 2 . 17,484)] . 10- 3 = 26,512 . 10- 3
Db/2 = ½ [(11,305 + 201,926) – (9,044 + 2 . 60,502)] = 41,5
Dс/3 = 1/3 (- 63,5 + 2 . 1,118) . 10- 3 = - 20,4 . 10- 3
DН0500 = 84,75 . 103 + 26,5 . 103 (500 - 298) – 41,5 / 2 (5002 - 2982) +
+20,4 / 3 . 10- 3 (5003 - 2983) = 243,5 кДж/моль.
Задача № 5. Найти зависимость мольной температуры испарения жидкого этилового спирта от температуры в интервале 283 – 348оК при р = 1атм.
Р е ш е н и е. Процесс испарения жидкости можно рассматривать как реакцию, в которой исходное вещество – жидкость, продукт реакции – пар. Поскольку зависимость теплоты химической реакции от температуры в общем виде описывается уравнением (I.86)
 ,
,
то для решения поставленной задачи необходимо знать стандартные теплоты образования и коэффициенты температурной зависимости теплоемкости участников реакции



Находим изменение выписанных величин в результате испарения жидкости


Чтобы найти зависимость  по (I.86) надо знать константу интегрирования
по (I.86) надо знать константу интегрирования  . Ее можно найти, когда известна теплота реакции при любой другой температуре. В нашем случае известна теплота испарения при 298оК. Следовательно, из (I.87)
. Ее можно найти, когда известна теплота реакции при любой другой температуре. В нашем случае известна теплота испарения при 298оК. Следовательно, из (I.87)
 Отсюда зависимость мольной температуры испарения жидкого этилового спирта от температуры в рассматриваемом интервале определится как
Отсюда зависимость мольной температуры испарения жидкого этилового спирта от температуры в рассматриваемом интервале определится как

Задача № 6. Стандартная теплота реакции

протекающей в газовой фазе при 900оК, равна 260119 дж. Теплоемкости реагентов  (в дж/град*моль)
(в дж/град*моль)
800°К 1000°К
СН4 . . . . . . . . . . . . . . . . 63,18 72,00
СО2 . . . . . . . . . . . . . . . . 40,21 42,77
СО . . . . . . . . . . . . . . . . . 29,81 30,36
Н2 . . . . . . . . . . . . . . . . . . 28,96 29,15
Найти теплоту рассматриваемой реакции  , приняв, что средняя теплоемкость в интервале 800 – 1000оК равна
, приняв, что средняя теплоемкость в интервале 800 – 1000оК равна

Результат расчета сравнить с литературной величиной [19]  =259,491 дж.
=259,491 дж.
Р е ш е н и е. Находим изменение теплоемкостей в результате реакции

Изменение средних мольных теплоемкостей в результате реакции при 900оК

Если пользоваться средними теплоемкостями реагентов, то, согласно (I.89),
 .
.
Искомая теплота реакции

Задача № 7. Найти графическим путем теплоту реакции дегидрирования этилена при 1150оК , протекающей в газовой фазе в стандартных условиях
2С2H6 = 2CH4 + C2H2 + H2
если стандартная теплота этой реакции при 298оК равна 246387 дж, а зависимость теплоемкостей участвующих в реакции веществ от температуры выражается следующими данными (в дж/град*моль) [9].
 . . . . 298 400 500 600 700 800 900 1000 1100 1200
. . . . 298 400 500 600 700 800 900 1000 1100 1200
CH4 . . . . . 35,73 40,73 46,57 52,51 58,07 63,18 67,82 72,00 75,69 78,99
C2H2 . . . . . 43,93 50,08 54,26 57,44 60,12 62,47 64,64 66,61 68,41 70,04
H2 . . . . . . 28,83 29,16 29,24 29,29 29,45 29,62 29,87 30,21 30,58 30,96
С2H6 . . . .. 52,63 65,60 78,07 89,33 99,24 108,07 115,85 122,71 128,74 133,97
Р е ш е н и е. Определяем изменение теплоемкостей в результате реакции при заданных температурах.

298° К  = 2 · 35,73 + 43,93 + 28,83 – 2 · 52,63 = 38,95
= 2 · 35,73 + 43,93 + 28,83 – 2 · 52,63 = 38,95
400° К  = 81,50 + 50,08 + 29,16 –131,20 =29,54
= 81,50 + 50,08 + 29,16 –131,20 =29,54
500° К  = 93,14 + 54,26 + 29,24 – 156,14 = 20,50
= 93,14 + 54,26 + 29,24 – 156,14 = 20,50
600° К  = 105,02 + 57,44 + 29,29 – 178,66 = 13,09
= 105,02 + 57,44 + 29,29 – 178,66 = 13,09
700° К  = 116,14 + 60,12 + 29,45 – 198,48 = 7,23
= 116,14 + 60,12 + 29,45 – 198,48 = 7,23
800° К  = 126,36 + 62,47 + 29,62 – 216,14 = 2,00
= 126,36 + 62,47 + 29,62 – 216,14 = 2,00
900° К  = 135,64 + 64,64 + 29,87 – 231,70 = -1,55
= 135,64 + 64,64 + 29,87 – 231,70 = -1,55
1000° К  = 144,00 + 66,61 + 30,21 – 245,42 = - 4,60
= 144,00 + 66,61 + 30,21 – 245,42 = - 4,60
1100° К  = 151,38 + 68,41 + 30,58 – 257,48 = -7,11
= 151,38 + 68,41 + 30,58 – 257,48 = -7,11
1200° К  = 157,98 + 70,04 + 30,96 – 267,94 = - 8,96
= 157,98 + 70,04 + 30,96 – 267,94 = - 8,96
 |
Рис. 2 Графическое определение теплоты реакции
дегидрирования этана.
Сводим результаты расчета в таблицу:
 . . . . 298 400 500 600 700 800 900 1000 1100 1200
. . . . 298 400 500 600 700 800 900 1000 1100 1200
 . . . . . 38,95 29,54 20,50 13,09 7,23 2,00 - 1,55 - 4,60 - 7,11 - 8,96
. . . . . 38,95 29,54 20,50 13,09 7,23 2,00 - 1,55 - 4,60 - 7,11 - 8,96
На основании полученных данных строим график зависимости 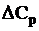 от температуры. Затем определяем площадь, ограниченную кривой
от температуры. Затем определяем площадь, ограниченную кривой  , ординатами T1 = 298°K и T2 = 1150°K , осью абсцисс (рис. 2).
, ординатами T1 = 298°K и T2 = 1150°K , осью абсцисс (рис. 2).
В соответствии с уравнением Кирхгофа теплота реакции равна

Дата добавления: 2018-02-15; просмотров: 4570; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
