Константы равновесия гетерогенной химической реакции.
Если какое-либо вещество находится в твердой или жидкой фазах, то его парциальное давление будет величиной постоянной и неизменной в ходе всего процесса.
Для реакции:
FeO(т) + CO(г) = Fe(т) + CO2(г),
 – гетерогенная константа
– гетерогенная константа
Н2(г) +  О2(г) = Н2О(ж);
О2(г) = Н2О(ж); 
Возможны случаи, когда только один реагент находится в газовой фазе:
СаCO3(т) = СаО(т) + CO2(г); Кр/ = 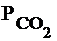
Рассмотрим определение константы равновесия в реальных условиях, когда газы и растворы отличаются от идеальных.
УРАВНЕНИЕ ИЗОТЕРМЫ ВАНТ-ГОФФА. ОПРЕДЕЛЕНИЕ НАПРАВЛЕННОСТИ ХИМИЧЕСКИХ ПРОЦЕССОВ ПО УРАВНЕНИЮ ИЗОТЕРМЫ
Как определять условия равновесия, когда парциальные давления исходных веществ и продуктов реакции отличаются от равновесных? Ответить на это вопрос поможет уравнение изотермы химической реакции. При известных ΔH реакции или при Δn ≠ 0 на химическое равновесие можно воздействовать изменением температуры или давления. Химическое равновесие может быть смещено изменением концентраций реагентов. Другими словами, равновесие можно сместить внешним воздействием, руководствуясь принципом Ле Шателье:
Если на систему, находящуюся в устойчивом равновесии, подействовать извне, изменяя какое-либо из условий, определяющих положение равновесия, то в системе усилится то из направлений, которое ослабляет влияние произведенного воздействия, и положение равновесия сместится в том же направлении.
1.Влияние температуры. Для реакций, идущих с уменьшением энтальпии (экзотермических), повышение температуры будет препятствовать протеканию прямого процесса, то есть смещать реакцию в сторону исходных веществ. Эндотермические реакции при этом будут смещаться в сторону конечных продуктов. Например, при обычных условиях реакция N2 + O2 не идет (ΔH > 0), но повышение температуры может сделать эти реакцию осуществимой. Реакция CO + 1/2O2 = CO2, ΔH < 0 с повышением температуры будут смещаться в сторону исходных веществ.
2. Влияние давления.Если реагируют газообразные вещества, то при неизменном числе молей начальных и конечных реагентов повышение общего давления не приведет к смещению равновесия. Если число молей при реакции меняется, то изменение общего давления приведет к смещению равновесия. В частности, реакция 2CO + O2 = 2CO2, протекающая с уменьшением Δn, при повышении общего давления сместится в сторону образования СO2.
3. Влияние концентраций. В тех реакциях, в которых лучше оперировать концентрациями (реакции в растворах), увеличение концентраций исходных веществ приводит к смещению равновесия в сторону конечных продуктов и наоборот. Так, в реакции этерификации (образование сложного эфира)
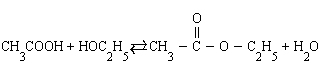
|
увеличение концентрации уксусной кислоты или этанола увеличивает выход этилацетата, а добавление в систему воды приводит к омылению, т. е. образованию исходных продуктов.
Так, повышение температуры экзотермических реакций способствует увеличению количества исходных веществ, а рост температуры эндотермических реакций приводит к обогащению продуктами реакции по сравнению с равновесным состоянием до изменения температуры.
Повышение температуры приводит к смещению равновесия в сторону эндотермической реакции; повышение давления – в сторону веществ, занимающих меньший объем.
Однако более качественно оценить влияние различных факторов на химическое равновесие можно с помощью уравнений изотермы, изобары и изохоры химической реакции.
Рассмотрим реакцию:
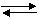 аА + вВ сС + dD
аА + вВ сС + dD
и обозначим через РА/, РВ/, РС/, РD/ неравновесные парциальные давления реагирующих веществ.
Условием равновесия для изобарно-изотермического процесса является следующее:
dG = 
DG = (сmС0 + dmD0 – аmA0 – вmВ0) + RT(сlnPC/ + dlnPD/ –
– alnPA/ – вlnPB/) (3.1.1)
Первое слагаемое правой части уравнения (3.1.1) равно
– RTlnКр, а второе слагаемое –
сlnPC/ + dlnPD/ – alnPA/ – вlnPB – 
DG = -RTlnKp + RT 
Изменение энергии Гиббса, определяемое условием:
DG = 
в отсутствии равновесия равно:
 (3.1.2)
(3.1.2)
По аналогии для энергии Гельмгольца получим:
 (3.1.3)
(3.1.3)
Уравнения (3.1.2) и (3.1.3) называются уравнениями изотермы химической реакции.
Проведем анализ этих уравнений.
В начале химической реакции, когда
РВ/ > РВ; РА/ > РА; РС/ > РС; РD/ > РD
lnKp =  >
> 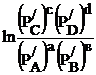
DG < 0, т.е. реакция пойдет самопроизвольно слева направо.
В условиях равновесия, когда Р/ = Р
lnKp = 
DG = 0, т.е. в условиях равновесия отсутствует изменение энергии Гиббса.
Если парциальные давления продуктов реакции превышают равновесные значения, т.е.
РВ/ < РВ; РА/ < РА; РС/ > РС; РD/ > РD,
получим: lnKp = 
lnKp <  ,
,
т.е. DG > 0.
Энергию Гиббса при стандартных условиях (химическое сродство) можно выразить уравнением:
 ,
,
когда РА/ = РВ/ = РС/ = РD/ = 1 атм для газов,
где  – стандартное химическое сродство. Т = 298,16 К.
– стандартное химическое сродство. Т = 298,16 К.
По аналогии химическое сродство для изохорно-изотермического процесса можно выразить через энергию Гельмгольца:

По величине химического сродства можно определить константы равновесия:
Кр =  ; КС =
; КС = 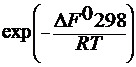
Уравнения изобары и изохоры химических реакций характеризует зависимость константы равновесия от температуры.
Дата добавления: 2018-02-15; просмотров: 1305; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
