Лечение при аэробной гнойной инфекции
Лечение при гнойной инфекции должно быть комплексным и соответствовать стадии развития гнойного воспаления с учетом нормергического, гиперергического или гипоэргического его проявления, а также биологических особенностей возбудителя. Независимо от стадии развития гнойно-инфекционного процесса комплекс лечебных мер должен включать: а) местные и общие антипатогенетические воздействия на больного животного, основанные на принципе охранительной терапии; б) противомикробные и антитоксические воздействия, направленные на подавление микробного фактора и удаление токсических продуктов из патологического очага и из организма; в) оперативное или консервативное удаление мертвых тканей, которое, так же как и дезинтоксикация организма, влияют на течение инфекционного процесса; г) меры симптоматического воздействия, направленные на улучшение функционального состояния того или иного жизненно важного органа; д) витаминотерапию и полноценное кормление при сбалансированном ощелачивающем рационе; е) дозированный моцион и более широкое применение физиотерапевтических процедур на стадии выздоровления.
Консервативное лечение. В начальных стадиях развития гнойной инфекции (стадии воспалительного отека и клеточковой инфильтрации) целесообразна короткая блокада 0,25%-ным раствором новокаина в сочетании с гидрокортизоном и одним или двумя антибиотиками, например с натриевой (калиевой) солью бензилпенициллина, и стрептомицинсульфатом либо с мономицином или с канамицином, но эффективнее с гентамицином. Раствор вводят вокруг развивающегося инфекционного очага и по возможности под него. На инфицированный очаг накладывают спиртовысыхающие повязки или спиртовые согревающие компрессы, используя 70%-ный этиловый, ихтиоловый, камфорный спирт, и организуют другие тепловые процедуры.
|
|
|
На стадии воспалительного отека такое лечение предупреждает перераздражение нервных центров, нормализует воспалительную реакцию, трофику, повышает активность физиологической системы соединительной ткани, способствует фиксации, локализации и подавлению возбудителей. В результате этого начавшийся инфекционный процесс нередко обрывается и наступает выздоровление.
На стадии клеточной инфильтрации, как и на стадии абсцедирования, целесообразно дополнительно внутримышечно применять антибиотики широкого спектра действия. Особого внимания заслуживают внутривенные введения 0,25%-ного новокаина с соответствующим антибиотиком или сульфаниламидом. Более эффективны внутриартериальные введения их в магистральную артерию, доставляющую с кровью введенный раствор непосредственно в инфекционный очаг (глубокая антисептика).
|
|
|
Некоторые авторы рекомендуют применять при этих стадиях и даже на стадии абсцедирования местную гипотермию. Но это допустимо лишь на стадии воспалительного отека и притом кратковременно в виде наложения резинового пузыря со снегом или толченым льдом на 10—15 мин, 2—3 раза, с такими же перерывами, либо на такой же срок накладывают охлаждающие повязки. Допустимо орошать зону инфицированного очага хлорэтилом через легкую бинтовую повязку или марлевую салфетку в течение 20— 30 с при передвижении струи со скоростью 1—2 см в 1 с. Процедуру повторяют 2—3 раза с интервалом 1—1,5 ч. Местная гипотермия уменьшает боль, предупреждает чрезмерную проницаемость сосудов, снижает отек и внутритканевое давление. Однако при длительном применении она понижает фагоцитарную реакцию, способствует некротизации и активизации возбудителя. Поэтому мы рекомендуем применять ее осторожно и только на стадии отека при фурункулезе и быстро прогрессирующих воспалительных отеках (гиперергическое развитие острогнойного воспаления).
Описанный комплекс лечения на стадии клеточной инфильтрации нормализует в инфекционном очаге трофику, активирует физиологическую систему соединительной ткани, фагоцитоз и ферментолиз, обеспечивает формирование клеточного барьера, предупреждает генерализацию, снижает и даже подавляет активность возбудителя. Инфекционный процесс купируется и приобретает благоприятное течение.
|
|
|
На стадии абсцедирования целесообразны также короткая новокаиновая блокада, спиртовысыхающие повязки, внутривенные и внутриартериальные введения антибиотиков и сульфаниламидов на 0,25%-ном растворе новокаина, облучение лампами соллюкс, Минина, но недопустимо применять согревающие компрессы, особенно припарки, горячие ванны, парафиновые и озокеритовые аппликации. Использование их допустимо лишь на стадии клеточковой инфильтрации преимущественно при анергической воспалительной реакции. Такие тепловые процедуры, особенно при гиперергическом воспалении, усиливают отек и внутритканевое давление, в результате чего ухудшается кровообращение и лимфоотток, расширяется зона некроза, создаются условия для проникновения гноя и возбудителя в здоровые ткани или анатомические полости.
На стадии сформировавшегося абсцесса его вскрывают, при накоплении гноя в анатомических полостях целесообразно систематически делать пункции с целью эвакуации гноя из закрытых анатомических полостей (плеврит, синовит, артрит, тендовагинит и др.). Эвакуацию гнойного экссудата необходимо сочетать с промыванием гнойных полостей растворами фурацилина (1 :5000), сульфаниламидами (альбуцид, норсульфазол и др.), антибиотиками (мономицин, канамицин, гентамицин). После эвакуации гноя и тщательного промывания целесообразно ввести в гнойную полость в небольшом объеме 2—3%-ный раствор новокаина с упомянутыми антибиотиками. В ряде случаев при нормергическом течении гнойного процесса такое лечение можно заменить оперативным вмешательством; при гиперергическом течении, с выраженными явлениями гнойно-резорбтивной лихорадки, необходимо возможно раннее оперативное вмешательство в сочетании с противосептической терапией (см. «Сепсис»).
|
|
|
Оперативное лечение. Прямыми показаниями к оперативному вмешательству при гнойной инфекции являются: а) наличие сформировавшегося абсцесса или флегмоны; б) накопление гноя в анатомических полостях и невозможность или неэффективность аспирации его; в) наличие ниш, карманов и гнойных затеков в межмышечные и другие соединительнотканные пространства при недостаточности дренирования из них гнойно-некротических масс; г) прогрессирующие некрозы, лимфангоиты, наличие костных секвестров, инородных тел.

Рис. 17. Проявление гнойной инфекции

Рис. 18. Проявление гнойной инфекции

Рис. 19. Проявление гнойной инфекции

Рис. 20. Проявление гнойной инфекции
Подготовка к оперативному вмешательству осуществляется по общим правилам. Затем делают по типу короткой новокаиновой блокады инфильтрационное обезболивание 0,5—1%-ным раствором новокаина с антибиотиком широкого спектра действия; при необходимости сочетают с релаксантами.
За 12—24 ч до оперативного вмешательства вводят внутривенно 10%- ный раствор кальция хлорида в целях повышения свертываемости крови и улучшения сердечной деятельности.
При общей слабости, обусловленной гнойно-резорбтивной лихорадкой, внутривенно вводят 20%-ный раствор глюкозы с аскорбиновой кислотой и внутримышечно — витамины группы В. За 2— 3 ч до операции, а затем в течение 10—12 дней задают внутрь метилурацил, улучшающий защитные реакции и лейкопоэз.
Перед вскрытием гнойных полостей целесообразно удалить из них с помощью инъекционной иглы возможно больше гноя и ввести в их полость новокаинфурацилиновый раствор с целью понизить активность микробов, через несколько минут проводят операцию.
Операцию следует проводить в резиновых перчатках, соблюдая правила асептики и антисептики.
Разрезают ткани так, чтобы при минимальных повреждениях мышц, сосудов и нервов был обеспечен наиболее свободный выход для экссудата. На конечностях ткани рассекать целесообразно по межмышечным желобам. При этом после рассечения кожи, общих и частных фасциальных «футляров» проникают тупым путем под соответствующую мышцу и, не повреждая последней, обеспечивают выход гноя наружу. При накоплении гноя в фасциальных «футлярах», окутывающих отдельные мышцы конечностей, разрезы следует производить на месте перехода мышечного брюшка в сухожилие. В случаях затоков гноя в заднебедренное межмышечное соединительнотканное пространство разрезы следует делать в зоне перехода апоневроза двуглавой мышцы бедра, а при затеке гноя в поверхностное переднебедренное соединительнотканное пространство рассекают ткань ниже перехода напрягателя широкой фасции бедра в апоневроз. Рассечение апоневрозов двуглавого, полуперепончатого, полусухожильного и грациозного мускулов позволяет проникать в различные участки заднебедренного соединительнотканного пространства и обеспечить сток для скопившегося в них гноя. Такие разрезы позволяют вскрывать глубокие гнойные очаги без повреждения крупных сосудов и нервов. Иногда для лучшего стока экссудата приходится, кроме апоневроза, рассекать мышцу, которая переходит в него. У рогатого скота разрезы необходимо делать значительно больших размеров, чем у лошади и собак, так как у них операционная рана вследствие выраженной пролиферативной реакции довольно быстро уменьшается, в то время как в глубине вскрытого инфекционного очага все еще продолжаются нагноительные процессы. Если не удается точно установить положение гнойного очага, расположенного в толще тканей, то вскрывать его нужно в месте максимальной болезненности.
После вскрытия полости и удаления гнойного содержимого производят ревизию полости, устанавливают самую низкую ее часть и, если необходимо, удлиняют первоначальный разрез или делают контрапертуру, чтобы обеспечить свободный сток для гнойного экссудата.
Завершение оперативного вмешательства должно включать остановку кровотечения, создание условий наилучшего дренирования очага инфекции и последующего введения в него антибиотиков или других средств подавления инфекта.
Дренирование открытых гнойных очагов необходимо, если после операции остались мертвые ткани, ниши и карманы, которые нельзя устранить оперативным путем по анатомическим соображениям (опасность повреждения крупных сосудов, нервов анатомических полостей и пр.).

Рис.21Схема дренирования гнойной полости резиновой трубкой с отверстиями
Для дренирования следует применять марлевые дренажи, пропитанные одним из гипертонических 5—10%-ных растворов средних солей с добавлением перекиси водорода до 3% либо хлорамина до 2%, марганцовокислого калия до 0,5%, фурацилина 1 :5000, для ускорения секвестрации мертвых тканей добавляют йода до 1 : 500—1 : 1000, скипидара до 4%. Заслуживают применения 15—20%-ные растворы мочевины, линименты синтомицина и А. В. Вишневского. При наличии большого количества мертвых тканей дренирование осуществляют с желудочным соком, лучше трипсином и трипсиноподобными ферментами или мазью Ируксола. Перед введением дренажей необходимо остановить кровотечение и выстлать рану марлевой салфеткой по Микуличу, обильно пропитанной 96%-ным этиловым спиртом. Под влиянием его суживаются капилляры лимфатических, артериальных и венозных сосудов, уменьшается всасывание экссудата при одновременном антисептическом воздействии на микробный фактор. Через 10—15 мин после такой обработки приступают к дренированию. Марлевые дренажи, смоченные одним из перечисленных растворов, рыхло вводят в каждую нишу или карман до дна. Целесообразнее применять более широкие дренажи, узкие хуже дренируют и скорее теряют дренажные свойства. В горловине раны дренажи должны располагаться свободно, иначе они плохо дренируют. Правильно примененные марлевые дренажи выполняют отсасывающую роль и улучшают течение вскрытого инфекционного очага или инфицированной раны и способствуют подавлению возбудителя. Марлевые дренажи действуют несколько часов, затем их следует удалить, так как они начинают препятствовать выведению экссудата.
Показания к удалению дренажа: а) наружный конец стал сухим; б) полость вскрытого очага или раны переполнена гноем; в) возникает ухудшение состояния животного и повышается общая температура. У рогатого скота, кроме этого, показанием к удалению дренажа служит обильное выпадение фибрина, который обтурирует выходное отверстие. В связи с такой реакцией рогатого скота на дренаж последний целесообразно смачивать фибринолизирующими растворами (желудочный сок, аллонтоин, фибринолизин, 5—10%-ный раствор тиомочевины и др.).
Первую перевязку и извлечение дренажа необходимо производить через 24—48 ч после операции. В дальнейшем смену дренажа производят с учетом указанных признаков нарушения дренирования. Извлекают дренажи с соблюдением правил асептики и антисептики без травмирующих манипуляций. Грубо сделанная перевязка иногда приводит к рецидиву и генерализации возбудителя. Трудно извлекаемые дренажи необходимо удалять последовательно, вначале дренаж, расположенный в центральной части раны, затем краевые. Удаляют их после длительного орошения подогретыми до 40° растворами перекиси водорода, 2%-ного хлорамина, двууглекислого аммония той же концентрации.
В тех случаях, когда после вскрытия и удаления мертвых тканей полость инфицированного очага содержит относительно мало мертвого субстрата, целесообразно применять марлевый дренаж, пропитанный линиментом А. В. Вишневского на рыбьем жире. Набухшие под его влиянием мертвые ткани подвергаются ферментативному расщеплению.
В последующем, когда гнойный очаг или рана очистится от мертвых тканей, применяют линимент А. В. Вишневского на касторовом масле, который способствует отбуханию тканей, защищает их от сильных раздражений, благоприятно влияет на трофику и рост грануляций.
Б. Ф. Сметанин установил, что обильно пропитанный масляно-антисептический дренаж А. В. Вишневского обладает ничтожной капиллярностью, однако по мере стекания со свободного конца линимента его капиллярность нарастает и создаются условия тока раневого содержимого в повязку по типу крупнокапиллярного сифона. Кроме того, будучи антисептическим, дренаж А. В. Вишневского препятствует всасыванию в организм ядовитых продуктов из инфицированного очага продуктов тканевого распада и токсинов микробов.
В тех случаях, когда нужно длительно орошать вскрытый инфицированный очаг, применяют дренажи из резиновой или синтетической эластической трубки необходимой длины, диаметром 3— 8 мм. Один из концов трубки косо срезают и закругляют острые края среза. Затем ножницами вырезают в стенке погружаемой части трубки небольшие оконца так, чтобы они располагались со всех сторон трубки. Противоположный конец трубки рассекают вдоль на небольшом протяжении. Конец с вырезами осторожно вводят в полость до ее дна, а рассеченные части загибают и заводят в горловину полости или раны так, чтобы они упирались в стенки и фиксировали дренаж. При этом наружный конец дренажа должен выходить за пределы полости на несколько сантиметров. Если наружный конец дренажной трубки не рассечен, то его подшивают к повязке или к краям кожи. Через дренаж систематически орошают полость антисептическими растворами, линиментами. При наличии карманов желательно дренажную трубку ввести в каждый из них.
Трубчатые дренажи извлекают через 5—6 дней или по мере их закупорки. Промытые и прокипяченные, они могут быть введены в полость. При необходимости дренажи можно оставлять в полостях мягких тканей (но не в суставах и сухожильных влагалищах) до заполнения последних грануляциями. В таких случаях дренажи постепенно извлекают и укорачивают. Необходимо учитывать, что трубчатые дренажи могут давить на ткани полостей, вызывать пролежни (некроз), особенно при нарушенной трофике. Поэтому резиновые и синтетические трубки должны обладать максимальной эластичностью и достаточной сопротивляемостью к сдавливанию.
Применение трубчатых дренажей противопоказано, если в стенке гнойной полости проходят сосудисто-нервные пучки или наблюдается легкая ранимость грануляций.
Рану с дренажем оставляют открытой или на нее накладывают повязки с целью защиты от загрязнений, раздражении и для усиления отсасывания экссудата и антисептизации. Повязки, пропитанные гипертоническими растворами, усиливают дренирование, а систематическое смачивание их антисептическими растворами и антибиотиками обеспечивает антисептизацию инфекционного очага и кожного покрова. Повязки, накладываемые на дистальные части конечностей (копыта), целесообразно пропитывать дегтем пополам с вазелиновым или растительным маслами.
Как только инфицированная рана освободится от мертвых тканей, покроется нормальными грануляциями и уменьшится отделение гноя, дренирование следует прекратить. Появление нормальных грануляций указывает на ликвидацию инфекционного процесса. Поэтому дальнейшее применение антисептических средств, сульфаниламидов, антибиотиков и гипертонических растворов нецелесообразно (см. лечение ран).
Применение антибиотиков при хирургической инфекции.
К настоящему времени установлено, что необоснованное применение антибиотиков, несмотря на их исключительное терапевтическое и профилактическое значение, приносит больше вреда, чем пользы. Так, длительное применение антибиотиков внутрь может привести к дисбактериозу в желудочно-кишечном тракте, особенно у рогатого скота, и возникновению устойчивых микробов. Безусловным показанием к их применению являются: прежде всего сепсис; закрытые гнойно-некротические очаги, сопровождающиеся выраженными признаками гнойно-резорбтивной лихорадки, а также инфекционные поражения анатомических полостей; анаэробная инфекция; актиномикоз и некоторые другие грибковые инфекции.
Раннее применение антибиотиков с учетом чувствительности к ним возбудителя инфекции позволяет достигнуть высокой терапевтической эффективности. Она еще более повышается, если предварительно провести хирургическую обработку раны и дренирование ее, а также после аспирации гноя из закрытых полостей и тщательного промывания их (см. ниже). Эффективность антибиотика значительно возрастает, если внутримышечно ввести 0,5%-ный продигиозан (мелким животным 10—15 мкг, крупным—250— 300 мкг), который активирует неспецифический и специфический иммунитет и образование интерферона. Продолжительность введения антибиотиков должна быть тем дольше, чем тяжелее инфекционный процесс. Оптимальная концентрация антибиотиков в инфицированном очаге достигается при введении их в регионарные артерии. Однако нужно иметь в виду, что слишком высокая концентрация антибиотиков в организме угнетает тканевое дыхание, затормаживает репаративные процессы и снижает естественный иммунитет, особенно при их длительном применении. Недопустимо вводить заниженные дозы антибиотиков, так как это способствует появлению устойчивых рас микробов. Длительное применение какого-либо антибиотика или сочетаний их может способствовать развитию суперинфекции. Чтобы не допустить этого, следует менять антибиотики через 5—7 дней и более, с учетом микробиологического контроля перед их сменой. При стафилококковой инфекции и неизвестном возбудителе целесообразно применять полусинтетические пенициллины (оксациллин или метициллин, фузидин) с антибиотиком, действующим на грамотрицательную флору (ампициллин, мономицин, канамицин, гентамицин). Наиболее активными антибиотиками по отношению к синегнойной палочке являются полимексин, канамицин, особенно гентамицин и карбенициллин и их сочетания. При местной и общей инфекции, вызванной кишечной палочкой и протеем, более эффективными являются комбинации ампициллина с левомицетином, канамицином или колистином.
Профилактика появления антибиотикоустойчивых микроорганизмов. Широкое применение антибиотиков в ветеринарии с лечебной целью без достаточного врачебного контроля и строгих показаний, а также включение их в премиксы и использование в качестве стимуляторов роста при откорме животных привело к возникновению стойких рас микроорганизмов к применяемым антибиотикам. Кроме того, у крупного рогатого скота антибиотики вызывают ареактивность и значительно подавляют регенеративно-восстановительные процессы.
Учитывая изложенное, необходимо антибиотики с лечебной целью применять при строгом ветеринарном контроле. Необходимо подбирать антибиотики с учетом чувствительности к ним инфекта, вызвавшего инфекцию; использовать оптимальные дозы и пути введения, обеспечивающие высокую терапевтическую концентрацию антибиотиков в организме и инфицированном очаге; сочетать антибиотикотерапию с сульфаниламидотерапией и витаминотерапией. Недопустимо бесконтрольное использование антибиотиков как стимуляторов роста животных.
Определение чувствительности микробов к антибиотикам методом «бумажных дисков» наиболее доступно для практических целей. В стерильные чашки Петри диаметром 10—11 см наливают по 20 мл агаровой питательной среды с рН 7,1—7,3. Можно взять и 2%-ный мясо-пептонный агар, а также 1%-ный или 2%-ный агар на переваре Хоттингера, содержащий 110—130 мг% аминного азота. Для получения равномерного «бактериального газона» в чашки Петри с застывшим агаром наливают 1 мл двухмиллиардной суспензии испытуемой культуры (по бактериальному стандарту). Жидкость равномерно распределяют по агару покачиванием чашки Петри. Избыток жидкости отсасывают пастеровской пипеткой, затем чашки подсушивают; в них можно высевать гной и пр. Испытуемый материал равномерно распределяют стерильным ватным тампоном или шпателем. На поверхность засеянного агара стерильным пинцетом накладывают по одному «бумажному диску» четырех испытуемых антибиотиков на равном удалении друг от друга и 2 см от стенки чашки. Каждый «бумажный диск» обозначают начальной буквой испытуемого антибиотика. Чашки Петри с бумажными дисками выдерживают при комнатной температуре в течение часа, затем вкладывают под крышку кружок стерильной фильтровальной бумаги или перевертывают чашки и помещают их в термостат с температурой 37° на 16—18 ч.
Зону задержки роста микробов определяют с помощью линейки или миллиметровой бумаги, которыми измеряют диаметр зон роста микробов вокруг дисков. Отсутствие зон задержки роста микробов указывает на устойчивость их к данному антибиотику; наличие зоны задержки роста в диаметре 15 мм означает малую чувствительность микроба к антибиотику, более 24 мм — высокую чувствительность. Описанный метод дает 80% совпадений в сравнении с клиническими результатами лечения. Несмотря на неполное совпадение, метод позволяет более правильно подобрать антибиотик и предупреждать образование устойчивых рас микробов.
Применение сульфаниламидов и производных нитрофурана при хирургической инфекции.Сульфаниламиды эффективны при грамположительных микробах. Целесообразно применять также растворимые в воде препараты пролонгированного действия, такие, как натриевая соль сульфапиридозина, сульфадиметоксин, этазол-натрий, сульфацил-натрий. Эти препараты вводят внутривенно в виде 5—10%-ного раствора в дозе 0,5—2 мл 3—4 раза в сутки при курсе лечения 8—10 дней. Их применяют, когда возбудитель нечувствителен к антибиотикам, а также при сравнительно нетяжелом течении инфекции. Во всех других случаях их целесообразно сочетать с антибиотиками. Заслуживает внимания местное применение стрептоцида и других растворимых сульфаниламидов в виде орошении и присыпок. Однако в чистом виде они вызывают асептический некроз грануляций, поэтому их вводят в сложные бактериостатические порошки.
Эффективны при хирургической инфекции производные нитрофурана. Препараты данной группы обладают широким спектром антимикробного действия. Они активны по отношению грамположительных микробов, простейших и патогенных грибков, резистентных к антибиотикам и некоторым сульфаниламидам. Устойчивость микробов к ним развивается очень медленно. Заслуживает особого внимания солафур (растворимый фурагин) при внутривенном введении в виде 0,1%-ного раствора по 50—100 мл в течение 30—40 мин (собакам), на курс лечения 7—10 введений.
Активизация защитных сил организма. Антибиотики, сульфаниламиды, производные нитрофурана и другие противомикробные средства подавляют жизнедеятельность микробного фактора. Это улучшает течение болезни. Однако окончательно ликвидирует инфекционное начало сам организм. Но инфекционный процесс, сопровождающийся гнойно-резорбтивными явлениями, нередко значительно снижает защитные механизмы организма, способствуя активации инфекционного начала. Одновременно с этим могут исчерпываться и терапевтические возможности противомикробных средств. Именно поэтому целесообразно мобилизовать резервы неспецифической иммунологической реактивности больного организма. К средствам, повышающим неспецифическую иммунобиологическую активность, относят АКТГ и кортикостероиды, продигиозан, производные пиримидина (метилурацил, пентоксил), активирующие иммунологические реакции; фагоцитоз и регенеративно-восстановительные процессы; липосахариды — сложные соединения преимущественно грамотрицательных микробов (пирогенал, пирексаль и пиромен).
Стимулируют защитные механизмы организма и фракционные переливания небольших количеств совместимой крови, обменная гемотрансфузия и аутогемотерапия. Сюда же следует отнести применение гамма-глобулинов и витаминов. Для создания активного иммунитета используют специфические вакцины, сыворотки, анатоксин и бактериофаг. Большого внимания заслуживает гипериммунная стафилококковая плазма. Она эффективна и при стафилококковом сепсисе (Скуркович и др., 1971).
Абсцесс, или нарыв (гнойник),—ограниченная патологическая полость, заполненная гноем, возникшая вследствие пространственно локализованного острого гнойного, чаще инфекционного, воспаления рыхлой клетчатки, реже других тканей и органов. Следует отличать абсцессы от эмпиэм, которые являются следствием скопления гноя в анатомических полостях и полых органах.
Этиология. Абсцессы возникают в результате внедрения в ткани гноеродных микроорганизмов, чаще стафилококков, стрептококков, палочки синего гноя, кишечной палочки, криптококков, туберкулезной палочки, актиномицет и других грибов, а также под влиянием различных химических веществ—скипидара, керосина, кротонового масла и пр.
Абсцессы бывают острые, подострые и хронические, асептические, инфекционные, поверхностные и глубокие, доброкачественные и злокачественные, метастатические, холодные и натечные. В зависимости от стадии развития различают абсцессы формирующиеся, или созревающие, и созревшие.
Поверхностные созревшие абсцессы легко диагностируются и легче протекают, дают меньше осложнений, нередко заживают после самопроизвольного вскрытия. Подкожные абсцессы могут возникать при глубоких гнойно-некротических процессах (артрит, остеомиелит).
Глубокие абсцессы труднее диагностируются, протекают тяжелее, чаще осложняются в результате прорыва гноя в ткани или анатомические полости, либо инкапсулируются, нередко превращаясь в очаги «дремлющей» инфекции. Ослабление защитных сил организма, механические и другие повреждающие воздействия, а также оперативные вмешательства способствуют выходу инфекта за пределы инкапсулированного абсцесса и вспышке «дремлющей» инфекции, заканчивающейся иногда сепсисом. Небольшие инкапсулированные абсцессы могут оставаться незамеченными и мало или совсем не сказываются на общем состоянии и продуктивности животного.
Доброкачественные абсцессы характеризуются совершенной локализацией инфекционного очага, полноценным грануляционным барьером и подавлением инфекта при минимальной зоне некротизации. Формируются такие абсцессы в течение 5—7 дней обычно на фоне нормергического воспаления, при ограниченном отеке тканей. Из вскрытого доброкачественного абсцесса изливается густой желтоватый гной со специфическим сладковато-кислым запахом. Дно и стенки абсцесса выстланы грануляционной (пиогенной) оболочкой розового или красного цвета, мертвые ткани отсутствуют, все они лизированы. Гной содержит живые лейкоциты, он ареактивен, микробы лизированы, а оставшиеся целыми плохо прокрашиваются, при посеве на питательные среды роста не дают. Инъецированный под кожу, такой гной действует но тину вакционо- и протеинотерапии.
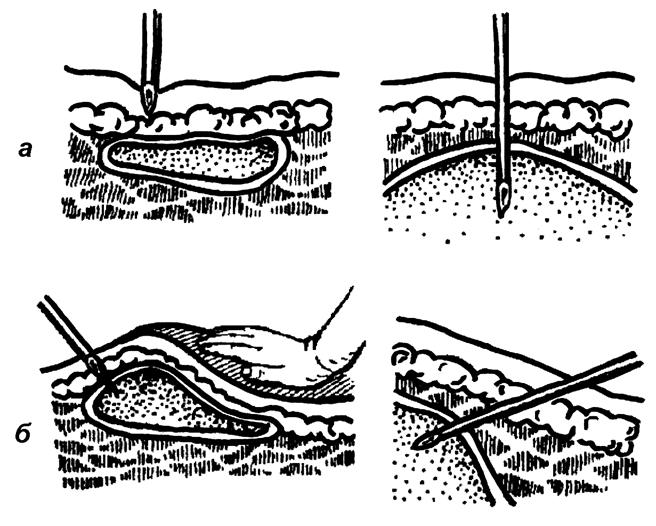
Рис. 22 Приемы проколов острых абсцессов:
а –неправильный; б – правильный
В ряде случаев доброкачественные абсцессы принимают хроническое течение и инкапсулируются, что наблюдается чаще у рогатого скота и свиней.
Злокачественные абсцессы характеризуются тенденцией к генерализации, разлитым болезненным горячим отеком, прорывом гноя за пределы неполноценного, замедленно формирующегося грануляционного барьера; возможно развитие флегмоны. Такие абсцессы возникают при наличии вирулентных микробов и выраженной гиперергической, воспалительной реакции. Гной в них содержит мертвые лейкоциты, он грязно-бурый, жидкий, зловонный, иногда имеется газ, много вирулентных микробов и небольшое количество живых лейкоцитов. Введение в ткани такого гноя сопровождается развитием инфекции. Стенки и дно злокачественного абсцесса состоят из мертвых тканей, грануляционный барьер (пиогенная оболочка) не сплошной, грязно-бурого цвета, с признаками некроза, имеются ниши и карманы. Злокачественные абсцессы в большинстве случаев бывают острым, горячими, реже—хроническими, холодными. Примером последних служит туберкулезный абсцесс.
Холодный абсцесс отличается хроническим течением, замедленным созреванием; отсутствуют или слабо выражены признаки воспаления; местная температура и боль незначительные. Формирование таких абсцессов протекает на фоне гипоэргической воспалительной реакции. Стенки и дно холодного абсцесса покрыты грибовидными синюшными грануляциями с явлениями некроза иизъязвления. После самопроизвольного вскрытия абсцесса из него длительно выделяется гной и формируется свищ.
Холодные микотические абсцессы (см. «Актиномикоз», «Актинобациллез»).
Натечный абсцесс является разновидностью холодного абсцесса. Он обычно формируется за счет гноя из существующего холодного абсцесса, проникающего по ходу сосудов и нервов в межмышечные, подфасциальные и другие соединительнотканные пространства, при выраженной ареактивности животного, чаще при алиментарном истощении. У овец натечные абсцессы наблюдаются при бруцеллезе, у лошадей—при затянувшихся абсцессах и флегмонах, у коров — при туберкулезе.
Метастатические абсцессы, как правило, протекают остро, они образуются в различных частях тела вследствие переноса микробов кровью и лимфой из первичного очага в паренхиматозные органы, кишечник, желудок, в мозг и даже сердечную стенку. Наличие метастатических абсцессов чаще наблюдается при сепсисе с метастазами.
Скипидарный абсцесс относится к асептическим, доброкачественным. Он формируется под влиянием инъекции скипидара под кожу или в мышцы. У животных, не имеющих инфекционных процессов, гной скипидарного абсцесса безмикробный, а при наличии общей или местной инфекции в нем накапливаются микроорганизмы. Поэтому скипидарный абсцесс называют еще фиксационным. В процессе его формирования микроорганизмы, находящиеся в крови и тканях, концентрируются, как бы фиксируются в нем, и гибнут под влиянием скипидара, повышенной фагоцитарной активности лейкоцитов, клеток физиологической системы соединительной ткани и ферментов гноя. Учитывая сказанное, скипидарные абсцессы издавна использовались в ветеринарии с лечебной целью. Для этого под кожу подгрудка инъецируют несколько кубических сантиметров скипидара.
Макроскопическая и микроскопическая характеристика гноя имеет большое значение, так как позволяет ориентировочно определить вид микроорганизма, вызвавшего нагноение. С учетом этого ориентировочно можно подобрать соответствующий антибиотик, уточнив затем правильность выбора дисковой пробой чувствительности к нему микробов, содержащихся в гнойном экссудате.
Гной состоит из сыворотки и огромного количества преимущественно нейтрофильных лейкоцитов, в большей своей массе погибших в процессе фагоцитоза, под влиянием токсинов микробов и продуктов гистолиза. В гнойной сыворотке содержится большое количество преимущественно протеолитических ферментов, белков и разнообразных продуктов тканевого распада (пептоны, аминокислоты, кетоновые тела, жирные кислоты и пр.). У лошадей, как правило, а у собак всегда в сыворотке гноя нет фибрина, а у рогатого скота и свиней содержится небольшое количество фибриногена, который превращается в фибрин, выпадающий в виде сетки на стенках формирующейся гнойной полости.
Стафилококковый гной у всех животных густой, бело-желтый или желтый, сливкообразной или сметанообразной консистенции, со специфическим кисловатым запахом. У рогатого скота и свиней он может содержать хлопья фибрина. У кроликов гной густой, белый или бело-желтый, как сгущенная сметана; у птиц—сыровидный, серо-белого цвета.
Стрептококковый гной обычно неприятного запаха, жидкой консистенции, серовато-желтый или серовато-бурый, с примесью небольшого количества мертвых тканей, прожилок крови и отдельных хлопьев фибрина. При гемолитическом стрептококке гной жидкий, желтоватого цвета, с кровянистым оттенком и прожилками крови; у рогатого скота и свиней, в нем встречаются примеси фибрина.
Гной при внедрении кишечной палочки жидкий, зловонный, коричневого цвета; синегнойной палочки—густой, бледно-зеленого или серо-зеленого цвета; некротизированные ткани и хрящи окрашиваются в изумрудно-зеленый цвет.
При туберкулезном абсцессе гной жидкий, содержит хлопья и творожистые массы, при бруцеллезном — гнойно-кровянистый, жидкий, иногда с примесью небольшого количества беловато-желтой творожистой массы; в дальнейшем он может приобретать серовато-желтый маслянистый вид.
В абсцессах с хроническим течением гной чаще густой, напоминает казеозную (творожистую) массу.
Диагноз. При осмотре острых поверхностных абсцессов устанавливают полусферическую припухлость, флюктуирующую при пальпации, с повышенной местной и общей температурой и болевой реакцией средней степени. Для определения флюктуации накладывают на противоположные стороны припухлости большой и указательный пальцы. При попеременном надавливании пальцами на припухлость ощущают колебательное перемещение жидкости (зыбление). Чем поверхностнее гнойник и тоньше его стенка, тем флюктуация определяется лучше; при глубоко расположенном абсцессе—хуже, а иногда и вовсе не выявляется, если стенка гнойника сильно напряжена или утолщена за счет инкапсуляции.
Острые глубокие абсцессы диагностируют по наличию повышенной общей и местной температуры, учащению пульса, дыхания и угнетению животного, нарушению функции соответствующего органа или части тела, а также по устанавливаемым иногда признакам глубокой флюктуации (зыбление под толстым слоем тканей). При этом нужно исключить ложную флюктуацию, которая ощущается при бимануальной пальпации мышц, находящихся в расслабленном состоянии или умеренном напряжении. Чтобы отличить глубокую флюктуацию от ложной, необходимо провести пальпаторное исследование соседних участков и сравнить с результатами флюктуации зоны предполагаемого глубокого абсцесса. Истинная глубокая флюктуация отличается от ложной тем, что при пальпации интактной зоны не удается получить таких же ощущений, как при пальпации зоны глубокого абсцесса, нередко при этом выявляются коллатеральный отек подкожной клетчатки и сильная болевая реакция при надавливании на кожу под центром проекции глубокого абсцесса.
В целях уточнения диагноза делают пункцию, которая совершенно необходима при диагностике глубоких абсцессов. Пункцию поверхностного абсцесса выполняют инъекционной иглой в центре припухлости при косом направлении; глубокого абсцесса—перпендикулярно иглой значительного диаметра с мандреном в точке максимальной болезненности. Достигнув предполагаемой глубины залегания гнойника, мандрен извлекают, присоединяют шприц и оттягивают поршень. Если гной не насасывается, вновь вводят мандрен в иглу и равномерно продвигают ее вглубь. При проколе стенки острого абсцесса ощущается «провал» иглы, а при проколе инкапсулированного абсцесса отмечается усиливающееся сопротивление, иногда с хрустом, и затем «провал» иглы. Густой гной хронических абсцессов предварительно разжижают фурацилином или хлорамином. После аспирации гноя и тщательного промывания абсцесс вскрывают (см. ниже).
Необходимо учитывать, что абсцесс формируется за несколько дней, а гематома образуется после травмы в течение нескольких минут или часов, прокол ее сопровождается выделением крови из иглы. При пульсирующих гематомах определяется пульсация, а при аускультации — шумы. Аневризма располагается по ходу магистрального кровеносного сосуда, припухлость вытянуто-овальная, при надавливании уменьшается и хорошо пульсирует, прослушиваются шумы, связанные с пульсовой волной, пункция дает свежую кровь. Грыжа от абсцесса отличается прежде всего тем, что содержимое грыжевого мешка обычно удается вправить в полость и вследствие этого полусферическая припухлость исчезает, но может возникать вторично; при аускультации грыжевой припухлости прослушиваются перистальтические шумы. Новообразования отличаются от абсцесса медленным увеличением припухлости, отсутствием воспалительных явлений и флюктуации.
Лечение должно соответствовать стадии развития абсцесса. Созревший абсцесс необходимо возможно раньше освободить от гноя аспирацией с последующим промыванием гнойной полости. Для аспирации гноя используют иглу большого диаметра или пробный троакар. К ним присоединяют шприц и с помощью его опорожняют, затем промывают гнойную полость раствором хлорамина или фурацилина до появления чистого раствора. Затем промывную жидкость отсасывают и инъецируют в гнойную полость новокаинантибиотиковый раствор или линимент синтомицина. Так поступают при глубоких и метастатических абсцессах.
Лучшие результаты получают от вскрытия абсцессов под местным обезболиванием. Перед вскрытием большого поверхностного абсцесса с сильным напряжением стенки его прокалывают троакаром с присоединенной резиновой трубкой и удаляют часть гноя в сосуд с антисептическим раствором, затем вонзают остроконечный скальпель в самую выпуклую часть абсцесса и рассекают его книзу, до грануляционного вала. Полость вскрытого доброкачественного абсцесса орошают теми же растворами или перекисью водорода, осушают стерильными салфетками и рыхло заполняют дренажем с линиментом А. В. Вишневского или синтомицина. Дальнейшее лечение такое же, как и гранулирующей раны. Глубокий абсцесс вскрывают, ориентируясь по игле, введенной в его полость для предварительного промывания.
Лечение вскрытого злокачественного абсцесса должно включать: частичное иссечение мертвых тканей и некротизироваиных грануляций, остановку кровотечения; длительное орошение вскрытого абсцесса теплым раствором хлорамина, перекиси водорода или калия перманганата; обильное припудривание трициллином и другими сложными порошками; рыхлое дренирование с гипертоническими растворами либо протеолитическими ферментами (см. лечение флегмон).
Флегмона—разлитое распространяющееся острогнойное, реже гнилостное, воспаление рыхлой клетчатки с преобладанием некротических явлений над нагноительными.
Различают первичную флегмону, возникающую на фоне закрытых инфицированных травм и ран, открытых переломов, других повреждений, и вторичную флегмону, развивающуюся как осложнение при локализованной острой инфекции (фурункул, карбункул, абсцесс, гнойный артрит, остеомиелит и др.), болезнях кожи (экзема, дерматит и др.), метастазировании инфекта и вспышке дремлющей инфекции. По характеру экссудата флегмоны подразделяются на гнойные, гнойно-геморрагические, гнилостные и газовые, а в зависимости от топографической локализации—на подкожные, субфасциальные, межмышечные и футлярные. Большинство из перечисленных флегмон могут быть ограниченными и диффузными, имеющими тенденцию к анатомической генерализации.

Рис. Проявление гнойной инфекции
Флегмона:
а – плеча; б – бедра
Патогенез и клинические признаки. Флегмоны развиваются в большинстве случаев стадийно. Начинается первичная флегмона в виде более или менее разлитого воспалительного отека (первая стадия, или стадия серозного пропитывания тканей). На этой стадии флегмона может задерживаться, длительное время (серозная флегмона) или переходит во вторую, более тяжелую стадию клеточковой инфильтрации и формирования клеточкового барьера. Припухлость в этот период становится очень болезненной, горячей и довольно плотной консистенции.
Вокруг плотной, плоской припухлости имеется более или менее выраженная зона отека, чаще с резким уступообразным переходом в здоровые участки тела. Животное при этой стадии флегмоны сильно угнетено, температура тела высокая (у крупного рогатого скота может быть субфебрильная). Вскоре флегмона переходит в стадию прогрессирующего некроза и абсцедирования, что вызывает еще более сильное угнетение и обуславливает высокую общую температуру животного вследствие повышенной резорбции продуктов жизнедеятельности микробов и тканевого распада. Припухлость становится более плотной, почти деревянистой, с четко ограниченными границами и узкой зоной отека. В центре уплотнения и максимальной болезненности удается установить отдельные небольшие очаги размягчения. Внутритканевое осмотическое давление на этой стадии достигает 19 атмосфер и более, формирование полноценного грануляционного барьера задерживается. Вскоре эта стадия переходит в стадию сформировавшихся абсцессов и прорыва гноя наружу или в анатомические полости. При этом над разлитой плотной припухлостью появляется обычно несколько небольших флюктуирующих возвышений, при надавливании на которые истонченная кожа нередко прорывается и наружу выходит гнойный экссудат. Общее состояние животного тяжелое, температура высокая.
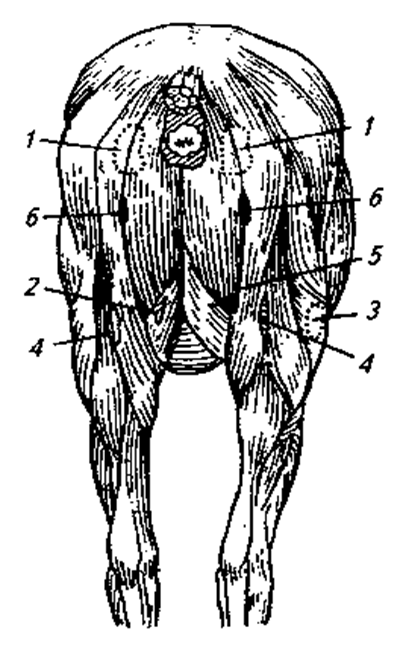
Рис. 24 Схема рациональных разрезов у крупных
животных в зонах межмышечных флегмов
(по М.В. Плахотину):
1 – седалищный бугор; 2 – разрез апоневроза стройной мышцы; 3 – коленная чашечка; 4-6 – разрезы в межмышечных желобах при абсцессах и флегмонах межмышечного заднебедренного соединительнотканного пространства
Самопроизвольное вскрытие созревших гнойников и выделение экссудата наружу характеризуют стадию самоочищения. При этом общее состояние животного несколько улучшается, появляется аппетит, общая температура начинает снижаться, но все еще остается высокой, так как продолжается резорбция из полости флегмоны токсических продуктов вследствие неполноценности грануляционного барьера и наличия образовавшихся ниш и карманов, заполненных большим количеством мертвых тканей и гноем. Поэтому стадия самоочищения флегмоны затягивается на продолжительное время, пока все мертвые ткани не подвергнутся ферментативному разжижению. Количество же их может дополняться в связи с продолжающимся инфекционным процессом, так как инфект к моменту самопроизвольного вскрытия флегмоны обычно не подавляется. Для ускорения очищения флегмоны от мертвых тканей и подавления микробов необходимо широко рассечь самопроизвольно вскрывшуюся флегмону и удалить мертвый субстрат. После очищения полости флегмонозный процесс вступает в стадию гранулирования и рубцевания. При этом снижаются признаки острого воспаления, улучшается общее состояние, резко уменьшается отделение гноя. Понижаются общая температура и болевая реакция. Обширные гранулирующие флегмонозные полости медленно заполняются вновь образованной соединительной тканью, которая затем превращается в значительный рубец, нередко нарушающий функцию области поражения.
При неблагоприятном течении флегмоны инфекционный процесс генерализуется, микробы проникают в некротизированные вены и лимфатические сосуды, что приводит к развитию гнойных тромбофлебитов, лимфангоитов и лимфонодулитов. Если не предпринять срочных мер лечения, развивается сепсис. Ему предшествует обычно тяжело выраженная, особенно при диффузных флегмонах, гнойно-резорбтивная лихорадка. В крови при флегмонах отмечается высокий лейкоцитоз при выраженном нейтрофилезе и уменьшении количества моноцитов.
Первичные флегмоны могут осложняться переходом инфекции на соседние ткани и органы. Вследствие этого, например, при параартикулярной флегмоне возникает гнойный артрит, а при параоссальной—периостит и остит, в иных случаях поражаются сухожилия, сухожильные влагалища и другие ткани.
Гнойная флегмона встречается довольно часто. Она протекает преимущественно ограниченно, а диффузно возникает, как правило, под влиянием вирулентных стрептококков. Гнойная флегмона характеризуется нагноением, абсцедироваиием и обширными некрозами, приводящими к образованию ниш и карманов. Так же как и серозно-некротическая флегмона, она сопровождается тяжелой гнойно-резорбтивной лихорадкой, лимфангоитом, лимфанодулитом и тромбофлебитом. Диффузная гнойная флегмона при запоздалом и недостаточно радикальном лечении может привести к сепсису.
Подкожная флегмона чаще протекает как серозная и гнойная. Припухлость при ней выражена довольно хорошо, кожа вскоре становится напряженной. В стадии абсцедирования на плотной припухлости появляются небольшие флюктуирующие возвышения, которые затем самопроизвольно вскрываются. Нередко эта флегмона приобретает диффузный характер.
Подфасциальная флегмона протекает тяжелее подкожной и сопровождается более обширными некрозами. Так как фасции обладают ничтожно малой растяжимостью, то флегмонозная припухлость выражена недостаточно четко. Под кожей развивается умеренный коллатеральный воспалительный отек, а под фасцией наблюдаются основные изменения в виде инфильтрации, некроза и нагноения. Инфильтрат и гной, накапливающиеся под фасцией, распространяются вширь между листками фасций или между ними и подлежащими органами (мышцы, сухожилия, капсульная связка, кости и пр.). Огромное давление, возникшее под фасцией, благоприятствует развитию некроза, анатомической генерализации процесса и сопровождается сильной болью. Встречающиеся на пути продвижения гноя соединительнотканные перегородки лишь на время задерживают его распространение. После их некротического распада гной прокладывает себе путь дальше. Это может происходить до тех пор, пока не будет вскрыта флегмона или не наступит самопроизвольного прорыва гноя наружу. Образование грануляционного барьера при этой флегмоне происходит медленнее, чем при подкожной флегмоне. В результате всего этого резорбция продуктов тканевого распада и токсинов микробов оказывается повышенной, что сопровождается тяжелой гнойно-резорбтивной лихорадкой. Одновременно с этим резко нарушается функция отдельных частей тела, например при подфасциальной флегмоне предплечья вся конечность выключается из функции; будучи полусогнутой, она периодически приходит в маятникообразное состояние. Несвоевременное оперативное вмешательство способствует развитию некрозов, генерализации инфекта и развитию сепсиса.
Футлярная флегмона, являясь разновидностью подфасциальной флегмоны, развивается в соответствующем частном фасциальном «футляре» преимущественно предплечья, голени, холки и спины. Так как процесс развертывается в глубине, под несколькими фасциями, то припухлость выражена слабо. В зоне соответствующего фасциального «футляра» появляется умеренный коллатеральный отек. Кожа здесь обычно подвижная, глубокая пальпация сопровождается сильной болью, функция конечности выключается полностью. Остальные изменения такие же, как и при подфасциальной флегмоне. Заключенная в фасциальный «футляр», мышца частично или полностью некротизируется, повреждаются сосуды и нервы. В результате этого могут возникать парезы, параличи, а некроз вен приводит к кровотечению. Учитывая сказанное, необходимо возможно раньше рассекать фасциальный «футляр» на границе перехода мускульного брюшка в сухожилие.
Межмышечная флегмона возникает при глубоких колотых, ушибленных, случайных и осколочных огнестрельных ранениях, открытых переломах, остеомиелитах, гнойных артритах или на фоне подфасциальной и других флегмон. Особенно длительно и тяжело протекают межмышечные флегмоны области шеи, холки, крупа и при поражении рыхлой клетчатки заднебедренного соединительнотканного пространства. Большую опасность представляет межмышечная флегмона брюшной стенки, развивающаяся между мышечными пластами, после их расслоения и загрязнения содержимым кишечника или рубца при операционных или случайных ранах. Межмышечный
флегмонозный процесс распространяется по рыхлой межмышечной клетчатке вдоль мышц, нервных стволов и сосудистых магистралей. Начавшаяся, например, межмышечная флегмона в области крупа часто распространяется на область бедра и даже голень. Гнойные массы при межмышечных флегмонах обычно опускаются до места прикрепления апоневрозов к костям или сухожильно-апоневротическим растяжениям. Учитывая эту особенность распространения флегмоны, необходимо рассечение тканей производить ниже места перехода соответствующей мышцы в собственный апоневроз.
Межмышечные флегмоны сопровождаются тяжелой интоксикацией. Самопроизвольное вскрытие их затруднительно. Это приводит к длительной интоксикации организма и обширным некрозам рыхлой клетчатки, мышц, апоневрозов и других анатомических образований, что может в короткое время привести к предсептическому состоянию и сепсису. Именно поэтому межмышечные флегмоны необходимо своевременно диагностировать и комплексно лечить.
Диагноз межмышечных и «футлярных» флегмон довольно сложный. Первыми признаками межмышечной флегмоны являются резкое нарушение функции части тела, значительное повышение температуры больного животного, частые пульс и дыхание, угнетение, нарушение аппетита. В зоне развивающейся флегмоны устанавливается очень болезненное напряжение мышц, кожа подвижна, собирается в складки, межмышечные желоба и контуры мышц сглаживаются. В последующем возникает коллатеральный отек над местом максимальной болезненности. Удачно сделанные проколы в таких местах иглой значительного диаметра позволяют отсосать шприцем гной. Анамнез и анализ перечисленных симптомов помогают установить диагноз.
Лечение следует проводить с учетом общего состояния, вида животного и возбудителя, топографической локализации и характера развития флегмоны. Оно должно быть прежде всего комплексным и направленным на подавление инфекта; охрану нервных центров от перераздражения; нормализацию воспалительной реакции и повышение общей сопротивляемости организма; уменьшение некротических и резорбтивных явлений; локализацию флегмонозного процесса и образование полноценного грануляционного барьера; более быстрое абсцедирование и последующее очищение от мертвых тканей, а также предупреждение местных осложнений и сепсиса. В стадии выздоровления лечение должно способствовать регенерации, рассасыванию излишнего рубца и восстановлению работоспособности и продуктивности животного. В период лечения больным животным предоставляют покой, улучшают их содержание, обеспечивают полноценным, обильным кормлением, витаминизированными и ощелачивающими кормами.
В стадии воспалительного отека и клеточного инфильтрата необходимо сочетать тепловые процедуры с применением новокаинантибиотиковых блокад. При локализации флегмон в области головы, шеи, конечностей целесообразны внутриартериальные и внутривенные инъекции новокаинантибиотиковых растворов и других антисептических и бактериостатических средств (см. лечение местной гнойной инфекции). При подкожных флегмонах с успехом может быть применена ионогальванизация водного 1—2%-ного раствора новокаина с пенициллином и стрептомицином из расчета по 600—1000 ЕД на 1 см2 прокладки (5000—10000 ЕД в 1 мл раствора) при плотности тока от 0,1 до 0,2 А/см2 и экспозиции от 20 до 60 мин ежедневно. Кроме того, в стадии инфильтрации применяют электрическое поле УВЧ в слабой или умеренно теплой дозировке, ежедневно по 10—15 мин.
В стадии инфильтрации при диффузных прогрессирующих флегмонах, сильном напряжении тканей (до деревянистой плотности) необходимо для уменьшения внутритканевого напряжения сделать под местным обезболиванием в сочетании с нейроплегиками насечки на коже в шахматном порядке длиной 2—3 см. Предварительно выбритую кожу целесообразно смазать 10%-ной ихтиоловой мазью. При подкожных флегмонах кожу рассекают до подкожной клетчатки, а при подфасциальных—обязательно фасции или апоневрозы. После остановки кровотечения на зону насечек накладывают повязки, обильно смоченные 5—10%-ными растворами средних солей, в которые добавляют фурацилин и другие антисептические средства.
В стадии абсцедирования при всех видах флегмон делают широкие разрезы, вскрывают по возможности имеющиеся ниши и карманы, удаляют мертвые ткани с помощью ножниц, не нарушая грануляционный барьер. До и в процессе иссечения мертвых тканей целесообразно промывать флегмонозную полость подогретыми до 40° растворами: перекиси водорода с фурацилином 1 : 5000, 5%-ного калия перманганата в 5—10%-ном растворе сульфата магния либо хлорида кальция; 2%-ного хлорамина. После иссечения мертвых тканей и остановки кровотечения возможно тщательнее удаляют промывную жидкость. Затем выстилают раневую поверхность обильно смоченной 96% спиртом салфеткой Микулича, заводя ее в ниши и карманы. Выстланную полость заполняют стерильными ватно-марлевыми шариками, пропитанными линиментом А. В. Вишневского на рыбьем жире; края салфетки вводят в рану и на последнюю накладывают временные швы. В случаях диффузного кровотечения осуществляют тугую тампонаду. При этом тампоны смачивают тем же линиментом, в который добавляют на каждые 100 мл 5 мл скипидара. Для удержания тампонов рану зашивают. На второй день после такой тампонады удаляют швы и тампоны. При рыхлом заполнении раны перевязку делают через 3—4 дня. Далее лечение осуществляют по одному из трех принципов в зависимости от полноты иссечения мертвых тканей. Если в ране осталось много мертвых тканей и не обеспечен сток экссудата из ниш и карманов через контрапертуры, применяют первый или второй принципы лечения. Перед их осуществлением удаляют салфетку Микулича.
Первый принцип лечения — сущность его сводится к ежедневному или через день рыхлому дренированию (до появления грануляций) с 10%-ным раствором магния сульфата либо кальция хлорида или с 15—20%-ным раствором мочевины (тиомочевины). Применение этих растворов вызывает положительный лимфаваж и способствует демаркационной секвестрации мертвых тканей. Целесообразно добавлять к ним калия перманганата до 0,25— 0,5%, фурацилина—из расчета 1:5000. При наличии глубоких ниш, заполненных мертвыми тканями, с признаками гнилостного распада необходимо до дренирования с интервалами в 5 мин провести в течение 10—15 мин 3—4 раза орошение гипертоническими растворами средних солей с калием перманганатом либо перекисью водорода, подогретыми до 38—40°. Хорошие результаты получают от длительного орошения и последующего дренирования с 2%-ным хлорамином или 2%-ным хлорацидом.
Второй принцип лечения сводится к тщательному удалению гноя путем промывания фурацилином, хлорамином, осушению флегмонозной полости и последующему ее дренированию с желудочным соком. Это позволяет в короткие сроки лизировать мертвые ткани. Следует учитывать, что желудочный сок содержит 0,5% соляной кислоты, вследствие чего длительное применение его способствует некротизации здоровых тканей. Его можно применять при наличии значительного слоя мертвых тканей не более 2—3 дней. Целесообразно промывать флегмонозную полость 2—5%-ным трипсином и химотрипсином на 0,25% -ном растворе новокаина или смачивать ими марлевые дренажи, что способствует очищению гнойно-некротических очагов и ран от мертвых тканей, не оказывая вредного влияния на здоровые ткани, стимулирует рост грануляций. Он активен как при кислой, так и слегка щелочной раневой среде.
Третий принцип лечения. Если во флегмонозной полости мало мертвых тканей и обеспечен хороший сток, ее дренируют с бальзамическим линиментом А. В. Вишневского, приготовленным на рыбьем жире. Наряду с местным лечением применяют комплекс общей противосептической терапии (см. ниже).
В стадии гранулирования и рубцевания лечение такое же, как при гранулирующих ранах. Для уменьшения образующегося рубца целесообразны дозированные моционы, местные тепловые процедуры, тканевые подсадки, пирогенал.
АНАЭРОБНАЯ ИНФЕКЦИЯ
Анаэробная хирургическая инфекция является прежде всего раневой инфекцией. Наиболее часто она развивается при случайных ушибленно-рваных, а также осколочных огнестрельных ранах. В литературе имеются указания о возможности эндогенного пути ее развития. Анаэробная инфекция может возникнуть при подкожных и особенно внутримышечных инъекциях растворов и вакцин, при несоблюдении асептики и антисептики. Если учесть, что анаэробы обнаруживаются в 95% проб почвы и в 100% проб навоза, то следует признать, что случайные раны животных, особенно в области конечностей, всегда загрязнены теми или иными анаэробами. Несмотря на это, раневая анаэробная хирургическая инфекция у животных развивается относительно редко, исключением является рогатый скот. У него она проявляется в виде газового отека (брадзот) и анаэробной флегмоны при разрыве пищевода.
Обширные, широко зияющие раны, обильно загрязненные почвой и навозом, редко осложняются анаэробной инфекцией, если подвергаются своевременной хирургической и антисептической обработке.
Этиология. Хирургическая анаэробная инфекция проявляется в виде газообразующей или кластридиозной инфекции чаще вызывается четырьмя возбудителями: Cl. perfringens, Cl. Oedematicus, Cl. Oedematis maligni, Cl. Hystoliticus и в виде гнилостной инфекции чаще вызываемой факультативными анаэробами B. colli, B. putrificus, В. proteus vulgaris.
Развитию инфекции способствует ряд условий: колотые и иные раны с узким входным отверстием и наличием раздавленных, размозженных мышц, ранящих и других инородных предметов, ниш, карманов, сгустков крови; разрывы или тромбоз основных артериальных магистралей, снабжающих кровью зону повреждения; венозный застой и наличие обширных гематом; большие кровопотери; длительное оставление жгута на конечности; ослабление сердечной деятельности и другие условия, приводящие к кислородному голоданию тканей и созданию анаэробных условий в ране. Кроме того, развитию анаэробной инфекции способствуют гипо- и авитаминозы, охлаждение, общее истощение, нервное перевозбуждение, физическое переутомление и особенно запоздалая, недостаточная и тем более непроведенная хирургическая и антимикробная обработка глубоких ушибленно-размозженных ран, открытых переломов, на которые накладывают глухие повязки.
Таблица 2

Чем больше в ране мертвых тканей, толще мускулатура и глубже раны, тем чаще и скорее развивается данная инфекция при всех других равных условиях. У рогатого скота вследствие обильного выделения в рану фибрина создаются более благоприятные условия для развития анаэробной и гнилостной инфекции, чем у лошадей и собак, с их серозно-экссудативным типом воспалительной реакции. Важно иметь в виду, что организм животных не выработал достаточного иммунитета по отношению к анаэробной инфекции, воспалительная же реакция при ней оказывается слабо выраженной, а при газовой гангрене и газовом отеке—подавленной. Вследствие этого возникший инфекционный процесс бурно-развивается и быстро генерализуется. Нейтральная или слегка щелочная реакция тканевой среды оказывается наиболее подходящей для развития и жизнедеятельности анаэробных микроорганизмов. Оптимум рН среды для роста B. tetani —7,0—7,6; B. perfringens—7,2—7,4; B. hystolyticus—6,0—7,6; Vibrion septique— 7,6; B. oedematiens –7,2—7,4. Указанные микробы (кроме B. tetani) окрашиваются по Граму.
По клиническому проявлению хирургическую анаэробную инфекцию подразделяют на газовый абсцесс, газовую гангрену, анаэробную газовую флегмону, злокачественный и газовый отеки, а также столбняк и некробактериоз.
Газовый абсцесс. У животных, особенно рогатого скота и свиней, на месте случайных уколов или инъекций может возникать газовый абсцесс. Такое проявление анаэробной инфекции у этого вида животных, по-видимому, обусловлено вначале сгустком фибрина, а затем выраженной пролиферативной реакцией, локализующих возбудителя на месте его первичного внедрения. По данным автора, газовые абсцессы могут наблюдаться в любой части тела. Однако обычно они возникают в местах, где мускулатура образует мощные пласты. В отличие от абсцесса, вызванного гноеродными микробами, газовый абсцесс формируется быстрее, без выраженных признаков воспаления, но при высокой общей температуре, общем угнетении, учащении пульса и дыхания. Перкуссией созревшего абсцесса выявляется тимпанический звук, а пальпацией — значительное уплотнение вокруг абсцесса. При вскрытии его изливается красно-бурый жидкий экссудат с гнилостным запахом и пузырьками газа. Дно и стенки абсцесса плотные, неровные, выстланы крупноворсинчатыми образованиями. Своевременное применение антибиотиков и сульфаниламидов, вскрытие созревшего абсцесса и последующее дренирование его с гипертоническими растворами средних солей и добавкой к ним до 0,5—1% марганцовокислого калия или до 3% пергидроля способствуют излечению; целесообразно также длительное орошение хлорсодержащими средствами (хлорацид, хлорамин с раствором калия перманганата).
Газовая гангрена. Возбудителями газовой гангрены, по данным отечественных исследователей, в 92—100% случаев является Cl. perfringens, в 21—35%—Cl. oedematiens, в 4—12%— Vibrion septique и очень редко (0,6%) —Cl. hystolyticus. Иногда в их ассоциацию входят возбудители гнилостной инфекции B. putrificus и B. sporogenes.
Развитие, течение, степень разрушения тканей, генерализация и раннее подавление функции нервной системы обусловлены преимущественно биологическими особенностями микроорганизмов, вызывающих газовую гангрену.
Cl. perfringens, будучи грамположительным сапрофитом, при благоприятных условиях раневой среды становится очень вирулентным. Быстро размножаясь в ране, он выделяет фермент гемолизин, лизирующий эритроциты; миотоксин, некротизирующий мышцы; нейротоксин, рано поражающий нервную систему, и большое количество гиалуронидазы, растворяющей гиалуроновую кислоту, входящую в состав межклеточного соединяющего вещества. При ассоциации с другими анаэробами к этому присоединяется вредоносное воздействие их токсинов и ферментов. Так, токсин Cl. oedematiens вызывает сильно выраженный желеобразный отек тканей и гемолиз эритроцитов. Экзотоксин Vibrion septique препятствует эмиграции клеток крови, подавляет фагоцитоз, гемолизирует кровь, вызывая паралич сосудов, и способствует развитию отека. Cl. hystolyticus выделяет протеолитический фермент фибролизин, который расплавляет не только мертвые, но и живые ткани, даже такие, как сухожилия и связки. Присоединение к упомянутым анаэробам гемолитических стрептококков, сарцин, сенной палочки, стафилококков и вульгарного протея способствует развитию и усиливает тяжесть газовой гангрены. Особенно тяжело протекает процесс при ассоциации Cl. perfringens, B. sporogenes, B. putrificus. Другие микробы, например кишечная палочка, значительно снижают токсические свойства основного возбудителя и способствуют более легкому течению газовой гангрены.
Патогенез. В результате местного воздействия токсинов и ферментов анаэробов на ткани и рецепторный аппарат через 24— 48 ч после ранения возникает сильная прогрессирующая боль; развивается паралич с повышенной проницаемостью сосудов, вследствие чего быстро нарастает холодный, мало или совсем безболезненный отек; ухудшается местное кровообращение, прогрессирует омертвение и распад тканей. Этому благоприятствует повышенная свертываемость крови в сосудах зоны отека, что сопровождается прекращением кровообращения; артерии и вены оказываются забитыми тромбами, создаются благоприятные условия для развития гангрены. Омертвевшие мышцы и другие ткани подвергаются ферментативному распаду. Вследствие разложения белков, углеводов и особенно мышечного гликогена образуются газы. Накапливаясь в зоне отека, они еще более повышают внутритканевое давление, что, в свою очередь, ухудшает кровообращение и способствует дальнейшему омертвению тканей. Эти процессы протекают очень быстро: за 2—3 дня омертвевают части тела. Прогрессирующий, бурно протекающий гангренозный процесс и поступление в кровь огромного количества микробов, их токсинов и токсических продуктов распада тканей приводят к поражению нервной системы. В ней возникает парабиотическое состояние, сопровождающееся дискоординацией и дисфункцией работы всех органов. Кроме того, под влиянием токсинов анаэробов довольно быстро некротизируется концевой аппарат нервных окончаний и нервные стволы. При этом в первую очередь страдает периневрий; липоидная ткань осевых цилиндров подвергается деструкции. Наблюдаются дегенеративные изменения в нервной системе сердца и паренхиматозных органов.
Резко снижается антимикробная и антитоксическая функция печени, подавляются воспалительная реакция и иммунобиологические процессы; нарушается функция почек; поражается эндокринная система, развивается сильнейший токсикоз. Ко всему этому присоединяется сепсис, и животное погибает в течение трех—пяти дней с момента заболевания.
Клинические признаки. В начале заболевания в области раны появляется сильная боль с нарастающим холодным безболезненным отеком. Кожа в зоне отека становится напряженной, сквозь нее выступают расширенные шнуры вен на фоне сине-багровых и зеленых пятен непигментированной кожи. Через несколько часов к отеку присоединяется газовая крепитация. Рана сильно зияет, отделяемое незначительное, грязно-серого или коричнево-красного цвета, с неприятным кислым запахом. При смешанной инфекции отделяемого больше, оно имеет цвет мясных помоев, с гнилостным запахом. Рассеченные ткани отечны, окрашены в желтовато-зеленый цвет. Пораженные мышцы цвета вареного мяса, в дальнейшем приобретают черно-бурую окраску. Вырезанные кусочки тканей плавают в воде или 10%-ном растворе поваренной соли. Во время бритья кожи в области отека слышится металлический звук. Животное резко угнетено, отказывается от корма, имеет высокую общую температуру, частый аритмичный, слабый пульс, учащенное, неправильное дыхание, желтушные слизистые оболочки. В тех случаях, когда в ассоциацию микробов входит Cl. hystoliticus, к описанным признакам присоединяется быстрое расплавление соединительной ткани, фасций, связок, мышц. Последние вначале имеют цвет ветчины, затем по мере распада превращаются в крошковатую красно-бурую массу. В крови наблюдается уменьшение эритроцитов при резко выраженной лейкопении, в лейкоцитарной формуле устанавливается резкий сдвиг влево, эозинофилы и моноциты отсутствуют.
Диагноз при выраженных клинических признаках установить довольно легко.
Прогноз сомнительный или неблагоприятный, спасти животное можно только в начале болезни.
Газовая флегмона вызывается теми же возбудителями, что и газовая гангрена, но в ассоциации со стрептококками и стафилококками. При газовой гангрене поражаются главным образом мышцы, а при газовой флегмоне—преимущественно рыхлая клетчатка. Газовая флегмона может быть подкожной, подфасциальной и межмышечной.
Патогенез и клинические признаки. Газовая флегмона обычно возникает при ранах со значительной зоной повреждения, реже при колотых ранах. В зоне раны в отличие от газовой гангрены появляется горячая, болезненная, быстро прогрессирующая припухлость. Газовая флегмона вначале напоминает диффузную гнойную флегмону; так же как и при ней, достаточно интенсивно проявляется воспалительная реакция с выраженным фагоцитозом. Однако вскоре эта реакция подавляется в центральной части припухлости, где развивается гангренозный распад тканей и накапливаются газы. Не достигнув необходимой интенсивности, воспалительный процесс как бы оттесняется от центра к периферии. В связи с быстрой анатомической генерализацией газовой флегмоны грануляционный барьер не успевает сформироваться или совсем не образуется. Все это способствует диффузному распространению газовой флегмоны. Под влиянием гангренозного распада тканей и обильного образования газов центральная часть припухлости становится холодной, баллонообразной и крепитирующей; при перкуссии слышится тимпанический звук; болевая реакция и местная температура устанавливаются только по периферии, в зоне прогрессирующего отека. Раневое отделяемое мутное, гноевидное, пенистое (примесь газов). В начале развития флегмоны отмечается значительное угнетение животного, повышается температура тела, учащаются пульс, дыхание, появляется желтушность слизистых оболочек. В дальнейшем общее состояние еще более ухудшается. В случае присоединения гнилостных микроорганизмов к ассоциации микробов, вызывающих анаэробную газовую флегмону, она приобретает газово-гнилостный характер. При этом появляется обильный, пенистый, зловонный, коричнево-красный экссудат цвета мясных помоев. Наблюдающаяся в начале развития газовой флегмоны слабая воспалительная реакция свидетельствует о способности организма вести борьбу с микробным фактором.
Прогноз при анаэробной газовой флегмоне более благоприятный, чем при газовой гангрене. Своевременно проведенное комплексное лечение может привести к выздоровлению животного.
Злокачественный отек наблюдается у всех видов сельскохозяйственных животных, но более часто у овец после стрижки и других ранений, а у баранов, особенно старых, и после кастрации открытым способом. Возбудителем злокачественного отека является Vibrion septique в ассоциации с Cl. oedematicus.
Имеются данные, что, кроме этих микробов, в развитии болезни принимают участие Cl. perfringeus и даже Cl. hystolyticus. В раневом содержимом может обнаруживаться непатогенный анаэроб В. sporogenus, способствующий гнилостному распаду омертвевших тканей.
Патогенез и клинические признаки. Через несколько часов или одни-двое суток после повреждений кожи, кастрации и других операций, проведенных без соблюдения асептики и антисептики и закрытии раны глухим швом, возникает подкожный быстро прогрессирующий отек. Вначале он теплый и умеренно болезненный, по мере же развития становится холодным и слабо крепитирующим при пальпации. Отек достигает больших размеров. Из раны вытекает сукровицеподобная жидкость без запаха и пузырьков газа. В экссудате всегда обнаруживают большое количество Vibrion septique. Местные явления сопровождаются высокой общей температурой, резким угнетением. Ухудшение прогрессирует по мере развития отека, и животные погибают в течение одних-двух суток, если не предпринять срочных мер лечения.
Гнилостная инфекция развивается под влиянием факультативных анаэробов B. colli, B. putrificus, В. proteus vulgaris и др., нередко находящихся в ассоциации со стрептококками и стафилококками. Эта инфекция характеризуется гнилостным распадом тканей с образованием геморрагического, зловонного экссудата, называемого ихором. Вначале он имеет серо-кровянистый цвет, а затем приобретает цвет мясных помоев.
Патогенез. Гнилостные микробы кишечного тракта при дисбактериозе и нарушении кишечного барьера могут проникать во внутреннюю среду организма и вызывать эндогенную гнилостную инфекцию. Это наблюдается при инвагинациях, ущемлениях кишечника и его ранениях. Экзогенная гнилостная инфекция возникает при тяжелых ранах с размозжением тканей и образованием значительных ниш и карманов. Гнилостные микробы живут и размножаются в мертвых тканях, в здоровые ткани они не проникают. Таким образом, для развития гнилостной инфекции прежде всего необходимы мертвые ткани или разлагающиеся сгустки крови при нарушенном кровообращении и недостатке кислорода в раневой среде. В таких условиях под влиянием ферментов, выделяемых гнилостными микробами, происходит распад мертвых тканей. Это сопровождается накоплением в очаге инфекции чрезвычайно ядовитых птомаинов и токсальбуминов, газа и ихора. Продукты гниения тканей резко снижают воспалительную реакцию, фагоцитоз, защитную функцию местной ткани и полностью подавляют жизнь клеток в зоне непосредственного воздействия; всосавшись в кровь, они вызывают тяжелую интоксикацию организма, резко снижают функцию нервной системы и внутренних органов, вызывая в последних дегенеративные перерождения и некрозы.
Клинические признаки. Вначале гнилостная инфекция проявляется в виде прогрессирующего воспалительного отека. При наличии раны из нее на второй день начинает выделяться жидкий ихор. Омертвевающие ткани дряблые, расползаются, зеленовато-серого и черно-бурого цвета. Наблюдается аррозионное кровотечение. Образовавшиеся до развития инфекции грануляции некротизируются, и процесс переходит на глубжележащие ткани и органы. В короткие сроки омертвевают сухожилия, сухожильные влагалища, мышцы и процесс, расширяясь, захватывает все новые и новые участки тела; на конечностях отпадают копыта и фаланги пальцев. Все эти изменения сопровождаются сильной интоксикацией организма, высокой температурой тела, учащенными пульсом и дыханием; состояние животного резко угнетено.
Прогноз осторожный или неблагоприятный. В запущенных случаях лечение не приносит положительных результатов.
Таблица3 
3.4.1. Лечение при анаэробной инфекции должно быть комплексным, с учетом биологических особенностей анаэробных микробов, их ассоциаций, патогенеза и форм проявления болезни. Оно должно включать прежде всего хирургические и специфические лечебные мероприятия в сочетании с осмо-оксигено- и патогенетической терапией. Главное при этом состоит в том, чтобы все лечебные меры были применены возможно раньше, по возможности до клинического проявления инфекции либо в самом начале ее. В таком случае создаются неблагоприятные условия для возбудителей, предупреждаются нервнодистрофические и гангренозные процессы и не подавляются защитные силы организма.
Хирургическое лечение имеет большое профилактическое и лечебное значение, а в ряде случаев оказывается ведущим. При свежих глубоких ранах с большой зоной повреждения мышечной ткани, с почвенно-навозным загрязнением совершенно необходима хирургическая обработка (см. ниже). Животных с признаками анаэробной инфекции изолируют и проводят лечебные процедуры в отдельном помещении, не связанном со стационаром, перевязочной или общим манежем, где ведется прием больных животных. Резиновую обувь, перчатки, хирургическое белье, инструментарий тщательно моют и стерилизуют. Помещения и оборудование, где обрабатывают и содержат животных, подвергают дезинфекции. Перевязочный материал, веревки, загрязненные экссудатом, сжигают.
Лечение животных при анаэробной инфекции осуществляют после обработки животных, свободных от этой инфекции. Перед началом операции осуществляют новокаинантибиотиковую инфильтрацию по периферии зоны отека.
Газовый абсцесс вскрывают широким разрезом, иссекают мертвые ткани, ликвидируют ниши, карманы и применяют горячие (40°) гипертонические растворы средних солей с перекисью водорода, калием перманганатом либо с хлорамином.
Газовую флегмону, газовые отеки, зону газовой гангрены рассекают широким («лампасным») одним или несколькими разрезами в пределах отека, до границы признаков кровоточивости, мертвые ткани иссекают.
Зашитые раны с признаками развивающейся анаэробной инфекции (отеки с крипитацией, выделение газа и пр.) немедленно вскрывают, производят дополнительные рассечения, делают контрапертуры, иссекают мертвые ткани до появления кровотечения. До, во время и непосредственно после иссечения раны длительно орошают (до 20 мин) указанными выше растворами. В них целесообразно добавлять скипидара от 2 до 10%. Промытые раны рыхло дренируют с Sol. natrii chloridi 20%; Hydrogenii peroxydati 3% аа 100,0, 01.Terebenthini 10,0.
Вместо дренирования рану можно обильно припудривать сложными пудрами с антибиотиками (Acidi borici 6,0, Iodoformii 2,0, Penicillini 500 000 (1 000 000) ЕД. Наружное, для депонирования раны) либо другими подобными порошками.
Большого внимания заслуживают внутримышечные инъекции антибиотиков и оксигенотерапия. Кислород через иглу нагнетают из кислородной подушки в пограничные здоровые ткани и непосредственно в зону анаэробного очага.
Таблица 4. Примерная дозировка противогангренозных сывороток
| Состав сывороток и дозы | |||||
| Назначение | Antiperfringens | Antivibrion septicus | |||
| инъекций | Животные | ||||
| сывороток | АЕ* | мл | АЕ | мл | |
| Профилакти- | Мелкие | 510 | 8,5 | 3 000 | 5 |
| ческое | Крупные | 80 400 | 134 | 40 200 | 67 |
| (100 000)** | (166) | (50 000) | (83) | ||
| Лечебное | Мелкие | 25 000 | 42,5 | 15 000 | 25 |
| Крупные | 420 000 | 670 | 210 | 335 | |
| (500 000) | (830) | (250 000) | (415) | ||
Продолжение
| Состав сывороток и дозы | Общая доза на одну | ||||
| Назначение | Antioedematiens | инъекцию | |||
| инъекций | Животные | ||||
| сывороток | АЕ* | мл | АЕ | мл | |
| Профилакти | Мелкие | 7 200 | 12 | 15 300 | 25,5 |
| ческое | Крупные | 120 000 | 200 | 240 600 | 401 |
| (15О 000) | (25О) | (300 000) | (499) | ||
| Лечебное | Мелкие | 36 000 | 60 | 76 500 | 127,5 |
| Крупные | 600 000 | 1 000 | 1 200 000 | 1 955 | |
| (75О 000) | (1 250) | (1 500 000) | (2 495) | ||
* АЕ — антитоксические единицы сыворотки, принятые в России.
** В скобках — повышенная терапевтическая доза.
Неспецифическое лечение заключается в использовании средств и методов охранительной терапии (новокаинантибиотиковые блокады, внутрисосудистые инъекции), дезинтоксикации и выведении токсинов (инъекции 40%-ного гексаметилентетрамина с дозой кофеина, 10% раствора кальция хлорида с 20%-ным раствором глюкозы, переливание совместимой крови либо 10% реополиглюкина, а также насыщение организма поливитаминами).
Принципы профилактики хирургической инфекции. Основные принципы профилактики хирургической инфекции состоят в следующем: 1. Не допускать проникновения возбудителя инфекции в организм животного, строго соблюдая асептику и антисептику при проведении инъекций, оперативных, акушерско-гинекологических и других врачебных вмешательствах. 2. При наличии мертвых тканей необходимо как можно раньше удалять их оперативным или другим путем и ликвидировать межтканевые ниши и карманы. 3. Обеспечивать оптимальные условия дренирования, используя средства осмотерапии и ферментотерапии. 4. Местно применять антисептические растворы и депонировать сложные бактериостатические порошки. 5. Снимать сенсибилизацию организма и перевозбуждение периферического и центрального отделов нервной системы средствами охранительной терапии (новокаиновые блокады, транквилизаторы и пр.).
Все эти мероприятия должны проводиться при полноценном белковом, углеводном, жировом и витаминно-минеральном кормлении, правильном содержании и эксплуатации животных.
Специфическое лечение и профилактика сводятся к применению смеси моновалентных противогангренозных сывороток. С профилактической целью сыворотку вводят внутримышечно или подкожно в зоне здоровых тканей, где не нарушено кровообращение, чтобы лучше происходило всасывание. Во избежание анафилаксического шока вначале вводят в вену 2— 5 мл сыворотки. Затем через 1—2 ч при отсутствии признаков шока вводят не менее 5 профилактических доз противогангренозных сывороток, разведенных в 3—5 раз стерильным изотоническим раствором натрия хлорида. Такое же количество смеси сывороток инъецируют внутримышечно в зоне и вокруг поражения, на границе отека. Таким образом, в организме больного животного создается депо готовых антител, способствующих выздоровлению. При появлении шоковых признаков введение сыворотки прекращают и внутривенно инъецируют крупным животным 50—100 мл 10%-ного раствора кальция хлорида, а под кожу вводят эфедрин и камфору.
Аэробная и анаэробная хирургические инфекции могут присутствовать в организме животных и в виде дремлющей инфекции.
3.5. ДРЕМЛЮЩАЯ ИНФЕКЦИЯ. КЛИНИЧЕСКОЕ ПРОЯВЛЕНИЕ.
Дремлющая хирургическая инфекция требует до сих пор особого и более того пристального внимания. Во-первых, она дремлющая («спряталась»), требует тщательного распознавания при своем проявлении, вместе с тем она проявляется в виде «вспышек».
Самое главное, она до сих пор нуждается в разработке точной и квалифицированной диагностики, лечения и рациональной профилактики. В хирургии ветеринарной медицины этому уделяется недостаточно внимания. А вот гуманитарная медицина занимается этим давно, скурпулезно и с большим эффектом.
Первое классическое описание вспышек дремлющей инфекции принадлежит Н.И. Пирогову. В «Началах военно-полевой хирургии» (1864) в разделе об инородных телах он писал: «В тех случаях, где пуля с самого начала ее пребывания в теле мало или почти не причинила раздражения, органические ткани скоро привыкают к давлению и едва реагируют против него; тогда случается одно из двух: или 1) около пули образуется из соединительной ткани сумка, и пуля, смотря по тому, будет ли эта сумка сухая или влажная на внутренней своей стороне, остается в ней то вовсе неподвижною, то несколько подвижною. В том и другом случае объективные явления почти ничтожны, раздражения нет; пуля, если она лежит поверхностно, двигается во все стороны без малейшей боли, или 2) припадки раздражения являются только по временам и периодически… Третий период давления (третичные припадки) длится иногда целые годы и целую жизнь… Почти всегда явления третичного периода имеют характер периодический и местный, вызывая временно и общую реакцию. Проходят иногда целые месяцы, пока является новый пароксизм, новые нарывы, рожи и т.п. В промежутки времени больной чувствует себя так хорошо, что может заниматься делами и службой. То же самое замечается, как известно, и у страдающих органическими болезнями суставов, и именно у молодых людей. После вскрывающегося нарыва пульпозные наросты синовиальной оболочки понемногу сжимаются; больные, поправляясь, встают и ходят на костылях, пока не образуется новый нарыв, который кладет их опять на время в постель. Так продолжается целые годы… Из раненых я знал одного офицера, который носил пулю с турецкой кампании (1823 г.) и от времени до времени страдал третичными припадками давления. Еще более застарелое страдание я наблюдал в 1812 г. в нижнюю треть бедра».
Первый случай, когда было ясно доказано длительное бессимптомное существование микробов в организме, подтвержденное тщательным бактериологическим исследованием, был описан Л.В. Орловым в 1889 г. Он наблюдал рецидив периостального абсцесса, вызванного палочками брюшного тифа, через 6,5 месяцев после выздоровления от этого заболевания, осложненного периоститом.
В 1905 г. А.П. Губарев сообщил о рецидиве тромбофлебита, возникшем через 5 лет после первичного заболевания. Провоцирующим фактором явилась операционная травма. В посеве был обнаружен белый стафилококк. «Было бы натяжкой приписать инфекцию в этом случае возобновлению старого очага в вене, - писал автор, - но и опровергнуть такое объяснения тоже трудно». Позднее в печати периодически появлялись описания случаев длительного бессимптомного пребывания патогенных микробов в организме животного.
Бактериолог С.И. Гольдберг в докторской диссертации (1900) обратил внимание на то, что введенные в кровь микроорганизмы в более или менее короткий срок исчезают. Через некоторое время после введения в кровь бактерии скопляются в органах (в селезенке, в печени и костном мозгу), где могут жить, по данным автора, до 3 месяцев. Гольдберг наблюдал длительное существование микробов в лимфатических узлах на значительном расстоянии от места прививки.
Высокович и Фодор (Fodor) указывали на задержку микробов в паренхиматозных органах. Они обратили внимание на следующий важный факт: в организме голодающего животного микробы живут значительно дольше, чем в здоровом. К 1899 г. Гольдбергу удалось собрать в литературе 8 случаев длительного пребывания инфекции в организме (в течение 8 – 35 лет).
Автор наблюдал изменения свойств синегнойной палочки в организме предварительно иммунизированных и неиммунизированных кроликов и пришел к выводу, что в иммунном организме бактерии не теряют вирулентности, и достаточно небольшого ослабления организма, чтобы «эти бактерии повели к общему или местному заболеванию организма».
Таким образом, еще в прошлом веке был установлен ряд фактов, касающихся возможности длительного сосуществования макро- и микроорганизмов.
Во время первой мировой войны вопрос о дремлющей инфекции приобрел особое значение в связи с появлением большого количества огнестрельных рецидивирующих остеомиэлитов и необходимостью пластических операций при лечении последствий ранений. Этим вопросом занимались крупнейшие русские хирурги: И.И. Греков, П.Д. Соловов, С.С. Гирголав и др. Разрабатывались методы диагностики и профилактики дремлющей инфекции.
В 1929 г. вопрос о дремлющей инфекции подвергся всестороннему обсуждению на XXI Всесоюзном съезде хирургов.
Во время Великой Отечественной войны вновь назрела необходимость разработки этой проблемы.
В последние годы многочисленные исследования (И.Г. Руфанов, И.Л. Крупко, А.В. Чиненков и др.) значительно углубили наши представления о дремлющей инфекции.
Для определения понятия дремлющей инфекции предлагались различные термины: «заточенная», «немая», «похороненная», «недеятельная», «латентная», «покоящаяся инфекция», «покоящийся микробный очаг», «покоящийся микробизм». В 1929 г. П.Г. Корнев предложил термин «блокированная инфекция», считая, что он отражает активное участие организма в инфекционном процессе.
Из всех определений в отечественной литературе упрочнились термины «дремлющая инфекция» и «латентная инфекция».
Не все ученые вкладывают в понятие дремлющей инфекции одно и то же содержание. Однако почти все они признают, что: 1) инфекция может длительно «бессимптомно» существовать в организме животного и при соответствующих условиях вызывать воспалительную реакцию в тканях; 2) в течении дремлющей инфекции имеются две фазы: активная (вспышка) и латентная, которые могут переходить одна в другую; 3) микробы дремлющей инфекции – патогенные микробы; 4) существует возможность распознавания дремлющей инфекции в латентной фазе.
Установлено следующее:
1. При скрытом пребывании микробов в организме животных вирулентность их снижается. На этот факт указывал еще И.И. Греков.
2. Очаг дремлющей инфекции и очаг хронической инфекции имеют общие черты.
3. Состояние тканей в месте внедрения инфекции может влиять на микробы даже при их достаточно высокой вирулентности.
4. Макро- и микроорганизмы находятся в тесном постоянном взаимодействии.
Экспериментальные данные несколько расширили представления о дремлющей инфекции, однако не дали исчерпывающей картины ее патогенеза и, более того, эти экспериментальные данные часто не учитывались авторами многочисленных теорий патогенеза дремлющей инфекции.
Эти теории могут быть разделены на пять основных групп:
1. Механическая теория.
2. Химическая теория.
3. Микробиологические теории.
4. Иммунологические теории.
5. Биологические теории.
Механическая теория. Бонд, Мельхиор, Рейнхард считали, что микробы отграничиваются от тканей плотным рубцовым барьером, который совершенно изолирует их от макроорганизма. Всякая вспышка дремлющей инфекции связана, по их мнению, с травмой барьера, сопровождающейся кровоизлиянием в полость и возникающей вследствие этого активизацией микробов. Эта теория встретила справедливую критику со стороны многих хирургов [И.И. Греков, П.Д. Соловов, Лезер (Leser), Пайр и др.]. Основной тезис, на котором строилась эта механическая теория, - непроницаемость рубца – оказался неправильным. Как показывают новые исследования, рубцы проницаемы не только для тех небольших количеств биологических жидкостей, которые необходимы для функциональной связи макроорганизма, но и для сравнительно грубо дисперсных красок.
Химическая теория. И.И. Греков указывал, что действие самого металла при наличии инородного тела, сказывается, с одной стороны, в снижении активности микробов (бактерицидное действие металла) и, с другой, - в стимуляции пролиферативных процессов с образованием рубцовой капсулы, способствующей изоляции инфекции. Микробиологические теории характеризуются тем, что основное значение придается микрофлоре. Так, например, Пайр представлял патогенез дремлющей инфекции следующим образом: стрептококки, являясь факультативными анаэробами, при попадании в глубину раны выживают и остаются в рубце. При новой травме вследствие притока кислорода стрептококки активизируются.
Теория Пайра неправильна тем, что не учитывается организм в целом и весь процесс объясняется с точки зрения свойств стрептококка, который не является, однако, единственным возбудителем инфекции.
Между сторонниками микробиологических теорий нет единодушия: одни допускают сапрофитирование патогенных паразитов, другие—приобретение патогенных свойств сапрофита, третьи считают, что могут находиться в дремлющем состоянии и сапрофиты, и патогенные паразиты, и что между ними имеется много .переходных форм.
Эта группа теорий приводит к следующим выводам.
1. Все животные в той или иной степени инфицированы.
2. Нет четких границ между патогенностью и сапрофитностыо микроба.
3. Эндогенные источники инфекции могут играть некоторую роль в возникновении многих болезней.
4. Патогенность и сапрофитность микроба являются динамическими понятиями, т. е. сапрофит может становиться патогенным, и наоборот.
Эти неопровержимые, твердо установленные и давно известные факты ничего, однако, не объясняют в исследуемом нами вопросе. И действительно, несмотря на несомненную инфи-цированность всех животных, вспышки инфекции или токсические явления, связанные с ее присутствием, встречаются редко.
Иммунологические теории делятся на две группы: 1) теории, основанные на предположении о возникающей при дремлющей' инфекции сенсибилизации макроорганизма,. [П. Д.. Соловов; Свэн (Swan), Гоэдби (Goadby), Филипсон (Philipson)], чем объясняется сила вспышек инфекции и 2) теории, исходящие из предположения о возникающем при проникновении инфекции иммунитете.
Биологические теории. Этих теорий придерживается большинство русских ученых. Волков рассматривает дремлющую инфекцию не к а к с т а т и ч е с к о е явление, а как п р о ц е с с борьбы инфекции с о р г а н и з м о м в его становлении, причем соотношение сил тоже все время меняется, обусловливая в известных случаях вспышки притаившейся инфекции.
П. А. Герцен отмечал, что в данном вопросе важным фактором является «лабильность коллоидальной системы клеточных аггломератов... Все, что может изменить местное состояние тканей по направлению, параллельному воспалению, как, например, местный ацидоз, может содействовать выявлению дремлющей инфекции».,
Таким образом, признается активное взаимодействие между макроорганизмом и микроорганизмом. Мы считаем, что при наличии в организме «дремлющих микробов» ответная реакция хотя и минимальна, но она существует.
Механизм этой биологической связи и характер ответных реакций до сих пор не раскрыты. Многие считают, что ведущая роль здесь принадлежит свойствам макроорганизма (О.О. Гартох, В. И. Иоффе, П. Н. Беневоленский, И. В. Давыдовский, Ф. М. Плоткин).
Этим исчерпываются основные теории дремлющей инфекции. Существенным недостатком этих теорий является то, что те изменения, которые положены в основу каждой теории, бывают у многих животных, однако носители дремлющей инфекции встречаются как исключение; многие авторы не делают попытки проникнуть в механизм, в существо процесса иммунизации.
Основные причины вспышек дремлющей инфекции
Ю.Я. Грицман (1953) пишет (это до сих пор безупречно и неоспоримо): в настоящее время «обосновано положение о том, что аллергический ответ в сенсабилизированном организме может получаться не только в отношении специфических или неспецифических биологических агентов, но и в отношении разнообразных физических воздействий» (П.Ф. Здоровский).
Сопоставление только что приведенного высказывания крупнейшего русского иммунолога с выводом о том, что любое, в том числе и физическое, воздействие способно провоцировать вспышку, позволяет нам допустить наличие сенсабилизации у носителей дремлющей инфекции.
Более того, универсальный характер раздражителей и стандартная ответная реакция организма в виде вспышки гнойного воспалительного процесса позволяет высказать предположение об участии в патогенезе вспышки реакции, опосредованной через кору головного мозга.
Механизм этой реакции, по-видимому, заключается в следующем. Неблагоприятно протекавший воспалительный процесс, продолжавшийся в глубине тканей длительное время после окончания явных клинических проявлений (это мы покажем при описании морфологических картин), является для организма сильным и продолжительным раздражением, оставляющим, по-видимому, длительный след в коре головного мозга. Новое сильное раздражение, иррадирующее по коре, ведет к возбуждению следовой реакции, которая по проторенным путям изменяет трофику в очаге поражения, что, в свою очередь, изменяет условия существования микроба. Последний активизируется , что является новым сильным раздражением нервной системы, подрывающим трофику тканей и ведущим к общим проявлениям патологического процесса в виде вспышки дремлющей инфекции при участии аллергического компонента.
В результате такой смены причинно-следственных отношений, по-видимому, и развивается вспышка дремлющей инфекции.
Формы дремлющей инфекции
Литературные данные свидетельствуют (Ю.Я. Грицман,1953), что дремлющая инфекция не одинока и что она непрерывным рядом промежуточный форм связана с другими формами хирургической инфекции. А именно:
1. Нормальные соотношения, встречающиеся у всех здоровых существ – флора, находящаяся за пределами эпителиального барьера (на слизистых, коже и т.д.).
2. Дремлющая инфекция - в латентном периоде отделена от организма неполноценным рубцовым барьером. Отмечаются явления стойкой сенсабилизации, сходной с обычной аутосенсабилизацией организма, но при наличии ряда патологических явлений, часто слабо выраженных (повышение проницаемости капилляров, угнетение активной соединительной ткани, изредка отклонения со стороны крови).
Выводы, сформулированные по дремлющей инфекции Ю.Я.Грицмана (1953 г.) до сих пор никем не опровергнуты, и они могут быть успешно рассмотрены в хирургии ветеринарной медицины.
Вот в чем они заключаются :
1. Дремлющая хирургическая неспецифическая инфекция представляет собой разновидность хронической инфекции с минимальной выраженностью клинических симптомов.
2. При изучении клинической картины вспышек, их причин, а также исследовании больных с помощью предложенного нами «индекса резистентности» у носителей дремлющей инфекции обнаруживается состояние неспецифической сенсибилизации по гиперергическому типу, которое является отражением нейтрофических сдвигов в организме. Состояние сенсибилизации менее отчетливо выявляется в случаях, приближающихся по своему течению к выраженной хронической инфекции. В этих случаях можно отметить изменения местного лейкоцитоза, повышение температуры кожи, остаточного азота венозной крови. Появляются сдвиги в картине белой крови.
3. Микробы при дремлющей инфекции изменяются под влиянием условий существования в организме животных, утрачивают часть видовых свойств, теряют в некоторой степени свою вирулентность.
4. Дремлющая инфекция чаще встречается у животных, перенесших ранение, не подвергавшееся своевременной хирургической обработке и осложнившееся гнойно-септическим процессом. Наличие в анамнезе шока, кровопотери, охлаждения и т.п. неблагоприятных факторов, увеличивает вероятность дремлющей инфекции. Из этой группы дремлющая инфекция наиболее часто встречается у тех больных животных, у которых при исследовании методом определения «индекса резистентности» обнаруживается состояние гиперергической реактивной готовности. В качестве вспомогательных методов распознавания дремлющей инфекции могут быть использованы: сравнительное исследование остаточного азота и артериальной и венозной крови, изменение местной температуры кожи, исследование картины крови, взятой из области предполагаемого очага инфекции, проба Ефмана.
5. Лучшим методом профилактики возникновения состояния дремлющей инфекции является своевременная полноценная хирургическая обработка и правильное лечение ран, основанное на принципах нервизма.
6.Выявление ряда патофизиологических сдвигов у носителей дремлющей инфекции указывает путь борьбы с последней. Успех должны иметь мероприятия, направленные на нормализацию нейтротрофического статуса.
7. Дальнейшее изучение проблемы дремлющей инфекции должно идти по пути углубленного исследования как организма ее носителя, так и особенностей микробов. Комплексное изучение этого вопроса даст возможность предупреждать и ликвидировать дремлющую инфекцию.
Общая хирургическая инфекция
Общая хирургическая инфекция характеризуется генерализацией возбудителя и интоксикацией организма, проявляется в виде сепсиса. Однако возникновению его предшествует местная инфекция, сопровождающаяся более или менее выраженной гнойно-резорбтивной лихорадкой.
Дата добавления: 2018-02-15; просмотров: 1531; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
