ОСНОВЫ ГЕНЕТИЧЕСКОЙ ИНЖЕНЕРИИ
МОЛЕКУЛЯРНАЯ БИОЛОГИЯ — ФУНДАМЕНТ ГЕНЕТИЧЕСКОЙ ИНЖЕНЕРИИ
Стремительное развитие событий—характерная черта XX столетия. В полной мере это относится и к темпам научного прогресса. В короткий срок были созданы две совершенно новые технологии, радикально изменившие мир, в котором мы живем. Это — ядерная технология и электроника. Тем не менее, поразительна скорость, с которой входит в нашу жизнь третья технология XX в.— биотехнология — основа третьей революции в биологии.
Важной составной частью биотехнологии является генетическая инженерия. Генная инженерия позволяет уже сегодня диагностировать, а в недалеком будущем — лечить наследственные болезни. Борьба с раком, поиски возможностей лечения СПИДа — все это немыслимо без использования методов генетической инженерии.
Применение достижений генетической инженерии в сельском хозяйстве сулит крупные успехи. Это производство пищевого и кормового белка, утилизация веществ, вредных для окружающей среды, создание технологий безотходного производства, получение биогаза, выведение высокопродуктивных пород животных, новых сортов растений, устойчивых к болезням, гербицидам, насекомым, стрессовым воздействиям и т. д. Сейчас даже трудно предсказать все возможности, которые будут реализованы в ближайшие несколько десятков лет.
Клонирование фрагментов ДНК — основа генетической инженерии. Что же представляет собой генетическая инженерия? Академик А.А. Баев определяет генетическую инженерию, как: «Конструирование invitro функционально активных генетических структур (рекомбинантных ДНК), или иначе — создание искусственных генетических программ». Несколько иное определение дает профессор Э.С. Пирузян: «Генетическую инжене-
|
|
|
154
рию составляет система экспериментальных приемов, позволяющих конструировать лабораторным путем искусственные генетические структуры в виде так называемых рекомбинантных (гибридных) молекул ДНК». По сути эти определения не отличаются друг от друга. Речь идет о направленном, по заранее заданной программе конструировании молекулярных генетических систем вне организма с последующим введением их в живой организм. При этом рекомбинантные ДНК становятся составной частью генетического аппарата реципиентного организма и сообщают ему новые уникальные генетические, а следовательно, и биохимические, а затем и физиологические свойства. Цель прикладной генетической инженерии заключается в конструировании таких рекомбинантных молекул ДНК, которые при внедрении в генетический аппарат придавали бы организму свойства, полезные для человека.
|
|
|
Для решения такой задачи необходимо создать методики, позволяющие вырезать из молекул ДНК желаемые фрагменты, модифицировать их должным образом, реконструировать в одно целое и, наконец, размножить в большом числе копий (клонировать). Особенно впечатляет то, что, используя такие рекомбинантные ДНК, можно синтезировать молекулы РНК, а затем молекулы белка нужного размера и конфигурации, т. е. добиться выражения экспрессии гена, перемещенного из одного генетического окружения в другое.
Все эти процедуры стали возможны вследствие становления технологии рекомбинантных ДНК, где главный экспериментальный прием заключается в клонировании генов. Именно клонирование более, чем какой-либо другой фактор, изменило весь облик биологии.
Возникновение генетической инженерии связано, прежде всего, с развитием молекулярной биологии. Исследования, проведенные в этой области за последние 35 лет, позволили перейти от описания структуры функции клеток на уровне органелл к установлению молекулярных механизмов протекающих в них процессов (см. гл. 2).
В конце 60-х годов многие исследователи считали, что молекулярные механизмы фундаментальных генетических процессов — репликации, транскрипции, трасляции, а также система их регуляции в основном разгаданы. Стройное, логичное здание молекулярной биологии, казалось, было почти построено. Схема, показывающая строго однонаправленный поток генетической информации, ДНК — РНК—белок, была названа основной догмой молекулярной биологии и как бы свидетельствовала о незыблемости возведенного здания. Правда, основ-
|
|
|
155
ные положения этой схемы были показаны для Escherichiacoli , которая является прокариотическим организмом, не имеющим истинного ядра. Однако логичность и простота схемы давала возможность считать ее универсальной для всего живого, и в том числе для эукариотических организмов, имеющих ядро и хромосомы, к которым также относятся высшие растения, животные и человек. Появилось даже высказывание: «Что верно для Е. coli , то верно и для слона».
Но ясность и завершенность картины молекулярной организации генетического аппарата была лишь кажущейся. Ведь кодирование белков — это важная, но не единственная функция ДНК и, следовательно, содержащейся в ней информации. Необходимо было узнать, какова общая организация последовательностей ДНК, и каким образом отдельные гены — функциональные единицы ДНК — взаимодействуют друг с другом в геноме организма. Однако, несмотря на несомненные успехи молекулярной биологии прокариот, геном сложных организмов был недоступен для анализа. Изучение общих биохимических свойств клетки не давало надежды на установление деталей генетической организации. Для этого необходимо было, как минимум, научиться «разрезать» ДНК не в случайных, а в строго определенных местах, с точностью до одного нуклеотида. Возникла и другая проблема — невозможность определения последовательности нуклеотидов в ДНК. Знание генетического кода нельзя было применить, поскольку не было прочитано ни одного реально существующего генетического текста.
|
|
|
Что уж говорить о переносе генов. Не решив двух первых задач, нельзя было ни выделить гена, ни расшифровать его структуру и структуру последовательностей нуклеотидов, которые к нему примыкают и обеспечивают его экспрессию. Одна из причин такой ситуации заключается в том, что даже простейшие организмы содержат очень длинные молекулы ДНК (геном кишечной палочки составляет несколько миллионов нуклеотидных пар), а геном млекопитающих и человека содержит около трех миллиардов пар оснований, и это далеко не предел. В геноме содержится несколько десятков тысяч генов. Наибольшего интереса заслуживает изучение конкретных генов — задача, которая представлялась совершенно недоступной для решения.
Трудно, да, пожалуй, и невозможно было предвидеть, что в течение нескольких последующих лет стремительное развитие химических и энзимологических методов приведет к созданию рекомбинантных ДНК и положит начало новой науке — генетической инженерии, составной части современной биотехнологии.
156
Рестриктазы и их классификация. В основе метода, позволившего непосредственно приступить к манипуляциям с генами, лежит открытие ферментов, названных рестрикционными эндонуклеазами (рестриктазами). Еще в 1953 г. было обнаружено, что ДНК определенного штамма Е. coli , введенная в клетки другого штамма (например, ДНК штамма В в клетки штамма С), не проявляет, как правило, генетической активности, так как быстро расщепляется на мелкие фрагменты. В 1966 г. было показано, что это явление связано со специфической модификацией хозяйской ДНК — она содержит несколько метиллированных оснований, отсутствующих в немодифицированной ДНК, причем метилирование (добавление к основанию метильной группы — СН) происходит уже после завершения репликации. Таким образом, клетка-хозяин как бы «метит» свою ДНК по определенной последовательности, а чужую ДНК расщепляет, «узнав», что эти же последовательности не мечены.
В 1969 г. были открыты специфический модифицирующий фермент, метилирующий ДНК, и рестриктаза, которая расщепляла неметилированную ДНК- Однако этот фермент не был высокоспецифичен по отношению к определенной последовательности ДНК. Вскоре была выделена первая рестриктаза, которая расщепляла строго определенную последовательность ДНК.
Поскольку бактерии по-разному метят свою ДНК, то и рестриктазы должны узнавать разные последовательности. И, действительно, с тех пор выделены рестриктазы, узнающие более 150 сайтов рестрикции (мест расщепления ДНК).
Рестриктазы бывают мелко- и крупнощепящими. Первые узнают тетрануклеотид и вносят в молекулы гораздо больше разрывов, чем вторые, узнающие последовательность из шести нуклеотидных пар. Это связано с тем, что вероятность встречаемости определенной последовательности из четырех нуклеотидов гораздо выше, чем последовательности из шести нуклеотидов. Например, в ДНҚ бактериофага 17, состоящей из 40000 пар оснований, отсутствует последовательность, узнаваемая рестриктазой R1 из Е. coli .
Построение рестрикционных карт. Рестриктазы по-разному расщепляют ДНК- Одни вносят разрывы по оси симметрии узнаваемой последовательности, а другие—со сдвигом с образованием «ступеньки». В первом случае образуются так называемые «тупые» концы, а во втором — «липкие», т. е. фрагменты имеют на своих концах однонитевые взаимно комплементарные участки длиной в четыре нуклеотида. Такие фрагменты удобны для создания рекомбинантных ДНК (табл. 3.1).
157
|
|
Сайты узнавания рестриктазами симметричны относительно поворота на 180°, т. е. последовательность нуклеотидов слева направо в одной нити такая же, как справа налево в другой.
Ферменты рестрикции стали эффективным инструментом исследования. Они позволяют превращать молекулы ДНК очень большого размера в набор фрагментов длиной от нескольких сотен до нескольких тысяч оснований. С помощью метода электрофореза в агарозном геле фрагменты ДНК, различающиеся по размеру, можно легко разделить, а затем исследовать каждый фрагмент отдельно. Метод электрофореза основан на разделении молекул ДНК, движущихся с различной скоростью в электрическом поле. В растворе ДНК существует в виде аниона и при помещении раствора в конденсатор молекулы будут двигаться к положительной обкладке. Чем длиннее молекула, тем больше ее заряд и сила, но больше и сопротив-
158
ление среды. Однако сопротивление среды увеличивается с ростом длины иначе, чем сила. В результате молекулы данной длины будут двигаться с постоянной скоростью, которая будет зависеть от длины молекулы.
Если вышеупомянутую процедуру проделать в растворе, то разделения достигнуть не удастся. Поэтому гель-электрофорез осуществляют в носителе, которым служит гель-концентрированный раствор полимера. Отсюда и название метода. Гель образует трехмерную полимерную сеть, ячейки которой заполнены растворителем. Эта сеть придает конструкции жесткость и составляет по массе лишь несколько процентов геля. Таким образом, использование геля в качестве среды, где проводится электрофорез, позволило решить проблему разделения фрагментов ДНК.
Короткие фрагменты мигрируют намного быстрее, чем длинные. При сравнительно высокой концентрации агарозы большие фрагменты вообще не могут проникнуть в гель. В процессе миграции рестрикционные фрагменты не деградируют, их можно элюировать (вымывать) в виде биологически активных двуцепочечных молекул. При окрашивании гелей красителями, связывающимися с ДНК, выявляется набор полос, каждая из которых отвечает рестрикционному фрагменту, молекулярную массу которого можно определить, проведя калибровку с помощью ДНК с известными молекулярными массами (рис. 3.1).
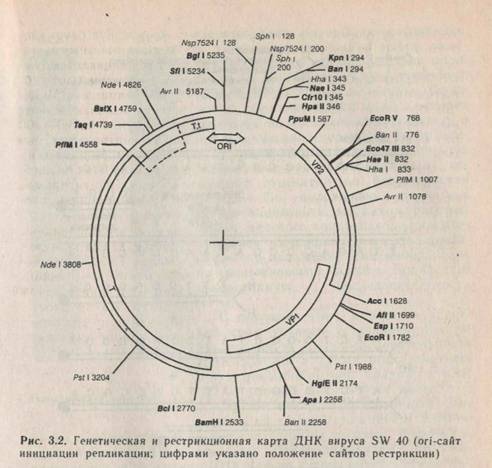
Использование электрофореза для разделения рестрикцион-ных фрагментов дает возможность получать рестрикционные карты. Первая карта была получена для вируса SW 40 (обезьяний вирус, вызывающий злокачественную трансформацию), содержащего 5423 пары оснований (рис. 3.2). Использовали рестриктазу HindII, расщепляющую кольцевую ДНК вируса на 11 фрагментов. Порядок их расположения в ДНК был установлен путем исследования наборов фрагментов, образующихся по мере того, как расщепление доходит до конца. Первый разрыв превращал кольцевую молекулу в линейную, которая затем расщеплялась на все меньшие фрагменты. Исследовали вначале наборы перекрывающихся фрагментов, а затем продукты полного расщепления. Таким образом была получена рестрик-ционная карта кольцевой вирусной ДНК, на которую были нанесены сайты расщепления рестриктазой. Повторив подобные эксперименты с другой рестриктазой, можно получить более подробную карту, где отмечено много сайтов рестрикции.
Располагая такой информацией, можно идентифицировать на ДНК биологически важные участки. Так, например, показано, что репликация вируса SW 40 всегда начинается в одном специфическом HindII фрагменте и продолжается в обоих направлениях. Для этого кратковременно метили реплицирую-
159
|
|
|
|
щуюся ДНК радиоактивными элементами, расщепляли образовавшиеся фрагменты Hind11 и сравнивали их с картой.
Затем рестрикционные карты и рестрикционные фрагменты были использованы для картирования участков ДНК, на которых синтезируются мРНК для вирусных белков.
Определение нуклеотидной последовательности. Методы, позволившие идентифицировать генетически важные участки ДНК, имели большое значение. Но они также способствовали разработке исключительно эффективных новых методов секвенирования ДНК и создания рекомбинантных молекул. Секвени-
160
рование позволяет довольно быстро определить полную нуклеотидную последовательность сегмента длиной 100—500 нуклеотидных пар, образующегося при расщеплении ДНК рестрикци-онными эндонуклеазами.
Один из методов основан на химической деградации ДНК.Он был предложен в 1977 г. Максамом и Гилбертом и назван их именем (рис. 3.3). Суть метода сводится к следующему: один из концов фрагмента ДНК метят с помощью изотопа фосфора 32Р; препарат меченой ДНК делят на четыре порции и каждую обрабатывают реагентом, специфически разрушающим одно или два из четырех оснований. Условия реакции подбирают таким образом, чтобы на каждую молекулу ДНК приходилось лишь несколько повреждений. При обработке поврежденных молекул пиперидином в ДНК образуется разрыв в том месте,
6-177161
|
|
|
|
где находилось разрушенное основание.
В результате получается набор меченых фрагментов, длины которых определяются расстоянием от разрушенного основания до конца молекулы. Фрагменты, образовавшиеся во всех четырех реакциях, подвергают электрофорезу в четырех соседних дорожках; затем проводят радиоавтографию, и фрагменты, содержащие радиоактивную метку, оставляют отпечатки на рентгеновской пленке. По положению отпечатковможно определить, на каком расстоянии от меченого конца находилось разрушенное основание, а зная это основание— его положение. Так набор полосна рентгеновской пленке определяет нуклеотидную последовательностьДНК.
С помощью этого метода за короткий срок удалось установить полную нуклеотидную последовательностьДНК SW 40, а также последовательность рекомбинантной плазмиды pBR 322, о которой речь пойдет ниже.
Другой метод, разработанный Сэнгером и названный его именем, основанне на химическом, а на ферментативном подходе. Ферменты, синтезирующие ДНК, называют ДНК-полимеразами. Они катализируют образование ДНК только в присутствии предсуществующих ДНК-матриц, и нуклеотидная последовательность новосинтезированных цепей ДНК комплементарна последовательности матриц.
Сэнгер использовал ДНК-полимеразу I. В клетке этот фермент участвует в процессе репликации, заполняя пробелы между вновь синтезированными фрагментами ДНК (фрагментами Оказаки). Для работы фермента в пробирке требуются предшественники ДНК — дезоксирибонуклеотидтрифосфаты (дНТФ), а также одноцепочечная матрица, на которой должен быть небольшой двуцепочечный участок — затравка, с которого начинается синтез.
Были синтезированы модифицированные предшественники — дидезоксирибонуклеотиды для каждого из четырех оснований ДНК- ДНК-полимераза включает эти предшественники в ДНК.
163
Однако, включившись в ДНК, модифицированное основание не может образовать фосфодиэфирную связь со следующим дезокси-рибонуклеотидом. В результате рост (элонгация) данной цепи останавливается (терминируется) в том месте, где в ДНК включился дидезоксирибонуклеотид (ддНТФ). Поэтому их называют .терминаторами элонгации.
Реакционная смесь по Сэнгеру состоит из цепи ДНК, нуклеотидную последовательность которой надо определить, короткого фрагмента меченой ДНК, комплементарной концевому отрезку этой цепи (затравка), одного из четырех ддНТФ и соответствующего дНТФ в строго определенном соотношении (чтобы они конкурировали), а также остальных трех дНТФ. Готовят четыре смеси, каждая из которых содержит один из четырех ддНТФ. В каждой из пробирок образуется набор меченых фрагментов, длина которых соответствует местоположению одного из четырех оснований. Меченые фрагменты ДНК разделяют в полиакриламидном геле (с точностью до одного нуклеотида), проводят радиоавтографию и по картине распределения фрагментов в четырех пробах устанавливают нуклеотидную последовательность ДНК (см. рис. 3.3).
В настоящее время определение точной нуклеотидной последовательности любого сегмента ДНК умеренной длины — вполне разрешимая задача. Уже определена последовательность нескольких сотен генов про- и эукариот. Зная последовательность гена и генетический код, легко определить аминокислотную последовательность кодируемого им белка. Раньше для определения структуры белка приходилось делать тщательный и весьма трудоемкий анализ выделенного и очищенного белка. Сейчас часто бывает проще определить структуру белка через нуклеотидную последовательность, чем с помощью прямого секвенирования. Если секвенирование белка занимает месяцы и даже годы, то ДНК удается секвенировать за несколько недель. Определение последовательности ДНК привело также к тому, что были обнаружены области, которые не кодируют белки, но принимают участие в регуляции экспрессии генов и репликации ДНК.
Сразу вслед за разработкой быстрых методов секвенирования появились столь же быстрые и простые методы синтеза сравнительно длинных олигонуклеотидов с определенной, заранее заданной последовательностью. Теперь за три-четыре дня можно синтезировать последовательность из 12—20 нуклеотидов. Автоматизация этой процедуры еще более облегчает и ускоряет синтез. Появились приборы — ДНК-синтезаторы, которые выполняют эту работу за несколько часов.
164
Дата добавления: 2021-01-20; просмотров: 390; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!