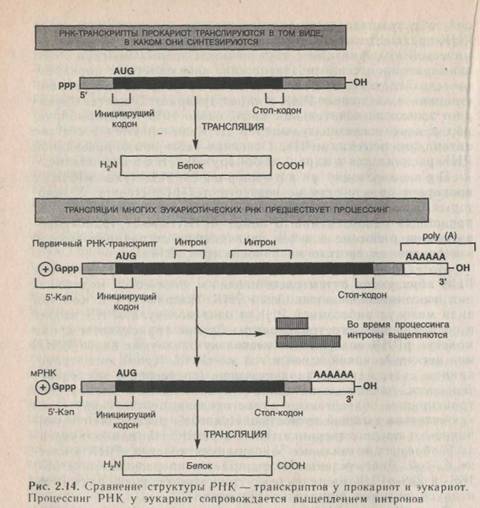
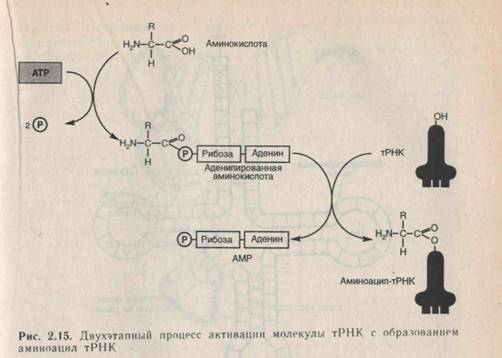
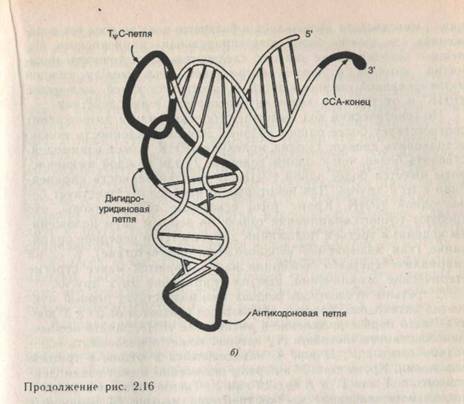
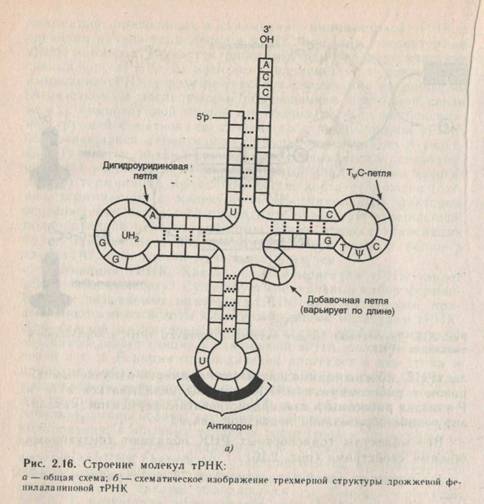
ВОЗНИКНОВЕНИЕ МОЛЕКУЛЯРНОЙ БИОЛОГИИ
Таинственные процессы размножения и зарождения новой жизни начали привлекать исследователей еще в XIII в. в период развития естествознания. К этому периоду относятся и первые научные эксперименты по гибридизации растений. Точные количественные исследования, позволяющие сформулировать генетические законы, были выполнены в 1856—1863 гг. чешским исследователем-любителем Грегором Менделем. Он первым сформулировал проблему и точно поставил эксперимент. Удачный выбор объекта (обычный горох) и тщательный анализ минимального количества признаков привели Менделя к открытию законов доминирования признаков и независимости комбинации различных признаков.
В своих работах Мендель вводит основную концепцию генетики: существует единица наследственности в виде некоторого дискретного фактора, который передается от родителей потомству. Иными словами, Мендель показал материальность и дискретность носителей наследственных свойств — генов.
В 1875 г. Оскар Гертвиг описал процесс оплодотворения как соединение двух клеток. Август Вейсман, обобщив исследования, касающиеся деления клеток, назвал ядра клеток носителями наследственных свойств. В 1873 г. Фридрихом Шнейдером в клеточном ядре были открыты «цветные тельца» — хромосомы. Вскоре выяснилось, что у каждого определенного вида растений или животных число хромосом в соматических клетках одинаково, а в половых клетках их в два раза меньше. При оплодотворении получается двойной набор хромосом, характерный для взрослых индивидуумов. Так эмбриология и цитология заложили надежную основу для исследования носителей наследственности.
|
|
|
В начале XX в. два цитолога Уолтор Сеттен и Теодор Бове-ри показали, что законы Менделя очень хорошо объясняют рас-
87
пределение хромосом при делении клетки. Было положено начало хромосомной теории наследственности.
В первой декаде XX в. в ряде исследований обнаружилось несоответствие полученных результатов с законами Менделя. Так, в 1906 г. Уильям Бетсон и Р. Пеннет, исследуя парные признаки, установили, что их распределение не согласуется с законами Менделя. Значительно позже стало понятно, что исследуемые признаки определяются большим числом генов и их анализ методами классической генетики крайне затруднителен.
Обнаруженные противоречия были, в сущности, предшествием нового открытия. И его сделал Томас Морган. Он сумел объединить данные статистики и результаты исследования процессов, происходящих в клетке. Объектом исследования была выбрана плодовая мушка дрозофила D . melanogaster , которая оказалась идеальным объектом для генетических исследований.
|
|
|
Изучая распределение наследственных признаков, Морган обнаружил, что они делятся на четыре связанные между собой группы. Это соответствует количеству хромосом в клетках дрозофилы. Он назвал этот феномен сцеплением генов. Установив, что определенный ген всегда присутствует в определенной хромосоме, Морган доказал, что гены находятся в хромосомах. Он также показал, что происходит обмен генетическим материалом между разными хромосомами. Этот процесс получил название кроссинговера.
Морган показал, что гены выстроены линейно по длине хромосомы. Экспериментальные данные привели его к замечательной идее о создании генетических карт. Стало возможным определять относительное расстояние между генами в хромосоме путем вычисления процента кроссинговера.
В опытах Моргана частота наблюдаемых мутаций была крайне низка. С развитием концепции гена стало ясно, что в основе мутации лежат химические изменения в веществе — носителе наследственной информации. К исследованию причин возникновения мутаций и возможностей их получения искусственным путем приступил ученик Моргана Г. Дж. Меллер. Он начал с облучения мушек светом и, наконец, в 1926 г. дошел до рентгеновских лучей. За год до этого Г.А. Надсон совместно с Г.С. Филипповым в СССР провели подобные опыты, подвергая дрожжи рентгеновскому излучению.
|
|
|
Эти эксперименты положили начало радиобиологии. Меллер добился почти 100%-ного уровня мутаций в потомстве дрозофил, что в тысячи раз превышает частоту мутаций в естественных условиях. Метод получения искусственных мутаций быстро нашел применение в селекционной практике. Уже в 1928 г. Л. Стедлер
88
успешно применил его к кукурузе. В 30-е годы биолог Н.В. Тимофеев-Ресовский и физик-теоретик Макс Дельбрук создали теорию мишени, объясняющую действие радиации.
Хромосомная теория наследственности явилась высшим достижением классической генетики. Хромосомные карты и возможность создания искусственных мутаций с помощью радиации или химических мутагенов оказались исключительно эффективными для селекционной работы. Чисто интуитивный искусственный отбор, осуществляемый в течение тысячелетий, превратился в точную науку, и это позволило существенно ускорить создание новых сортов.
Рождение молекулярной биологии. Методами формальной генетики было установлено, что ген — это дискретный фактор наследственности, часть хромосомы, и что он переходит от родителя к потомку. Однако, несмотря на большие достижения классической генетики, основная концепция этой науки — концепция гена — оставалась без материального содержания. Арсенал генетических методов не давал возможности выяснить химическую природу гена и объяснить, как гены управляют физиологическими процессами в клетке, как они осуществляют собственное удвоение в течение цикла клеточного деления.
|
|
|
Классическая генетика принципиально отличается от возникшей на ее основе молекулярной генетики. Основной единицей классической генетики является неделимый и абстрактный ген. Основная единица молекулярной генетики — конкретная химическая молекула — мономер, из сотен и тысяч которых состоит ген, т. е. ген играет роль вторичного агрегата элементарных единиц.
Исследование детальной физической и химической природы гена, молекулярных механизмов хранения и передачи информации — главная задача молекулярной генетики.
Молекулярная генетика — составная часть молекулярной биологии, науки, возникшей в середине XX в. Эта наука обязана своим развитием в значительной степени физикам и химикам, которые ставили своей задачей изучение структуры биологически важных макромолекул и познание молекулярных механизмов биологических процессов.
На протяжении многих лет самым главным классом макромолекул считали белки. Многие в то время предполагали, что и гены имеют белковую природу. Их сложная структура не поддавалась расшифровке теми методами, которыми в то время располагала химия. Кроме того, думали, что несмотря на то, что ген подчиняется тем законам физики, которые уже известны, изучение его свойств может привести к открытию новых за-
89
конов физики, присущим только живым системам. Известный ученый Г. Стент пишет об этом периоде так: «Многие физики, вдохновленные романтическим стремлением открыть другие законы физики через изучение генетики, оставили ту работу, к которой они были подготовлены, и обратились к проблеме природы гена. Вторжение этих людей в генетику и родственные ей области биологии в 40-х годах произвело в этой науке революцию, которая, когда пыль рассеялась, оставила в качестве своего наследия молекулярную биологию. В результате этой революции, в частности, из классической генетики развилась молекулярная генетика и к 1965 г., к столетию работы Менделя, природа гена была уже выяснена».
К исследованию структуры биологически важных микромолекул подошли с двух сторон. Одна из школ стремилась применить физические методы, в особенности рентгеноструктурный анализ, для определения трехмерной структуры макромолекул. В 1934 г. было показано, что дифракция рентгеновских лучей на монокристаллах белка позволяет проводить исследование их структуры с разрешением, близким к атомному. Впоследствии этот подход был применен к изучению структуры нуклеиновых кислот. Другая школа, возглавляемая Дельбрюком и Луриа, сосредоточила свои усилия на выяснении молекулярных механизмов генетических процессов, опираясь, в основном, на изучение вирусов бактерий (бактериофагов).
В 1943 г. Освальд Эйвери с сотр. показали, что носителем генетической информации является дезоксирибонуклеиновая кислота (ДНК). С этого времени многие исследователи сосредоточили свои усилия на изучении нуклеиновых кислот. И всего через 10 лет, в 1953 г., была создана модель ДНК (двойная спираль). Именно этот год принято считать годом рождения молекулярной биологии, поскольку открытие структуры ДНК объясняет, каким образом генетическая информация может быть записана в молекулах ДНК, и в то же время позволяет высказать предположение о химическом механизме самовоспроизведения этих молекул. В открытии ДНК наиболее ярко проявилась методология молекулярной биологии — исследование структуры макромолекул и ее связи с функцией.
ИССЛЕДОВАНИЕ ДНК
Ко времени открытия структуры ДНК история изучения нуклеиновых кислот насчитывала уже около восьмидесяти лет. Честь их открытия принадлежит швейцарскому биохимику
90
Фридриху Мишеру, который в 1868—1872 гг. выделил из ядер клеток гноя и спермы лосося новое фосфорсодержащее вещество, названное им нуклеином (от греч.— ядро). Примерно в те же годы Мендель старался убедить ученый мир в значении своей работы. До середины XX столетия никто не предполагал, что эти два открытия столь тесно связаны между собой. Работа Менделя пребывала в забвении до 1901 г., а результаты исследований Мишера в подробном изложении были опубликованы после его смерти — в 1890 г. Незадолго до этого, в 1889 г., немецкий химик Р. Альтман впервые получил свободный от белков нуклеин Мишера и предложил назвать его нуклеиновой кислотой.
К этому времени А. Коссель выделил основные составные части нуклеина: содержащие азот вещества — аденин и гуанин, фосфорную кислоту и соединения из группы углеводов. Впоследствии удалось установить, что в природе существует два типа нуклеиновых кислот ДНК и РНК (у последней сахар— дезоксирибоза — заменен на рибозу, а одно из четырех азотистых оснований — тимин — на урацил). Так как ДНК выделяли в основном из тимуса теленка, а РНК — из дрожжей и растений, то долгое время бытовало представление о том, что ядра клеток животных содержат только ДНК, а ядра клеток растений — только РНК- Только к середине 30-х годов было доказано, что ДНК и РНК содержатся в каждой живой клетке. С развитием методов цитохимии и гистохимии, а также методов фракционирования субклеточных структур к концу 40-х годов было установлено, что ДНК локализуется преимущественно в ядре, а РНК в цитоплазме клеток.
К началу 50-х годов были установлены основные принципы химического строения нуклеиновых кислот. Была выяснена структура их мономеров — нуклеозидов и нуклеотидов, и доказано, что и в ДНК, и в РНК нуклеотидные остатки связаны только 3' — 5'-фосфодиэфирной связью.
Гены состоят из ДНК. До 40-х годов исследование нуклеиновых кислот считалось весьма скучным и вообще бесперспективным занятием. Так продолжалось до 1944 г., когда Эйвери, Мак-Леод и Мак-Карти установили, что дезоксирибонуклеиновая кислота является носителем генетической информации. Это выдающееся открытие, приведшее к установлению химической природы генов. Его история ведет свое начало с 1928 г., когда Фред Гриффит провел эксперименты с заражением мышей пневмококками. Пневмококки вызывают пневмонию у человека и других чувствительных к ним млекопитающих. Они обычно окружены слизистой блестящей оболочкой — полисахаридной
91
капсулой. Этот наружный слой имеет существенное значение для проявления патогенности бактерий. Мутанты, лишенные полисахаридной оболочки, не патогенны. Патогенные бактерии дикого типа обозначают буквой S (от англ. smooth — гладкий), так как они образуют гладкие колонии, а мутантные бактерии, не имеющие капсулы, — буквой R (от англ. rougth — шероховатый), так как они образуют шероховатые колонии.
Гриффит обнаружил, что непатогенный мутант можно трансформировать в патогенную S-форму следующим образом. Он инъецировал мышам смесь живых бактерий R-формы и убитых нагреванием пневмококков S. При этом были получены поразительные результаты. Оказалось, что указанная смесь вызывала гибель мышей, хотя ни живые пневмококки, ни убитые нагреванием пневмококки, инъецированные порознь, смерти мышей не вызывали. В крови погибших мышей содержались живые S пневмококки. Следовательно, убитые нагреванием пневмококки каким-то образом трансформировали живые R- и живые S-пневмококки. Это изменение стабильно наследовалось: трансформированные пневмококки давали патогенное потомство S-формы.
Впоследствии R+S-трансформацию удалось воспроизвести в бесклеточной системе (invitro). Некоторые R-клетки в растущей культуре трансформировались в S-форму при добавлении бесклеточного экстракта убитых нагреванием пневмококков. Это открытие позволило установить химическую природу трансформирующего фактора.
Эйвери с сотр. в своих классических исследованиях показали, что трансформирующий фактор — это дезоксирибонуклеи-новая кислота. Новое доказательство трансформирующей активности ДНК было получено несколько позже, когда удалось очистить фермент дезоксирибонуклеазу, разрушающую ДНК. Было показано, что добавление этого фермента необратимо инактивирует трансформирующий фактор.
Публикация выводов Эйвери с сотр. в 1944 г. была встречена с большим удивлением и недоверием, так как едва ли кто-либо ранее придавал ДНК информационную роль. Вездесущему присутствию ДНК в хромосомах большей частью приписывали чисто физиологическую или структурную роль. В то же время считали, что именно хромосомный белок придает генам информационную роль, поскольку еще в начале XX в. были выявлены различия в специфичности белков у различных организмов. Авторы понимали трудность обоснования генетической роли ДНК и в заключительной части своей работы высказали следующее утверждение: «Если результаты представленного
92
исследования о природе трансформирующего начала подтвердятся, то придется признать, что нуклеиновые кислоты обладают биологической специфичностью, химическая основа которой еще не установлена».
В 1952 г. Альфред Херши и Марта Чейз доказали генетическую роль ДНК в совершенно иной системе — при изучении вируса (бактериофага), заражающего бактерию Е. coli . Когда фаги добавляют к бактериальной культуре, они адсорбируются на наружной поверхности бактерии и вводят в нее определенное вещество, в результате чего примерно через 30 мин бактерия разрывается (лизирует), высвобождая большое число новых фаговых частиц — потомков, адсорбированных фагов.
Эксперимент был поставлен следующим образом. Бактерии инфицировали фагом Т2, у которого радиоактивным изотопом метили либо ДНК-компоненты (изотопом фосфора — 32Р), либо белковые компоненты (изотопом серы — 35S). Фаги смешивали с бактериями и неадсорбированные частицы удаляли центрифугированием. Затем инфицированные бактерии энергично встряхивали и разделяли полученный препарат на две фракции путем центрифугирования. Одна фракция содержала пустые фаговые оболочки, отделившиеся от клеточной стенки бактерий, другая —сами бактерии. Анализ фракций показал, что S метка была связана с оболочками фага. Большая же часть метки 32Р оказалась внутри инфицированных бактерий. В потомстве фага после инфицирования было найдено примерно 30% исходной метки 32Р. А от исходного белка в фаговом потомстве обнаружили лишь менее 1%. Этот эксперимент прямо показывает, что родительская фаговая ДНК проникает в бактерию и затем становится частью фагового потомства. Именно так должно происходить наследование генетического материала.
Эксперименты Херши и Чейз убедительно подтвердили факты, открытые восемью годами раньше Эйвери с сотр. на другой системе, и результаты работы были сразу восприняты как доказательство генетической роли ДНК.
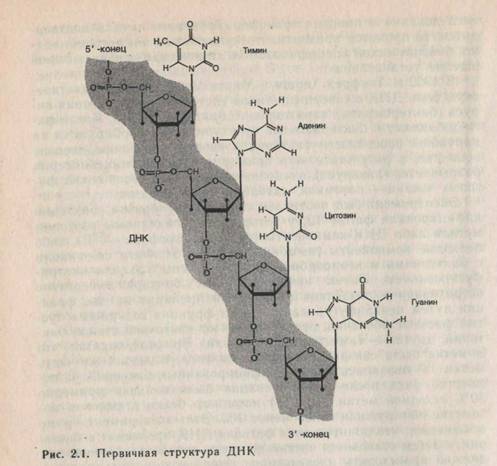
Компоненты и первичная структура ДНК. Нуклеиновые кислоты состоят из последовательности химически связанных между собой нуклеотидов, т. е. они представляют собой полинуклео-тиды. Каждый нуклеотид содержит гетероциклическое кольцо из атомов углерода и азота (азотистое основание), пятиуглеродное сахарное кольцо (пентозу) и фосфатную группу.
Между азотсодержащими кольцами, встречающимися в нуклеотидах, имеется родственная связь. Цитозин (Ц), тимин (Т) и урацил (У) называют пиримидиновыми основаниями, так как они представляют собой простые производные шестичлен-
93
|
|
ного пиримидинового кольца; гуанин (Г) и аденин (А) — пуриновые основания, второе пятичленное кольцо которых сконденсировано с шестичленным циклом (рис. 2.1).
Сахар, входящий в состав нуклеотида,— это пентоза, которая может присутствовать в одной из двух форм: β-D-рибоза и (β-D-2-дезоксирибоза. Различие между ними состоит в том, что гидроксильная группа рибозы при 2'-углеродном атоме пентозы замещена в дезоксирибозе на атом водорода. Нуклеотиды, содержащие рибозу, называются рибонуклеотидами и являются мономерными звеньями РНК, а нуклеотиды, содержащие дезоксирибозу, являются дезоксирибонуклеотидами, и из них строится ДНК.
Нуклеозид— это нуклеотид бесфосфатной группы (групп). Он образуется соединением одного из азотистых оснований с
94
пентозным кольцом посредством гликозидной связи между С'1—N-атомом пентозного кольца и NЗ-атомом пиримидина или N9 пурина. Чтобы избежать путаницы в нумерации атомов азотистых оснований и Сахаров, положение атомов углерода пентозы пишут со штрихом.
Одна, две или три фосфатные группы могут быть присоединены эфирной связью к 5'-углероду пентозы. Образующиеся при этом нуклеотиды соответственно называют нуклеозид-5'-моно-, нуклеозид-5'-ди- и нуклеозид-5'-трифосфатами и обозначают соответственно ХМФ, ХДФ и ХТФ, где X — то или иное азотистое основание. При физиологических значениях рН (близких к 7) основания не заряжены. Однако одна, две или три фосфатные группы, входящие в состав нуклеотида, являются кислыми и несут два, три или четыре отрицательных заряда
соответственно.
Нуклеотиды могут выступать в качестве переносчиков энергии. При этом трифосфатный эфир аденина (АТФ) гораздо чаще, чем другие нуклеотиды, участвует в переносе энергии между сотнями индивидуальных внутриклеточных реакций.
РНК и ДНК построены, соответственно, из связанных кова-лентно рибонуклеотидных или дезоксирибонуклеотидных звеньев, образующих полинуклеотидные цепи. Звенья соединяются между собой с помощью фосфоднэфирных мостиков, связывающих 5'-гидроксильную группу одного нуклеотида и З'-гидроксильную группу следующего. При этом образуется регулярная основная цепь (сахарофосфатный остов) фосфат — сахар— фосфат — сахар — и т. д. Азотистые основания присоединены к сахарам аналогично тому, как присоединены боковые группы в белках; они как бы «торчат» из сахарофосфатного остова.
Концевой нуклеотид на одном конце цепи имеет свободную 5'-группу, на другом конце З'-группу. Таким образом полинуклеотидная цепь обладает полярностью, и, согласно принятому соглашению, последовательность оснований читается в направлении от 5'- к З'-углеродному атому пентозы. О первом и последнем нуклеотидах говорят, что они находятся на 5'- и З'-концах цепи соответственно.
До 1950 г. доминировала тетрануклеотидная теория структуры ДНК, рассматривающая полинуклеотид как монотонную макромолекулу, состоящую из многократно повторяющихся наборов четырех нуклеотидов. Такая молекула, очевидно, не способна выполнять роль носителя генетической информации. В 1948 г. Хочкисс и Эрвин Чаргафф применили тогда еще новый метод хроматографии на бумаге для разделения и количе-
95
ственной оценки компонентов нуклеиновой кислоты. Этот метод давал возможность проводить более точный анализ нуклеотидных оснований, высвобождающихся при полном гидролизе ДНК. Анализы показали, что в противоположность требованиям тетрануклеотидной теории четыре азотистых основания не обязательно присутствуют в ДНК в точно равных соотношениях. Чаргафф проанализировал образцы ДНК, выделенной из разных организмов, и показал, что молярные соотношения оснований в молекуле ДНК могут варьировать в широких пределах в зависимости от ее биологического источника. Но если она не монотонна, то тогда вполне возможно, что именно состав ее оснований и обусловливает ее биологическую специфичность.
К 1952 г. удалось сформулировать теорию, объясняющую, каким образом ДНК может осуществлять перенос генетической информации в опытах с трансформацией. Основное положение этой теории сводилось к следующему: если молекула ДНК содержит генетическую информацию, то последняя определяется не чем иным, как специфической нуклеотидной последовательностью четырех нуклеотидных оснований в полинуклеотидной цепи. ДНК — двойная спираль. В 1953 г. Джеймс Уотсон и Френсис Крик установили трехмерную (вторичную) структуру ДНК и сразу же предложили механизм ее репликации (удвоения). Это блестящее достижение стоит в ряду важнейших событий в истории биологии, так как оно открыло путь к пониманию функции гена на молекулярном уровне. Не случайно 1953 год считают годом рождения молекулярной биологии.
Две группы фактов легли в основу модели ДНК- Первая связана с успешным использованием рентгеноструктурного анализа для изучения биологических макромолекул. Одним из первых исследователей, высказавших соображения о трехмерной структуре ДНК, был Астбюри (именно он ввел в 1940 г. термин «молекулярная биология»), который предположил, что полимер ДНК представляет собой стопку уложенных один над другим нуклеотидов. Его измерения показали также, что нук-леотидные остатки, ориентированные перпендикулярно длинной оси молекулы, располагаются вдоль оси через каждые 3,4 Ᾰ (1 ангстрем = 10-10 м). Группа исследователей, продолжившая рентгеноструктурные исследования ДНК, начатые Астбюри, и работавшая под руководством Уилкинса, достигла важного методического решения: им удалось приготовить высокоориентированные нити ДНК, на основе которых получили рентгенограмму, показывающую множество ранее не проявлявшихся деталей.
96
Уотсон и Крик к тому времени рассмотрели несколько возможных вариантов структуры ДНК, однако из-за плохого качества рентгенограмм им не удалось прийти к каким-либо определенным выводам. Рентгенограмма, полученная Розалиной Франклин, сотрудницей Уилкинса, помогла узнать недостающие детали, и в течение нескольких недель вопрос о структуреДНК был решен.
Определяющую роль в установлении структуры ДНК сыграли факты, полученные Чаргаффом при анализе нуклеотидного состава ДНК различных организмов. В его докладе, сделанном в 1950 г., можно найти следующее утверждение: «Полученные результаты служат опровержением тетрануклеотидной гипотезы. Следует, однако, отметить — хотя трудно еще сказать, не является ли это чистой случайностью,— что во всех изученных до сих пор дезоксирибонуклеиновых кислотах молярные отношения пуринов к пиримидинам в целом, а также аде-нина к тимину и гуанина к цитозину близки к 1". В этом утверждении впервые была сформулирована важная структурная особенность ДНК, подтвержденная последующими анализами: несмотря на довольно широкое разнообразие в составе (у бактерий молярная доза Г + Ц варьирует от 26 до 74%), проявляемое различными типами ДНК, молярное содержание тимина равно молярному содержанию аденина, так же как содержание гуанина равно содержанию цитозина.
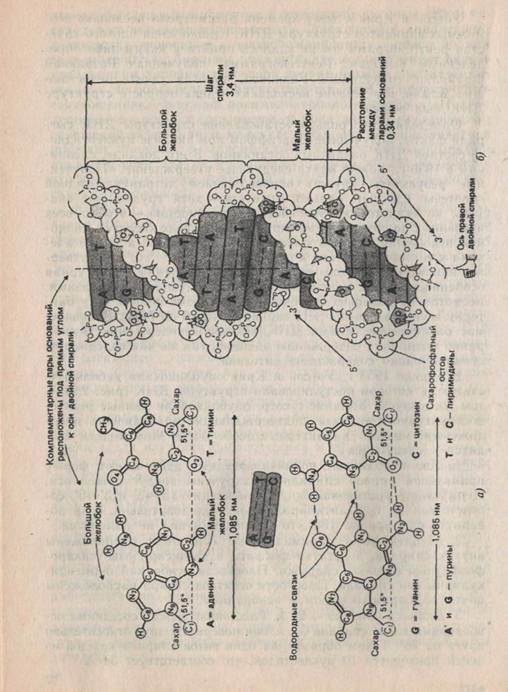
В апреле 1953 г. Уотсон и Крик опубликовали небольшую статью, в которой постулировали структуры ДНК (рис. 2.2). В том же выпуске Уилкинс с сотр. опубликовали данные рентгеноструктурного анализа, подтверждающие правильность предложенной модели. Характерные особенности этой модели сводятся к следующему.
1. Две спиральные полинуклеотидные цепи имеют форму правильной правой спирали и закручены вокруг общей оси. Цепи имеют противоположную ориентацию (5'→3' и 3'→5' соответственно), т. е. антипараллельны. Следовательно, если повернуть спираль на 180°, то ее внешний вид не изменится.
2. Пуриновые и пиримидиновые основания расположены внутри спирали, а остатки фосфата и дезоксирибозы (сахаро-фосфатный остов) — снаружи. Плоскости оснований перпендикулярны оси спирали. Плоскости остатков сахара расположены почти под прямым углом к основаниям.
3. Диаметр спирали — 20 А. Расстояние между соседними основаниями вдоль спирали 3,4 А, они повернуты друг относительно друга на 36°. Таким образом, на один виток спирали каждой из цепей приходится 10 нуклеотидов, что соответствует 34 А.
97
|
|
4. Две цепи удерживаются при помощи водородных связей между парами оснований. Аденин всегда спаривается с тимином, а гуанин с цитозином. Спаривание происходит таким и только таким образом; два пурина занимали бы слишком много места, а два пиримидина, наоборот,— слишком мало, так что регулярная спираль образоваться бы не могла.
5. На последовательность оснований в полинуклеотидной цепи не накладывается никаких ограничений. Определенная последовательность оснований несет конкретную генетическую информацию.
Важнейшее свойство двойной спирали — специфичность связывания оснований. Только при указанном порядке взаимодействия могут образоваться водородные связи и в то же самое время сохранится постоянный диаметр двойной спирали. Обязательное спаривание комплементарных нуклеотидов, с одной стороны, дает объяснение ранее загадочному правилу эквивалентности Чаргаффа, а с другой стороны, получает неожиданное подтверждение от него.
Однако основное значение открытия правил спаривания оснований для последующего развития молекулярной генетики лежит не в объяснении этих любопытных данных, а в признании того, что полная молекула ДНҚ является самокомплементарной: если наследственная информация записана в полинуклеотидной цепи в виде специфической последовательности четырех оснований, то каждая молекула ДНК несет два полных набора такой информации, хотя и написанной комплементарными буквами. Комментируя этот факт, авторы двойной спирали замечают: «От нашего внимания не ускользнул тот факт, что специфическое спаривание, которое мы постулировали, позволяет предполагать возможный копирующий механизм для генетического материала». Таким образом, информация, необходимая для воспроизведения ДНК, заложена в ее структуре.
Полиморфизм ДНК. Двуспиральную модель молекулы ДНК, предложенную Уотсоном и Криком, считают одним из несомненных фактов молекулярной биологии. Но в последнее десятилетие стало очевидным, что некоторые параметры классической В-формы нужно пересмотреть и даже что ДНК может образовывать другие типы двуспиральных структур. Таким образом, под полиморфизмом ДНК подразумевают способность двойной спирали принимать различные конформации.
Рис. 2.2. Комплементарное взаимодействие азотистых оснований (а). Расстояние между Сl'-атомами дезоксирибозы в двух цепях одинаковы для AT- и CG-пар и равны 1,085 нм. Схематическое изображение двойной спирали ДНК (б)
99
|
|
РЕПЛИКАЦИЯ ДНК
К одному из основных свойств генетического материала относится его способность передаваться из поколения в поколение. Для этого каждая клетка должна дублицировать (удваивать) свою ДНК перед очередным делением. В результате дочерние клетки получают такую же генетическую информацию, как и у родительских клеток. Процесс самовоспроизведения генетического материала и называется репликацией. Репликация лежит в основе размножения и развития живых организмов.
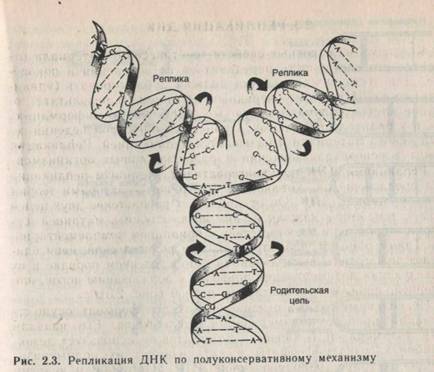
Репликация ДНК полуконсервативна. Механизм репликации был предложен Дж. Уотсоном и Ф. Криком — авторами теории двойной спирали ДНК. Он предполагает расплетение двух цепей ДНК с тем, чтобы каждая из них могла служить матрицей для сборки второй цепи в соответствии с принципом комплементарности. Таким образом, на матричной, или родительской, цепи одиночные нуклеотиды выстраиваются в определенном порядке и их последующая полимеризация приводит к образованию новой, или дочерней, цепи, комплементарной первой (рис. 2.3).
Несколькими годами позднее был открыт фермент, осуществляющий процесс полимеризации нуклеотидов. Его назвали ДНК-полимеразой. В качестве субстратов он использует дезоксирибонуклеозидтрифосфаты и катализирует их полимеризацию на матрице (одноцепочечной ДНК). Источником энергии служит гидролиз пирофосфата.
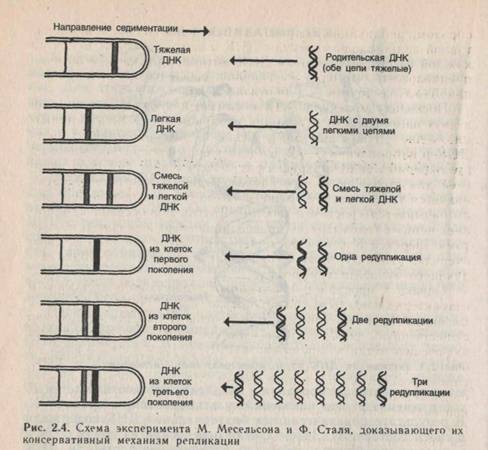
Предложенный механизм репликации был назван полуконсервативным, поскольку каждая из идентичных друг другу дочерних молекул состоит из одной старой и одной новой цепи ДНК. Первые доказательства полуконсервативной репликации были получены в экспериментах М. Мезельсона и Ф. Сталя. Они использовали метод равновесного ценрифугирования в градиенте плотности. Суть его состоит в следующем. Концентрированные растворы солей тяжелых металлов, например хлорид цезия, по своей плотности могут соответствовать плотности ДНК- Если ДНК в таком растворе подвергнуть длительному центрифугированию, то в пробирке сформируется градиент концентрации, а значит, и градиент плотности соли. ДНК при этом займет в пробирке вполне определенное положение, соответствующее своей плотности. В том случае, когда ДНК представлена смесью молекул разной плотности, центрифугирование приведет к разделению препарата на несколько фракций.
В экспериментах было использовано то обстоятельство, что ДНК, содержащая азот 14N, отличается по плотности от ДНК, содержащей изотоп 15N, и соответствующие молекулы разделя-
100
ются при центрифугировании в градиенте плотности. Клетки.£. coliв течение многих поколений культивировали на среде с N. В результате практически вся бактериальная ДНК содержала в своем составе l5N. Затем клетки переносили на среду с N и периодически брали пробы для определения плотности ДНК (рис. 2.4). Оказалось, что после первого деления на среде с 14 N плотность ДНК была промежуточной между (15N)ДНК и ( N) ДНК, а после второго деления ДНК разделилась на две фракции: одна с промежуточной плотностью, как после первого деления, а другая —с плотностью (14N) ДНК, причем фракции были равными. После третьего деления3/4, ДНК имела плотность (14N) ДНК и 1/4 — плотность (14N — 15N) ДНК- Соотношение и плотность фракций ДНК после каждого деления были в точности такими, как предсказывает модель полуконсервативной репликации.
Модель также предсказывает, что в ДНК с промежуточной . плотностью одна цепь тяжелая, а другая — легкая. С целью подтвердить это предположение фракция с промежуточной плотностью была выделена и денатурирована нагреванием. По-
101
|
|
следующее центрифугирование показало, что эта ДНК действительно состоит из цепей с различной плотностью.
Опыты, таким образом, полностью подтвердили правильность модели полуконсервативной репликации и стали первым весомым аргументом в пользу двойной спирали Уотсона — Крика.
Новая цепь ДНК синтезируется в направлении 3' →5'. Как уже отмечалось, для репликации необходимо локальное распле-тение двойной спирали в той области, где ДНК в данный момент служит матрицей для синтеза дочерних нитей ДНК. Эта расплетенная часть молекулы называется репликативной вилкой. Ее можно наблюдать, если во время репликации на короткое время добавить радиоактивные («меченые») предшественники ДНК и экспонировать молекулы ДНК на рентгеновской пленке. Такое мечение ДНК называется импульсным. Таким
102
образом, репликация сопровождается перемещением репликативной вилки вдоль молекулы ДНК и синтезом новых цепей на каждой из старых. Но цепи ДНК антипараллельны, и логично предположить, что одна из дочерних цепей растет в направлении 5'→3' а другая — в противоположном, 3'→5'.
Поскольку молекула ДНК несимметрична, для репликации в двух направлениях нужно два различных фермента репликации— две ДНК-полимеразы. Одна из них наращивает цепь ДНК в направлении 5'→3', и тогда каждый очередной мономер (дезоксирибонуклеозидтрифосфат) обеспечивает сам себя энергией для присоединения к растущей цепи (носителем энергии является трифосфатная группа). Такой рост на полимерной цепи называется «ростом с хвоста». Другая полимераза наращивает цепь «с головы», т. е. присоединяет новый мономер к богатому энергией 5'-концу растущей цепи. Этот мономер, в свою очередь, использует свой трифосфат для присоединения следующего нуклеозидтрифосфата.
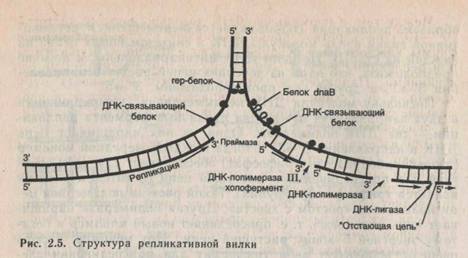
Однако у прокариот и у эукариот обнаружены, выделены и охарактеризованы (см. ниже) только 5'→3' ДНК-полимеразы. Возникает проблема синтеза другой цепи ДНК. Для ее решения существенную роль сыграли эксперименты по импульсному включению метки во время синтеза ДНК. Если метка дается на очень короткие промежутки времени, она включается в ДНК, синтезированную в последний момент. Мечеными оказываются те области новых цепей, которые расположены сразу за репликативной вилкой. Исследования размеров меченой ДНК показали, что при репликации бактериальной ДНК сначала на некоторое время образуются фрагменты длиной 1000—2000 нуклеотидов. Эти фрагменты назвали по имени их первооткрывателя — фрагменты Оказаки. При репликации эукариотической ДНК длина фрагментов Оказаки составляет 100—200 нуклеотидов. Было также показано, что синтез фрагментов идет в направлении от 5' к З'-концу, и впоследствии они соединяются в длинные цепи ДНК. Так возникло представление, согласно которому синтез ДНК на обеих матрицах идет в направлении 5'→3' (от хвоста к голове). Но на одной из цепей новая ДНК синтезируется непрерывно, а на другой— фрагментами, стыкующимися в единую полимерную молекулу. Первая из цепей называется лидирующей, другая — отстающей (рис. 2.5). Таким образом, на отстающей нити синтез идет в направлении 5'→3', а сама цепь растет в направлении 3'→5'. Это напоминает шитье «иголкой назад».
ДНК-полимераза — основной фермент репликации. Основные принципы и механизмы репликации сходны у прокариот и
103
|
|
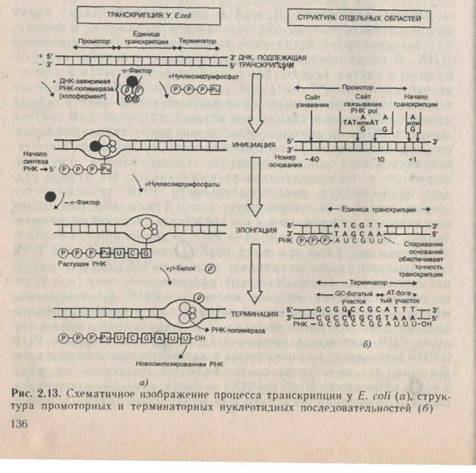
у эукариот. Лучше всего изучена репликация у Е. coli . Основным ферментом репликации у Е. coliявляется ДНК-полимера-за III. Это сложный комплекс белковых молекул, состоящий из семи субъединиц с общей молекулярной массой около 700 кило-дальтон (кД). Некоторые из субъединиц сами по себе обладают полимеразной активностью, но репликацию в клетке (invivo) осуществляет весь фермент, или холофермент. Перед связыванием с матрицей холофермент образует комплекс с АТФ, и последний гидролизуется в процессе связывания. Фермент связывается с ДНК практически необратимо, т. е. остается на матрице до окончания репликации. Скорость синтеза ДНК составляет около 1000 нуклеотидов в секунду (!).
В клетках эукариот обнаружены четыре ДНК-полимеразы. Аналогом ДНК-полимеразы III считают эукариотическую ДНК-полимеразу а (альфа). Во время S-фазы клеточного синтеза его количество существенно увеличивается, и он в основном ведет синтез ядерной ДНК. Молекулярная масса фермента — 500 кД. Скорость репликации примерно в 10 раз ниже, чем в прокариотических клетках (около 100 нуклеотидов в секунду).
Самокоррекция ДНК-полимеразы. Механизм репликации должен обеспечивать безошибочное копирование матрицы. Включение в новую' цепь ДНК некомплементарных нуклеотидов влечет за собой возникновение мутаций, которые могут привести к генетическим изменениям, нарушающим структуру и функции генетического материала. Последствия таких мутаций сказываются негативно, а иногда пагубно для жизни клетки и всего организма.
104
Между тем в нормальной ДНК довольно часто (с частотой 10-5—10-6) на короткое время возникают редкие таутомерные формы каждого из оснований. Такие измененные нуклеотиды при репликации могут спариваться с некомплементарными основаниями. Например, с цитозином может образовать пару аденин, а не гуанин. После возвращения нуклеотида в нормальное состояние водородные связи распадаются и нуклеотиды оказываются неспаренными.
Для избежания ошибочного спаривания ДНК-полимеразы обладают способностью к самокоррекции. Корректирующий механизм заключается в том, что перед присоединением каждого последующего нуклеотида к растущей цепи ДНК фермент «проверяет» правильность спаривания предыдущего нуклеотида. Если нуклеотиды спарены правильно (т. е. в соответствии с принципом комплементарности), полимераза присоединяет следующий нуклеотид, который впоследствии также будет проверен. Если же произошла ошибка спаривания, «неправильный» нуклеотид отщепляется от цепи ДНК. Затем проверяется нуклеотид, предшествующий вырезанному, и так далее. Вырезание нуклеотидов происходит из-за того, что ДНК-полимераза обладает кроме полимеразной еще и 3'→5'-экзонуклеазной активностью. Когда полимераза, отщепив неспаренный нуклеотид или несколько нуклеотидов, дойдет до нормально спаренных нуклеотидов, восстанавливается ее полимеразная активность, и синтез ДНК продолжается до обнаружения очередной дефектной пары.
Используя систему самокоррекции, ДНК-полимераза ведет синтез с исключительно высокой быстротой и точностью. В среднем одна ошибка приходится на 109 нуклеотидов. Геном Е. coliимеет размер 4,2 х 106 нуклеотидов. Это значит, что при репликации 200 геномов допускается всего одна ошибка.
Присутствие у фермента корректирующей способности означает, что для инициации репликации на матрице ему необходим хотя бы короткий участок двуцепочечной ДНК, с которого начинается синтез комплементарной цепи. Такой участок называется праймером, или затравкой. Можно говорить, что всякий самокорректирующий фермент для начала работы нуждается в затравке. Справедливо и обратное утверждение: всякий фермент, требующий для работы затравки, обладает способностью к самокоррекции.
Структура репликативной вилки. Репликативная вилка асимметрична. Для синтеза лидирующей цепи, который идет непрерывно, затравка нужна только в начале полимеразной ре-
105
акции. Полимераза, ведущая синтез запаздывающей цепи, нуждается в затравке перед синтезом каждого фермента. Существует специальный фермент, создающий затравки. Он называется РНК-праймаза и синтезирует из рибонуклеозидтрифосфатов короткие РНК-праймеры длиной около 10 нуклеотидов. Из вышесказанного ясно, что этот фермент не нуждается в затравке, а значит, он не способен к самокоррекции. Такой фермент делает ошибки примерно в 1000 раз чаще, чем самокорректирующий. Ясно, что после синтеза фрагментов Оказаки праймер нужно удалять. В противном случае до 10% (у эукариот длина фрагментов Оказаки 100—200 н. п.) ДНК будет содержать огромное, по сравнению с нормой, число ошибок.
Для удаления праймеров и застраивания образовавшихся брешей в действие вступает особая система репарации ДНК. Основную роль здесь играет ДНК-полимераза IЕ. coliи аналогичные ферменты других организмов. У эукариот это, по-видимому, ДНК-полимераза р. ДНК-полимераза I—это первый из открытых ферментов, катализирующих полимеризацию нуклеотидов. Сначала его считали основным ферментом репликации, а позднее установили его репарирующую роль. ДНК-полимеразу I можно представить как два фермента на одной полипептидной цепи. Первый называется фрагментом Кленова и обладает полимеразной и корректирующей (3'→5'-экзонуклеазной) активностями. Другой фрагмент способен отщеплять нук-леотиды в направлении 5'→3', т. е. в направлении синтеза ДНК- Эта 5'→3'-экзонуклеазная активность и дает возможность удалять затравку.
Синтез ДНК на запаздывающей цепи состоит, таким образом, из следующих этапов.
1. РНК-праймаза синтезирует затравки на некотором (равном длине фрагментов Оказаки) расстоянии друг от друга;
2. ДНК-полимераза IIIсинтезирует фрагменты ДНК, начиная с З'-конца затравки и заканчивая на 5'-конце предыдущей затравки;
3. ДНК-полимераза I продолжает синтез фрагментов ДНК в направлении 5'→3', одновременно удаляя затравку в том же направлении;
4. Фрагменты ДНК «сшиваются», т. е. образуется фосфодиэфирная связь между началом предыдущего и концом последующего фрагментов.
Целесообразен ли такой сложный механизм синтеза запаздывающей цепи? На этот вопрос можно ответить положительно, если принять во внимание то обстоятельство, что при синте-
106
зе в направлении голова—хвост энергию для присоединения следующего нуклеотида несет уже присоединившийся нуклеотид. Если произойдет коррекция, этот нуклеотид будет удален и присоединение следующего станет невозможным. Таким образом, синтез в направлении 3'→5' вести нецелесообразно, и плата за это — усложнение механизма синтеза одной из цепей ДНК.
Понятно также, почему затравки состоят не из дезоксирибо-нуклеотидов. Они подлежат удалению, поскольку содержат много ошибок, и «метятся» необычными для ДНК рибонуклеотидами, которые распознаются ДНК-полимеразой как «чужие».
Топоизомеразы. Две цепи ДНК, согласно модели Уотсона — Крика, образуют двойную спираль. Для того чтобы каждая из цепей стала матрицей для синтеза новой цепи, необходимо, чтобы нити ДНК расплелись. Эту функцию в процессе репликации выполняют специальные белки, называемые ДНК-геликазами. Молекула геликазы движется перед ДНК-полимеразным комплексом и раскручивает спираль ДНК в репликативной вилке, используя энергию гидролиза АТФ.
При расплетении спирали ДНК в нерасплетенной части должно возникнуть напряжение, которое приведет к положительной суперспирализации и вращению молекул ДНК. Это обстоятельство было высказано, как аргумент против полуконсервативного механизма репликации. В действительности ни вращения, ни положительной суперспирализации не происходит. Топологические проблемы «решает» группа ферментов, способных изменять степень спирализации ДНК. Они называются топоизомеразами.
Топоизомеразы типа I могут снимать избыточную спирали-зацию. Они вносят временный разрыв в одну из цепей ДНК в области перед репликативной вилкой и дают, таким образом, спирали ДНК вращаться вокруг своей оси, снимая при этом избыточное напряжение и восстанавливая затем разорванную цепь;
Другой фермент, топоизомераза типа II, связывается на время с обеими цепями двойной спирали и вносят в нее временный двуцепочечный разрыв, удерживая при этом разорванные концы. Благодаря этому ферменту можно распутать сложные переплетения и узлы, которые возникают между дочерними молекулами ДНК после их синтеза. Кроме того, такая топоизомераза совершенно необходима при репликации кольцевых молекул ДНК для разъединения двух дочерних кольцевых молекул.
107
Важную роль в репликации играет еще один класс белковых молекул. Они называются SSB белки, или белки, связывающиеся с ДНК. SSB белки, связываясь с одноцепочечной ДНК, делают ее более доступной для ферментов репликации и способствуют дальнейшему расплетению двойной спирали. Белки препятствуют возникновению в одноцепочечной ДНК структур, препятствующих репликации, например, шпилек.
Репликон. Процесс репликации бактериальной ДНК непрерывен. Начавшись в одной точке, репликация продолжается до тех пор, пока вся ДНК не удвоится. Таким же образом реплицируются плазмиды бактерий, бактериофаги и вирусы. В смысле репликации все они представлены как единица репликации, которая получила название репликон. Другими словами, их геномы представляют собой монорепликонные структуры.
Место, где начинается репликация, называется сайтом инициации репликации, или ориджином репликации (оrі). Орид-жин репликации представляет собой определенную последовательность нуклеотидов в ДНК- Эта последовательность способствует расплетению ДНК (образуется так называемый «репликационный глаз»), и на ней собирается репликативный комплекс белков. На ориджине может образоваться одна или две репликативные вилки. В первом случае репликация называется однонаправленной, а во втором—двунаправленной. При двунаправленной репликации образуются две репликативные вилки, перемещающиеся в противоположных направлениях. Монорепликонные геномы имеют кольцевую структуру, и картина их репликации напоминает греческую букву тета. Поэтому структуры ДНК, образующиеся при репликации кольцевых молекул ДНК, называют θ-структурами.
Специфичность ориджина определяется тем, что его распознает специальный белок (или белки), с ним связывающийся и участвующий в инициации синтеза. Сама ДНК-полимераза в инициации синтеза белка не участвует. Она начинает синтез после того, как праймаза синтезирует затравку. У бактерий и некоторых вирусов длина ориджина репликации составляет около 300 нуклеотидных пар (н. п.).
Размер генома эукариот в тысячи раз превосходит размер бактериального генома и представлен несколькими молекулами ДНК, которые сложным образом компактизованы. Вместе с тем, скорость репликации эукариотической ДНК на порядок ниже, чем у прокариот. Репликация происходит в фазе S клеточного цикла, протяженность которого составляет несколько (5—10) часов. Репликация столь большого количества ДНК за
108
столь короткий промежуток времени осуществляется посредством разделения каждой хромосомы на множество отдельных репликонов. Таким образом, в любой момент S-фазы только некоторые из репликонов вступают в репликацию.
У многих высших эукариот расстояние между соседними точками инициации составляет (1—2)*105 н. п. Это расстояние соответствует среднему размеру репликона. Отсюда следует, что в гаплоидном геноме млекопитающих содержится 20000—30000 репликонов. До сих пор не ясно, как регулируется инициация репликации у столь большого количества репликонов. Не ясно также, как репликационный аппарат отличает уже отреплицировавшиеся репликоны от тех, которым предстоит реплицироваться, т. е. существует запрет на повторную репликацию в пределах одного клеточного цикла. Иногда этот запрет нарушается, что приводит к появлению нескольких копий одного и того же участка хромосомы. Такое явление называется амплификацией.
Итак, несмотря на принципиальное сходство механизмов репликации у прокариот и эукариот, последние представляют по-лирепликонную структуру со сложным механизмом регуляции инициации репликонов.
РЕПАРАЦИЯ ДНК
Высокая стабильность генетического материала. После рассмотрения процесса репликации ясно, что генетическая информация копируется с исключительно высокой степенью точности. Это связано с тем, что замены оснований в молекуле ДНК могут вызвать мутации, приводящие к нарушениям клеточных функций и гибели клеток. Следовательно, допустимы низкие частоты возникновения мутаций для сохранения жизни. Таким образом, как зародышевые, так и соматические клетки должны быть надежно защищены от генетических изменений.
Анализ частоты аминокислотных замен показывает, что белок среднего размера, состоящий из 400 аминокислот, изменяется случайным образом в результате одной аминокислотной замены приблизительно один раз в 200 000 лет. Некоторые белки настолько консервативны, что даже такая низкая частота изменения аминокислот неприемлема для их нормального функционирования. Например, в молекуле гемоглобина одна замена на каждые 100 аминокислот происходит за 6 млн. лет. Гистон Н4 изменяется в сто раз медленнее. Особи, у которых замены происходят чаще, элиминируются естественным отбором. Это — еще одно подтверждение тому, что сохранение нук-
109
|
|
леотидных последовательностей — необходимое условие сохранения жизни.
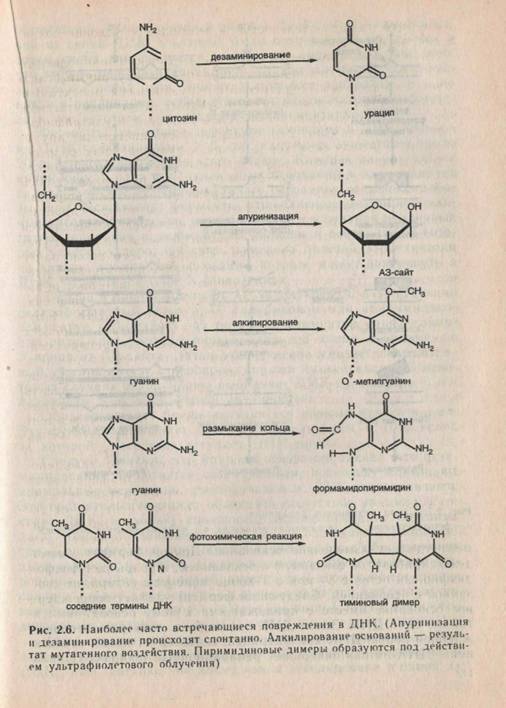
Между тем нуклеотиды в составе ДНК постоянно подвергаются изменениям, вызванным тепловыми флуктуациями вследствие беспорядочных соударений с окружающими молекулами. Изменения также происходят в результате действия мутагенов, клеточных метаболитов, космической радиации и ультрафиолетового облучения (рис. 2.6). Наиболее часто происходит апуринизация — потеря остатков аденина и гуанина из-за разрыва N-гликозидной связи между пурином и дезоксирибозой. За сутки каждая клетка человеческого организма претерпевает 5000 актов апуринизации. Другое нарушение — дезаминирование цитозина в результате потери аминогруппы, которое происходит в клетке 100 раз в сутки. Дезаминированию подвергаются также другие основания. Многие канцерогены алкилируют (например, метилируют) основания. Иногда может происходить разрыв пуринового кольца. Такое нарушение препятствует репликации. Ультрафиолетовое излучение Солнца вызывает образование димеров тимина за счет образования ковалентной связи между соседними тиминами в одной из цепей ДНК. Нарушения оснований в ДНК должны исправляться. Процесс ликвидации генетических нарушений называется репарацией.
Прямая и эксцизионная репарация. Наиболее простой путь репарации некоторых повреждений — прямая реактивация. Так, например, фермент метилтрансфераза может переносить метильную или этильную группу с алкилированного основания на один из собственных остатков цистеина. При этом фермент инактивируется, но сохраняет способность регулировать активность собственного гена.
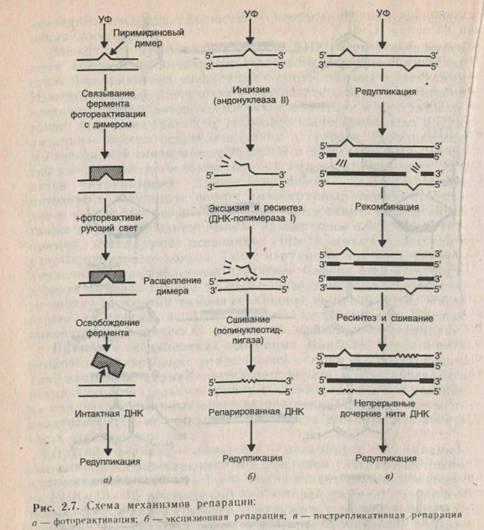
Другой фермент — фотолиаза — репарирует пиримидино-вые димеры, образовавшиеся под действием ультрафиолетового излучения (220—230 нм). В его состав входит короткая молекула РНК (10—15 нуклеотидов), без которой фермент теряет активность. Фотолиаза способна обнаружить пиримидиновый димер и прочно связаться с ним. В результате облучения образовавшегося комплекса видимым светом происходит фотохимическая реакция «расшивания» димера, т. е. разрушение специфических ковалентных связей. В результате этой фотохимической реакции восстанавливается нормальная структура ДНК и фермент теряет сродство к ней (рис. 2.7, а).
Прямая реактивация—это частный случай репарации. В клетке также функционирует универсальный механизм репарации, который называется эксцизионная репарация (рис. 2.7, б). Ее принцип заключается в следующем. Специфический фер-
110
|
|
мент удаляет измененное основание. Другой фермент узнает дезоксирибозу, не связанную с основанием, и разрывает фосфо-диэфирный остов с 3'- или с 5'-конца молекулы сахара, не связанной с основанием. Следующий фермент удаляет поврежденное основание вместе с прилежащими к нему основаниями в той же цепи ДНК. Затем ДНК-полимераза, пользуясь неповрежденной цепью ДНК как матрицей, синтезирует новый отрезок цепи. ДНК-лигаза завершает репарационный процесс, сшивая
112
остающийся одноцепочечный разрыв. Таким образом, часть одной из цепей ДНК, в которой было повреждение, удаляется и затем снова синтезируется в исходном виде, вследствие того, что вторая, неповрежденная, цепь служит матрицей для синтеза отрезка новой цепи. Значит, в процессе репарации, так же как и в репликации, используется механизм матричного синтеза в соответствии с принципом комплементарности.
Ферменты, узнающие дефектные основания в ДНК,называют) ДНК-гликозилазами. У Е. coli , например, существует около 20 различных ферментов этого класса. Каждый из них узнает какой-нибудь один тип измененных оснований и катализирует гидролитическое отщепление такого основания от дезоксирибозы.1 В их число входят ферменты, отщепляющие дезаминирован-ные цитозин или аденин, алкилированные основания различных типов, основания с разомкнутым кольцом и основания, в которых углерод-углеродная связь заменена простой. Практически на каждое аномальное основание, которое может возникнуть в ДНК, существует своя N-гликозилаза.
Дальше в работу вступают АР-эндонуклеазы, разрывающие сахарофосфатный остов в АР (апуриновом или апиримидиновом) сайте. Существует два типа этих ферментов, один из которых разрывает фосфодиэфирную связь с З'-конца, а другая — с 5'-конца от АР-сайта. Затем экзонуклеаза удаляет поврежденный участок вместе с неповрежденными нуклеотидами. В некоторых случаях эту функцию выполняет ДНК-полимераза I, обладающая 5'-экзонуклеазной активностью.
Образовавшаяся брешь заполняется новыми нуклеотидами. Эту функцию выполняет ДНК-полимераза I (см. с. 106), вслед за которой в действие вступает ДНК-лигаза.
Следует отметить, что природа оснований такова, что дезаминирование не остается незамеченным, поскольку возникают аномальные основания, распознаваемые ДНК-гликозилазами. Это обстоятельство может объяснить отсутствие урацила в составе ДНК, поскольку спонтанное дезаминирование цитозина дает урацил. Наиболее простой из пуринов — гипоксантин — специфически связывается с цитозином с образованием двух водородных связей. Но гипоксантин — продукт дезаминирования аденина. Гуанин образуется при добавлении к гипок-сантину второй аминогруппы и уже не является продуктом дезаминирования. Так эволюция создала пару Г — Ц с тремя водородными связями.
Здесь следует отметить, что процесс репарации может объяснить присутствие, казалось бы, избыточной информации в ДНК. Если генетическая информация закодирована в одной из
113
цепей, то вторую цепь можно рассматривать как резервную, по которой информацию можно восстановить в процессе репарации. Лишь в крайнем случае, когда одновременно повреждаются оба основания в паре, в клетке не остается правильной копии для репаративного синтеза.
Ряд повреждений ДНК вызывает нарушения двойной спирали. К ним относится возникновение под действием ультрафиолета пиримидиновых димеров или нарушения в результате взаимодействия оснований ДНК с объемистыми углеводородами. Для репарации такого рода повреждений используется несколько иной путь. Повреждения распознаются и удаляютсй с участием фермента эндонуклеазы UvrABC. Этот фермент разрывает фосфодиэфирные связи с обоих концов поврежденного участка. Затем фермент хеликаза II удаляет поврежденйый участок. Реакция сопряжена с гидролизом АТФ. И, наконец, ДНК-полимераза I застраивает образовавшуюся брешь.
SOS- репарация. В ответ на увеличение повреждений в ДНК клетка может мобилизовать дополнительные репаратив-ные ресурсы. Такая репарация называется индуцируемой. Она используется клеткой, когда повреждений в ДНК становится настолько много, что жизнь клетки поставлена под угрозу. Поэтому систему индуцируемой репарации называют SOS-системой, или системой SOS-репарации.
Индукция SOS-системы тонко настроена. При незначительных повреждениях возрастает уровень некоторых репаративных белков, работавших и до индукции. При увеличении числа повреждений блокируется деление клеток (при успешном устранении дефектов оно восстанавливается) и включается часть генов SOS-системы. При очень сильном повреждении ДНК включаются все гены репарации. При SOS-репарации специальные белки подавляют самокорректирующую активность ДНК-поли-меразы III, давая ей возможность удлинять цепь ДНК, последний нуклеотид в которой не спарен с матрицей. Это дает возможность провести репликацию на поврежденной ДНК и спасти клетку ценой увеличения числа мутаций.
Репарация — процесс достаточно энергоемкий, поэтому индукция SOS-системы происходит только при условиях благоприятного энергетического баланса клетки. С другой стороны, степень индукции SOS-системы отражает степень неблагополучия генома, а значит, и шансы клетки на выживание. Например, для некоторых умеренных бактериофагов индукция SOS-системы является сигналом для размножения и уничтожения клетки-хозяина, чтобы спастись самому.
114
В результате ошибок репликации и репарации в ДНК могут находиться некомплементарные пары нуклеотидов. Такие Нарушения также репарируются. Вся сложность здесь заключается в том, как отличить, в какой цепи правильный, а в какой неправильный нуклеотид, подлежащий замене на комплементарный правильному. Т. е. нужно уметь отличать старую и новосинтезированную цепи ДНК.
Некоторое время новая цепь ДНК может отличаться от матричной присутствием одноцепочечных разрывов или брешей, а также тем, что старая цепь метилирована, а вновь синтезированная ДНК полуметилирована.
Со временем ДНК метилируется полностью, но пока отличие существует, система репарации удаляет неспаренный нуклеотид на неметилированной цепи. Механизм репарации сходен с механизмом эксцизионной репарации.
Еще одни механизм репарации связан с рекомбинацией и будет рассмотрен в следующем параграфе.
РЕКОМБИНАЦИЯ
Механизм генетической рекомбинации включает в себя молекулярные процессы, которые приводят к перераспределению нуклеотидных последовательностей. Рекомбинация обусловливает большое число разнообразных биологических явлений. Однако события, приводящие к рекомбинации, делятся на два больших класса. Это общая рекомбинация и сайт-специфическая рекомбинация.
Общая, или гомологичная, рекомбинация. Этот тип рекомбинации характерен для всех живых организмов. При гомологичной рекомбинации происходит обмен участками гомологичных, т. е. близких по нуклеотидной последовательности участков молекул ДНК- Классический пример общей рекомбинации— обмен участками гомологичных хромосом в мейозе.
У разных организмов последовательность событий, приводящих к рекомбинации, может быть различной, но в целом результаты общей рекомбинации всегда одинаковые: I) две гомологичные двойные спирали разрываются, и концы одного гомолога соединяются с концами другого так, что получаются две спирали ДНК со взаимозамещенными участками; 2) точка обмена может находиться в любом участке гомологичных молекул ДНК; 3) в точке обмена две молекулы ДНК соединяются ступенчато, а длина ступеньки может составлять до нескольких тысяч пар оснований; 4) в точке обмена ни один нуклеотид не
115
|
|
исчезает, не добавляется и не превращается в другой нуклеотид, т. е. гомологичная рекомбинация внутри гена не приведет к потере его активности за счет мутации или сдвига рамки считывания.
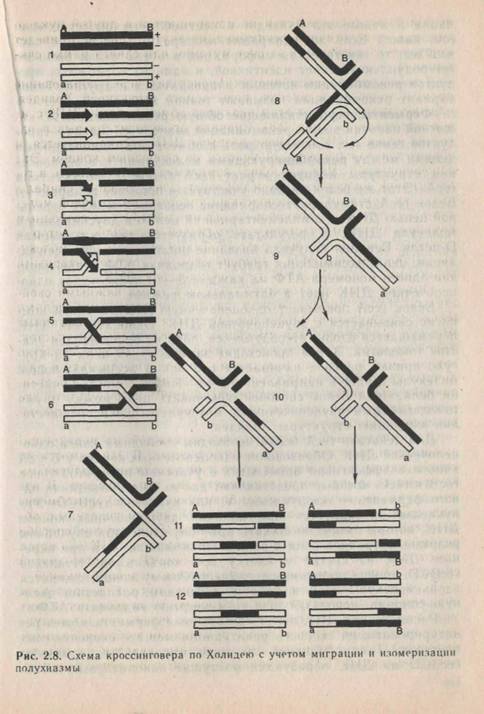
Гомологичная рекомбинация происходит через образование промежуточного соединения, называемого структурой Холидея, или полухиазмой. Этот этап включает обмен цепями ДНК с их перекрещиванием (рис. 2.8). Сначала происходит разрыв в одной из цепей ДНК. В районе разрыва ДНК деспирализуется, и образуется одноцепочечный участок со свободным концом. Эта одноцепочечная ДНК «находит» комплементарную область в гомологичной молекуле ДНК и образует с ней двойную спираль, вытесняя при этом одноцепочечный участок гомологичной молекулы. Последний, в свою очередь, взаимодействует со свободным комплементарным участком гомологичной молекулы, в котором произошел инициирующий разрыв. Таким образом, две молекулы ДНК обмениваются одноцепочечными комплементарными участками с образованием гетеродуплексной ДНК.
Образовавшаяся структура обладает двумя важными свойствами. Точка обмена между двумя гомологичными цепями (точка скрещивания) может перемещаться вдоль гомологичных молекул, увеличивая или уменьшая гетеродуплексный участок. Такой процесс называется миграцией ветвей. Второе свойство заключается в том, что полухиазма может существовать в различных изомерных формах, возникающих при вращении составляющих элементов друг относительно друга. В результате две ранее перекрещивающиеся цепи становятся неперекрещиваю-щимися и наоборот.
Для разделения гетеродуплекса в каждой из перекрещивающихся цепей должен произойти разрыв. В зависимости от того, в каком из изомерных состояний находилась полухиазма во время разрыва, могут возникнуть два типа обменов. В одном случае окажется, что рекомбинирующие молекулы обменялись сравнительно короткими одноцепочечными участками, образовавшими гетеродуплексные районы. При другом способе рекомбинации часть каждой исходной спирали ДНК окажется присоединенной (ступенчатым соединением) к части другой спирали. Такой обмен называют собственно рекомбинацией.
Если рекомбинация пошла по первому пути, т. е. привела к образованию гетеродуплексных районов, то судьба последних может быть двоякой. Если неспаренные основания гетеродуплекса не репарируются, то после репликации в образовавшихся молекулах ДНК возникнут двуцепочечные участки из гомологичной молекулы ДНК, вступившей в обмен. В случае рекомби-
116
нации в мейозе это приведет к постмейотическои сегрегации (см. ниже). Если же репарация неспаренных оснований произойдет, то генетическая информация в обеих цепях бывшего гетеродуплекса станет идентичной, и один из возможных продуктов рекомбинации исчезнет и превратится в другой. Такой вариант рекомбинации называют генной конверсией.
Ферменты, осуществляющие общую рекомбинацию. У кишечной палочки общая рекомбинация зависит от белков — продуктов генов rec. Ключевую роль в обмене комплементарными цепями между рекомбинирующими молекулами и в образовании структуры Холидея играет гесА белок — продукт гена гесА. (Этот же белок активно участвует в процессе репарации.) Белок гесА стимулирует спаривание оснований между отдельной цепью ДНК и комплементарной ей цепью в двуспиральной молекуле ДНК- В результате образуется так называемая D-петля. Реакция получила название поглощение, или ассимиляция, цепи. Ассимиляция требует гидролиза АТФ и при наличии одного мономера АТФ на каждые 5—10 нуклеотидов одно-цепочечной ДНК идет в оптимальном режиме.
Белок гесА покрывает одноцепочечную ДНК, и такой комплекс связывается с двуцепочечной ДНК. Однонитиевая ДНК перемещается вдоль гетеродуплекса, пока не будет найден участок гомологии. Затем происходит замена одной цепи на другую, причем перенос начинается с З'-конца ассимилирующей молекулы и идет в направлении 3'→5'. Иначе говоря, с участием белка гесА белок способен обменивать цепи между двумя гомологичными двуцепочечными молекулами ДНК, осуществляя миграцию структуры Холидея.
Для действия гесА белка необходим свободный конец одно-цепочечной ДНК. Образование одноцепочечных концов у Е. coliнаиболее эффективно происходит с участием продуктов генов гесВ и гесС, которые представляют две из трех субъединиц одного фермента — экзонуклеазы V, или нуклеазы recBCD. Эта нуклеаза активируется при наличии двуцепочечных концов ДНК, которые могут возникать при облучении, при случайном разрыве матричной цепи в репликативной вилке или при переносе ДНК из клетки в клетку при конъюгации. Нуклеаза recBCD, присоединившись к двуцепочечному концу, движется вдоль молекулы ДНК и, подобно геликазам, расплетает двойную спираль, используя при этом энергию гидролиза АТФ.
Расплетенная ДНК после прохождения фермента может ре-натурировать, но скорость ренатурации меньше скорости расплетения. Таким образом, по мере продвижения нуклеазы recBCD на ДНК образуются растущие однонитиевые петли.
118
Если фермент встречает на своем пути определенную нуклеотидную последовательность, называемую χ-сайтом, он вносит в нее одноцепочечный разрыв. В результате одна из петель превращается в длинный однонитиевый «хвост», который может быть использован гесА белком для инициации гомологичной рекомбинации.
Одноцепочечные разрывы возникают под действием многих факторов, в частности γ-лучей и рентгеновских лучей. Указанные воздействия могут также инициировать генетическую рекомбинацию. Например, в клетках позвоночных в S- и G-фазах митотического цикла эти факторы индуцируют обмены между двумя сестринскими хроматидами каждой хромосомы, которые можно наблюдать с помощью особой методики окрашивания хромосом.
RecAи recDCD белки действуют кооперативно с SSB белком, который предохраняет одноцепочечную ДНК от действия нуклеаз и облегчает реакции спаривания. Мутации по гену ssb заметно ослабляют рекомбинацию.
Рекомбинация завершается разрезанием полухиазмы. Какие ферменты отвечают за эту реакцию у Е. coli , не ясно. Однако специализированные ферменты, специфически разрезающие структуру Холидея, удалось выделить из клеток, зараженных фагом Т4 или Т7.
В гомологичной рекомбинации могут принимать участие и топоизомеразы. Например, образование D-петель существенно облегчается, если ДНК имеет отрицательную сверхспирализацию, которую создает ДНК-гираза. С участием топоизомеразы I две рекомбинирующие молекулы могут комплементарно спариваться в отсутствии свободных одноцепочечных концов.
Участие рекомбинации в репарационных процессах. Наличие повреждений в ДНК активирует системы репарации и рекомбинации. По крайней мере, у бактерий эти два процесса связаны между собой. Репарация некоторых типов повреждений вообще невозможна без образования гомологичного дуплекса ДНК и может происходить только рекомбинационным путем (рис. 2.7, В).
При репликации в ДНК возникают одноцепочечные разрывы и бреши. Это происходит, когда репликативная вилка продвигается через поврежденный участок ДНК до того, как репа-ративные системы успели устранить повреждение. Одна из цепей в таком случае окажется дефектной, и комплементарная цепь напротив поврежденного участка не будет синтезирована. Чтобы репарировать образовавшуюся брешь, нужно использо-
119
вать и качестве эталона второй полученный при репликации дуплекс ДНК- Это возможно при гомологичной рекомбинации. Как видно из рис. 2.7, в, и поврежденная, и недореплицированная ДНК при рекомбинации окажутся в дуплексе с неповрежденной ДНК и могут быть репарированы обе. Аналогично, за счет гомологичной рекомбинации, и только за счет нее, происходит репарация двуцепочечных разрывов.
Рекомбинация может происходить между гомологичными генами соматических клеток или при вегетативном росте одноклеточных эукариот. Большинство случаев такой митотической рекомбинации связаны с репарацией. С точки зрения репарации можно объяснить возникновение сестринских хроматидных обменов, которые так же, как и митотическая рекомбинация, стимулируются воздействиями, повреждающими ДНК- Обмен сестринскими хроматидами есть не что иное, как обмен между идентичными копиями одной и той же хромосомы. Однако с репарационной точки зрения, такой обмен может исправлять одно- и двуцепочечные разрывы.
Ферментативный аппарат, осуществляющий рекомбинацию у эукариот, пока не известен. Есть данные, указывающие, что центральную роль в рекомбинации должен играть белок, подобный гесА белку. Такой белок выделен у низших эукариот. Выделен также белок дрожжей, способный разрезать полухиазмы и по свойствам напоминающий аналогичные белки фагов Т7 и Т4.
Мейотическая рекомбинация. В мейозе у эукариот гомологичные хромосомы, полученные от родителей, расходятся по разным клеткам. Перед расхождением гомологичные хромосомы спариваются на всем своем протяжении и образуют в профазе первого деления мейоза особую структуру—синаптоне-мальный комплекс. Считается, что эта структура способствует рекомбинации между гомологами. Такой рекомбинационный обмен, кроссинговер, играет в мейозе важную роль. Места связывания хромосом называются хиазмами. В первом делении мейоза хиазмы, возникшие в результате гомологичной рекомбинации, выполняют роль центромер в митозе. Результатом мейо-тической рекомбинации может быть как генная конверсия, так и постмейотическая сегрегация. Значит, этот вид рекомбинации проходит через образование полухиазм и гетеродуплексных участков. Кроме обеспечения нормального расхождения гомологов, мейотическая рекомбинация играет очень важную эволюционную роль, которая будет рассмотрена ниже.
Специализированные системы гомологичной рекомбинации. Выше были описаны системы рекомбинации, выполняю-
120
щие общие функции. Однако существуют и специализированные системы гомологичной рекомбинации, обеспечивающие вполне определенные частные процессы. На одной из таких систем мы остановимся подробнее.
Многие паразиты для борьбы с иммунной системой организмов-хозяев используют систему общей рекомбинации. Так, у гонококков— бактерий, вызывающих гонорею, на поверхности клеток есть ворсинки — пили. Пили являются одним из основных факторов вирулентности: они обеспечивают прикрепление гонококков к клеткам эпителия мочеполовой системы. Пили состоят из белка — пилина. В геноме бактерий много генов, кодирующих иммунологически различные варианты пилина. Однако экспрессируется только тот ген, который находится в области ріlЕ. Он и определяет, какой пилин представлен на поверхности клетки.
Довольно часто в результате утраты гена ріlЕ бактерия лишается пилей. Однако в результате гомологичной рекомбинации один из альтернативных генов пилина, находящийся в другом локусе (pilS), «перемещается» в локус pilE. Рекомбинация идет в результате взаимодействия «остатков» прежнего гена и гомологичных нуклеотидных последовательностей гена из локу-са pilS. Таким образом, бактерии меняют иммунологические свойства пилей и не позволяют развиться эффективному иммунному ответу.
Подобную «стратегию» использует возбудитель возвратного тифа Во relli а, который за счет гомологичной рекомбинации меняет структуру поверхностного белка, распознаваемого иммунной системой человека. Эукариотический болезнетворный агент — возбудитель сонной болезни Tripanosomabruseiиспользует тот же способ ускользания от действия защитных средств организма.
Сайт-специфическая рекомбинация. Этот тип рекомбинации не требует протяженных участков гомологии: в рекомбинационное событие вовлекаются специфичные последовательности нуклеотидов и специальный ферментативный аппарат. В пределах рекомбинирующих последовательностей имеется короткая область гомологии, присутствие которой хотя и необходимо, но недостаточно для осуществления рекомбинации. В каждом конкретном случае сайт-специфическая рекомбинация выполняет строго определенную функцию, а нуклеотидные последовательности, вовлекаемые в обмен, и ферменты специфичны для каждого случая. Однако в общих чертах механизм сайт-специфической рекомбинации всегда одинаков.
121
|
|
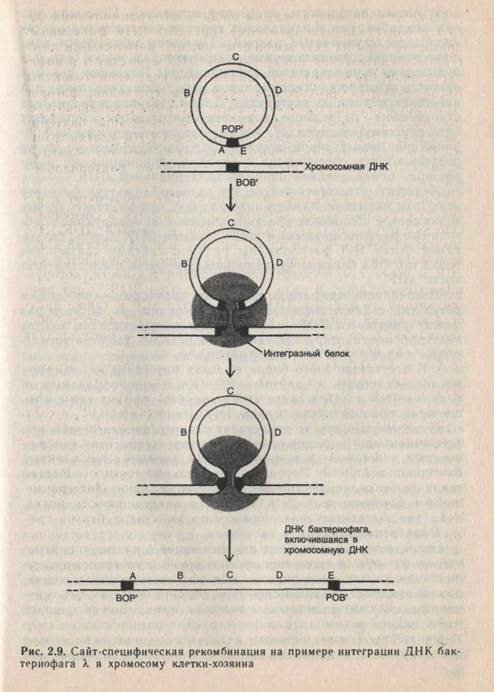
В качестве примера опишем процесс интеграции генома фага λв бактериальную хромосому (рис. 2.9). ДНК фага может проходить один из двух жизненных циклов: литический и лизогенный. В литическом цикле фаговая ДНК существует в инфицированной бактерии в виде независимой кольцевой молекулы. Когда бактерия находится в лизогенном состоянии, фаговая ДНК представляет собой составную часть бактериальной хромосомы и называется профагом. Для лизогенизации бактерии свободная ДНК фага должна внедриться в ДНК клетки-хозяина. При выходе из лизогенного состояния происходит обратный процесс — исключение профага из хромосомы бактериальной клетки.
Интеграция и исключение фаговой ДНК происходит в результате рекомбинации, которая осуществляется в специфических областях (локусах) бактериальной и фаговой ДНК. Эти локусы названы сайтами присоединения, или att-сайтами. Сайт присоединения на бактериальной хромосоме обозначается как attB и состоит из нуклеотидной последовательности, которую можно представить в виде трех компонентов ВОВ'. Сайт присоединения на фаговой ДНК обозначается attP и также представлен тремя компонентами POP'. Последовательность, обозначенная О, является общей для attB и attP и представляет собой сайт рекомбинации между ними.
После внедрения фаговой ДНК в хромосому профаг ограничен двумя новыми att-сайтами, которые обозначаются attL и attR. Каждый из этих сайтов также состоит из трех компонентов: сайт attL представлен последовательностями ВОР', а сайт attR — РОВ'. Видно, что в результате интеграции происходит перекомбинация исходных последовательностей. Таким образом, при интеграции и при исключении фаговой ДНК взаимодействуют различные последовательности нуклеотидов. Различаются и белки, осуществляющие эти две реакции. Интеграция требует продукта фагового гена int и бактериального белка INT. Реакция исключения помимо двух указанных белков требует продукта фагового гена XIS.
Последовательность О является общей для всех сайтов. Именно по этой области гомологии и происходит кроссинговер. Она называется сердцевинной или кор-последовательностью. Фланкирующие (примыкающие) ее области В,В' и Р,Р' рассматриваются по отношению к ней как отличающиеся друг от друга «плечи».
Удалось расшифровать последовательности att-сайтов. Все они представляют собой АТ-богатые области, включающие об-
122
щую последовательность из 15 пар оснований. Показано, что при рекомбинации в одинаковых коровых последовательностях происходят ступенчатые разрезы. При этом образуются комплементарные одноцепочечные концы, которые могут быть использованы в перекрестной гибридизации. Подобная реакция происходит между «липкими» концами, образующимися под действием некоторых рестриктаз. Длина «уступа» в результате ступенчатого разрезания кор-последовательности составляет пять или семь нуклеотидов. Таким образом, во время рекомбинации обе цепи двойной спирали ДНК бактериофага на время разрываются и соединяются с концами точно таких же разорванных цепей двойной спирали бактериальной ДНК.
Фермент, ответственный за эту реакцию (продукт фагового гена int), называют лямбда-интегразой. С его участием происходит тесное сближение участков обмена и инициируются необходимые реакции разрыва и воссоединения ДНК. Сайты связывания белка INT расположены рядом с сайтами связывания белка inf. Оба белка покрывают большую часть последовательности attP.
Выщепление профага из клеточной хромосомы — это также результат сайт-специфической рекомбинации, но на этот раз между участками ВОР и РОВ, которые находятся на концах интегрированной вирусной ДНК. Эта реакция также асимметрична и идет с участием дополнительного белка (продукта гена xis). В отсутствие этого белка фаговая интеграза не способна взаимодействовать с сайтом attR. Комплекс, образованный белками INT и X1S в сайте attR, способен спариваться с комплексом, образованным белком INT в сайте attL.
В некоторых случаях происходит так называемая незаконная рекомбинация. В результате образуются дефектные фаговые частицы, у которых часть фаговой ДНК замещена прилежащей бактериальной ДНК. Перенос бактериальных генов с помощью таких фагов получил название трансдукции. До разработки методов рекомбинантных ДНК трансдуцирующие фаги использовали для выделения генов, примыкающих к att-сайту.
Роль рекомбинации в эволюции. Кроме непосредственных функций, которые выполняет рекомбинация в клетке, она играет важную роль в эволюции организмов. В животном мире существуют те или иные способы обмена генетическим материалом. У эукариот главным способом, обеспечивающим рекомбинацию, служит половое размножение. В результате мейотической рекомбинации формируются разнообразные сочетания генов. Таким образом, создается возможность отбора благоприятных комбинаций генов, т. е. геномов. В отсутствие
124
рекомбинации генетический материал каждой хромосомы был бы фиксирован в ее аллелях и размер мишени для мутационных повреждений увеличился бы от одного гена до целой хромосомы. В результате перераспределения генов полезные мутации отделяются от вредных и проверяются в новых сочетаниях. Таким образом, благодаря рекомбинации, хромосому, с эволюционной точки зрения, можно рассматривать как структуру, состоящую из временно связанных аллелей.
Рекомбинация может приводить к возникновению мульти-генных семейств, состоящих из генов со сходными, но различными функциями. Рекомбинация способствует также «унификации» множественных высокогомологичных генов (например, генов, кодирующих гистоны). С другой стороны, рекомбинация обеспечивает перераспределение ограниченного числа генов, что значительно увеличивает число комбинаций, которые они могут создавать (например, гены иммуноглобулинов).
ГЕНЕТИЧЕСКИЙ КОД
Носителем генетической информации является ДНК. Эта информация «переписывается» на молекулу РНК, а последняя, в свою очередь, служит матрицей для синтеза молекулы белка. Значит, в ДНК записана информация о структуре белковых молекул, и посредником при передаче этой информации выступает молекула РНК.
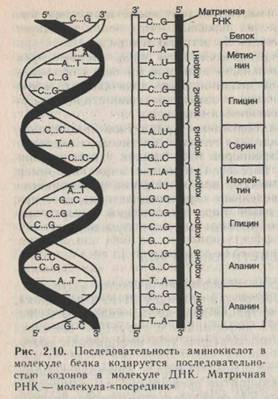
Белковые молекулы образуют сложные пространственные структуры, но общий принцип их организации заключается в том, что структуры высшего порядка определяются непосредственно структурой низшего порядка, т. е. последовательностью аминокислот в белковой молекуле. Таким образом, в молекуле ДНК записана информация о первичной структуре белковой молекулы (рис. 2.10).
ДНК представляет собой однородную по длине двуцепочеч-ную молекулу, и ее структура не зависит от последовательности пар оснований. Значит, последовательность оснований в полинуклеотидной цепи имеет значение не для самой структуры ДНК- С точки зрения структуры ДНК именно эта последовательность и несет информацию о последовательности аминокислот в белковой молекуле. Ген и его продукт коллинеарны. В состав ДНК входят четыре азотистых основания, а белковые молекулы включают 20 различных аминокислот. Каким же образом на четырехбуквенном языке нуклеотидов записана информация о двадцатибуквенном языке аминокислот? Это и есть проблема генетического кода. Иными словами, генетический
125
|
|
код устанавливает взаимоотношения между по-
следовательностью нук-
леотидов в ДНК и последовательностью аминокислот в молекуле белка.
Генетические исследо вания. Поскольку аминокислот больше, чем нук-
леотидов, каждая аминокислота должна кодироваться определенной комбинацией нуклеотидов, называемой кодоном. Число нуклеотидов, определяющих аминокислоту, соответствует кодовому отношению. Минимальное кодовое отношение должно равняться трем, так как двух нуклеотидов для кодирования аминокислот недостаточно, поскольку число комбинаций двух нуклеотидов равно 16, а аминокислот — 20. Число комбинаций из трех нуклеотидов составляет четыре, т. е. 64. Этого вполне достаточно, чтобы закодировать все аминокислоты. С другой стороны, избыточное число триплетов предполагает, что либо не все триплеты участвуют в кодировании аминокислот, либо одна и та же аминокислота может кодироваться несколькими триплетами, т. е. генетический код вырожден.
Идея триплетности кода была высказана в 1954 г. в статье известного физика Г.А. Гамова.
Наиболее простой способ кодирования состоит в том, что триплетные кодоны расположены друг за другом и считываются последовательно. Однако были высказаны предположения, что кодоны могут перекрываться, а следовательно, данное основание может входить в состав более чем одного кодона и определять более чем одну аминокислоту. В таком случае набор возможных соседей каждой аминокислоты в молекуле белка должен быть огра-
126
ничен. Гамов исследовал известные к тому времени аминокислотные последовательности и показал, что не существует аминокислот, которые никогда не встречаются рядом.
Окончательно неперекрываемость кода была доказана при исследовании последовательности аминокислот белка оболочки мутантов вируса табачной мозаики. Было показано, что в результате мутации, вызывающей замену оснований, синтезируется белок с одной изменённой аминокислотой.
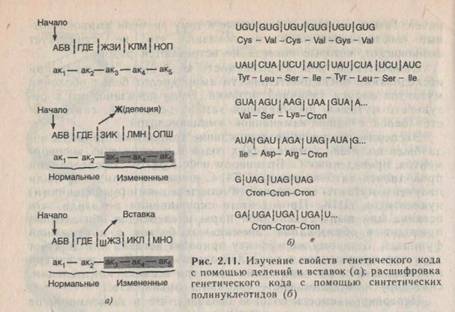
Экспериментальное подтверждение триплетной природы кода было получено в начале 60-х годов в генетических экспериментах, проведенных С. Бреннером и Ф. Криком. Исследования проводились на бактериофаге Т4. С помощью акридинов были получены мутанты со вставками или делециями (выпадениями) нуклеотидов ДНК. Проведенные скрещивания показали, что вставка или выпадение одной пары нуклеотидов обязательно приводит к образованию аномальных белков с нарушенной функцией. К такому же эффекту приводит вставка или делеция двух пар нуклеотидов в пределах одного гена. Если же внутри небольшой области гена происходит три вставки или делеции, синтезируемый белок часто сохраняет активность.
Неперекрываемость кодонов означает, что в зависимости от стартовой точки возможны три варианта считывания генетической информации. Если для считывания используется только одна рамка, то при добавлении или удалении одного или двух нуклеотидов происходит сдвиг «рамки считывания». При этом нуклеотидная последовательность в новой рамке будет совершенно иной и в ней будет закодирована последовательность аминокислот, лишенная функционального смысла. В случае трех вставок или делеций активность белка восстанавливается. При этом происходит добавление и потеря одной аминокислоты, но рамка считывания восстанавливается (рис. 2.11, а). Измененная часть белка ограничена участком между крайними мутациями.
Таким образом были установлены основные свойства генетического кода: 1) каждую аминокислоту кодирует определенная комбинация из трех нуклеотидов (кодон), т. е. код трипле-тен; 2) кодоны не перекрываются, а следуют друг за другом без «знаков препинания»; 3) последовательность оснований читается последовательно, начиная со строго определенной (фиксированной) стартовой точки, т. е. генетическая информация записана только в одной из рамок считывания (за редкими исключениями, которые мы рассмотрим позже).
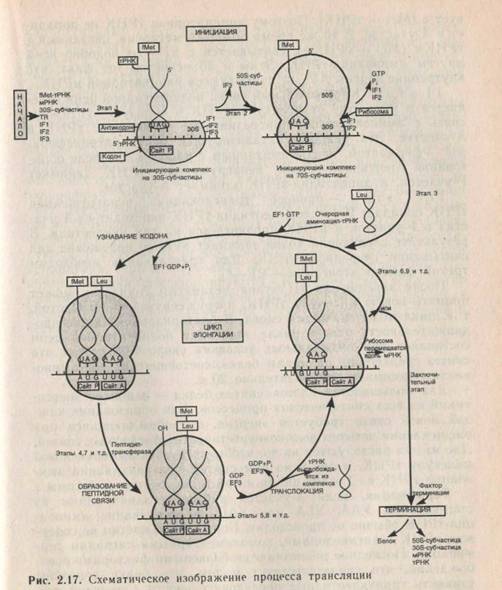
Расшифровка генетического кода. Решающую роль в расшифровке генетического кода сыграли два подхода, которые реализуются с участием бесклеточной системы белка. Бесклеточная система синтеза белка была получена из Е. collв ре-
127
|
|
зультате механического разрушения клеток и последующего центрифугирования для осаждения обрывков клеточной стенки и клеточной мембраны. В результате получили клеточный экстракт, содержащий необходимые компоненты для синтеза белка (ДНК, мРНК, тРНК, рибосомы, ферменты и другие компоненты клетки). При добавлении в такую систему АТФ, ГТФ и аминокислот — предшественников белков было обнаружено, что идет синтез белка и добавленные аминокислоты включаются во вновь синтезированные белковые молекулы. Если с помощью фермента дезоксирибонуклеазы разрушить ДНК-матрицу для синтеза мРНК, то через несколько минут синтез белка прекращается, поскольку имеющиеся в системе мРНК имеют короткое время жизни.
М. Ниренберг и X. Маттеи обнаружили, что если в систему добавить препарат мРНК, то синтез белка возобновляется. Таким образом от того, какая матрица будет добавлена в бесклеточную систему, можно получить белковые молекулы, аминокислотная последовательность соответствует последовательности нуклеотидов в добавленной матрице. Для синтеза матрицы был использован фермент полинуклеотидфосфорилаза. Этот фермент катализирует синтез полирибонуклеотидов из рибо-нуклеозиддифосфатов в отсутствие ДНК. Состав РНК, синтезируемый этим ферментом, определяется соотношением рибонуклеотидов в инкубационной смеси, а их последовательность близка к случайной.
Первым синтезированным полирибонуклеотидом был поли (Ү). Его получили при инкубации концентрированного раствора УДФ в присутствии фермента. Оказалось, что при добавлении поли (Ү) в бесклеточную систему синтеза белка синтезируется исключительно полифенилаланин. Так в 1961 г. был расшифрован первый кодон. Вскоре было показано, что поли (А) вызывает синтез полилизина, а поли (Ц) — полипролина. Поли (Г) в качестве матрицы не работает, так как образует сложную спиральную структуру.
Определение состава кодонов с помощью случайных сополимеров. Следующим шагом в расшифровке генетического кода было использование в качестве матриц полирибонуклеотидов, синтезированных в присутствии двух рибонуклеотиддифос-фатов, причем последние были взяты в разной пропорции. В такой смеси синтезируется матрица, содержащая все кодоны, которые могут быть образованы в данной системе, но различные кодоны присутствуют с разной частотой в зависимости от соотношения предшественников в реакционной смеси. Например, случайный сополимер У и Г содержит восемь различных триплетов (табл. 2.1) и их относительная частота зависит от соотношения У и Г в смеси.Таблица2.1.
Таблица кодонов РНК
| Стандартный генетический код | |||||||||
| 1-е вание (5'-ко- нец) | 2-е основание | 3-е вание (3'-ко- нец) | |||||||
| U (T) | C | A | G | ||||||
| U (T) | UUU |
(Phe/F) Фенил- аланин | UCU | (Ser/S) Серин | UAU | (Tyr/Y) Тирозин | UGU | (Cys/C) Цистеин | U (T) |
| UUC | UCC | UAC | UGC | C | |||||
| UUA | (Leu/L) Лейцин | UCA | UAA | Стоп (Охра) | UGA | Стоп (Опал) | A | ||
| UUG | UCG | UAG | Стоп (Янтарь) | UGG | (Trp/W) Триптофан | G | |||
| C | CUU | CCU | (Pro/P) Пролин | CAU | (His/H) Гистидин | CGU | (Arg/R) Аргинин | U (T) | |
| CUC | CCC | CAC | CGC | C | |||||
| CUA | CCA | CAA | (Gln/Q) Глутамин | CGA | A | ||||
| CUG | CCG | CAG | CGG | G | |||||
| A | AUU | (Ile/I) Изолейцин | ACU | (Thr/T) Треонин | AAU | (Asn/N) Аспарагин | AGU | (Ser/S) Серин | U (T) |
| AUC | ACC | AAC | AGC | C | |||||
| AUA | ACA | AAA | (Lys/K) Лизин | AGA | (Arg/R) Аргинин | A | |||
| AUG[A] | (Met/M) Метионин | ACG | AAG | AGG | G | ||||
| G | GUU | (Val/V) Валин | GCU | (Ala/A) Аланин | GAU | (Asp/D) Аспарагиновая кислота | GGU | (Gly/G) Глицин | U (T) |
| GUC | GCC | GAC | GGC | C | |||||
| GUA | GCA | GAA | (Glu/E) Глутаминовая кислота | GGA | A | ||||
| GUG | GCG | GAG | GGG | G | |||||
129
____
| неполярный | полярный | основный | кислотный | (стоп-кодон)терм |
A Кодон AUG кодирует метионин и одновременно является сайтом инициации трансляции: первый кодон AUG в кодирующей области мРНК служит началом синтеза белка [1] .
Расшифровка завершена в 1966 году [2] .
____ Анализ аминокислотного состава синтезированных в присутствии матрицы полипептидов показывает относительную частоту включения той или иной аминокислоты. Сопоставление частоты образования разных кодонов и включения разных аминокислот дает информацию о нуклеотидном составе кодонов, но не о последовательности нуклеотидов в кодоне. Например, из данных табл. 2.1 был сделан вывод, что валин, лейцин и цистеин кодируются кодонами, содержащими 2У и 1 Г, а триптофан и глицин — 1У и 2Г.
В результате использования различных сополимеров из двух и трех нуклеотидов был установлен состав кодонов для каждой из аминокислот.
Использование сополимеров с заданной последовательностью. Сочетая методы органической химии и ферментативные методы Г. Корана, удалось синтезировать полирибонуклеотиды с определенной повторяющейся последовательностью. Были синтезированы сополимеры, в которых многократно повторяется последовательность из двух, трех и четырех оснований. Использование таких матриц для синтеза полипептидов в бесклеточной системе дало возможность установить точную корреляцию между кодонами и аминокислотами в полипептиде. Например, сополимер, в котором повторяется последовательность из двух нуклеотидов У и Г, содержит два чередующихся кодона УГУ и ГУГ (см. рис. 2.11, б). При использовании такой матрицы синтезировался полипептид, в котором валин сочетался с цистеином. Этот результат однозначно подтверждает триплетность генетического, кода и в сочетании с данными, полученными другими методами, дает возможность точно идентифицировать кодоны для валина и цистеина (УГУ и ГУГ соответственно).
Если матрица состоит из повторяющейся лоследовательности из трех оснований, то в зависимости от рамки считывания можно получить три равных гомополипептида (см. рис. 2.11, б). Например, на матрице поли (УУГ) синтезировались полифенилаланин, полисерин и полилейцин. В сочетании с другими экспери-
130
ментами выяснилось, что УУГ кодирует фенилаланин, УГУ— серин, ЦУУ — лейцин. В некоторых случаях на подобных матрицах синтезировались не три, а два гомополипептида. Такими, например, были матрицы поли (ГУА) и поли (ГАУ). Причину этого мы рассмотрим позже.
Интересные данные были получены на матрицах, состоящих из повторяющегося тетрануклеотида. В этом случае должны синтезироваться полипептиды с повторяющейся последовательностью из четырех аминокислот. На матрице поли (УАУЦ) шел синтез полипептида с повторяющейся последовательностью тирозин—лейцин—серин—изолейцин независимо от рамки считывания (см. рис. 2.11, б). Достаточно знать ко-дон для одной из аминокислот, чтобы определить остальные. Однако совершенно иные результаты были получены при использовании поли (ГУАА) и поли (АУАГ) (см. рис. 2.11, б). Продуктами реакции были только ди- и трипептиды. Это связано с тем, что три из 64 кодонов не кодируют аминокислот, а выполняют роль терминаторов белкового синтеза. В первом случае синтез останавливался на кодоне УАА, во втором — на кодоне УАГ. Именно по этой же причине на матрицах поли (ГУА) и поли (ГАУ) синтезировалось только два го-мопептида. Одна из рамок считывания соответствует стоп-кодону (УГА и УАГ, соответственно).
Метод связывания рибосом. Ниренберг и Ледер разработали в 1964 г. другой метод расшифровки кодонов. Они установили, что тринуклеотиды стимулируют связывание с рибосомами тРНК, которая, в свою очередь, связана с аминокислотой, соответствующей данному тринуклеотиду. Это имитирует процесс взаимодействия кодона с антикодоном, который происходит на рибосомах между тРНК и мРНК. Таким образом, связывая рибосомы на нитроцеллюлозных фильтрах, можно выделить тройные комплексы: тринуклеотид — аминоацил-тРНК (в комплексе с аминокислотой) —рибосома. Не связанные с рибосомами молекулы тРНК проходят через фильтр и на фильтре можно обнаружить ту аминокислоту, которая связана стринуклеотидом, добавленным к смеси.
Тринуклеотид добавляли в реакционную смесь, где одна из аминокислот, связанных с тРНК, была радиоактивно мечена. В эксперименте анализировали 20 проб, в которых находился один и тот же тринуклеотид. Определив, в которой из проб метка окажется связанной с фильтром, устанавливают соответствие триплета и аминокислоты.
Два описанных выше метода привели к полной расшифровке генетического кода в 1966 г. Огромная по объему и выдаю-
131
щаяся по значению работа была выполнена всего за 5 лет. Полностью генетический код приведен в табл. 2.1.
Основные свойства генетического кода. 1. Триплетн о с т ь . Была доказана в генетических экспериментах и подтверждена в биохимических экспериментах. Одна аминокислота задается последовательностью из трех нуклеотидов, называемой кодоном.
2. Код не перекрывается. Кодоны следуют друг за другом без знаков препинания. Иными словами, два кодона не имеют общих нуклеотидов. В цепи ДНК, таким образом, существуют три рамки считывания и генетическая информация записана, как правило, в одной из них. Следовательно, считывание информации начинается со строго фиксированного нук-леотида, который и задает нужную рамку.
3. Код вырожден.Из табл. 2.1 видно, что 61 кодон кодирует 20 аминокислот, и три кодона служат сигналами для остановки белкового синтеза. Таким образом, код в высокой степени вырожден, т. е. большинство аминокислот кодируется более чем одним кодоном, а каждый кодон обозначает только одну аминокислоту. Следовательно, по аминокислотной последовательности можно однозначно определить последовательность нуклеотидов, которыми она закодирована. Обратная процедура из-за вырожденности кода невозможна.
Кодоны, соответствующие одной и той же аминокислоте, называются кодонами-синонимами. Метионин и триптофан кодируются одним кодоном, остальные аминокислоты имеют от 2 до 6 кодонов-синонимов. Интересно, что число кодонов для каждой аминокислоты коррелирует с реальной частотой встречаемости данной аминокислоты в белках (исключение составляет аргинин).
Большинство синонимов различается только последним основанием триплета. Поэтому говорят, что код вырожден по третьему основанию.
Например, кодоны с одним из двух пиримидинов (Ц или У) в третьем положении всегда являются синонимами, а кодоны с одним из двух пуринов (А или Г) чаще (но не всегда) кодируют одну и ту же аминокислоту. Различия по всем трем основаниям наблюдаются лишь в редких случаях (например, УЦГ и АГУ оба кодируют серии). Ф. Криком для объяснения вырожденности по третьему основанию в кодоне была предложена гипотеза «качания».
В структуре кода находят отражение и химические свойства разных аминокислот. Сходные по свойствам аминокислоты кодируются кодонами, имеющими общие основания. Например, все кодоны с У во втором положении кодируют аминокислоты с
132
гидрофобной боковой цепью. Если исключить терминирующие кодоны, то наличие А во втором положении определяет полярную или заряженную боковую цепь.
Можно полагать, что биологический смысл вырожденности генетического кода состоит в том, что эффект мутаций сводится к минимуму. При такой организации кода случайно возникшая замена основания с большей вероятностью, чем при случайном подборе кодонов, приведет к замене на сходную аминокислоту или же замены не произойдет вовсе.
Вырожденностью кода можно также объяснить существенную разницу в содержании АТ-пар у прокариот (от 30 до 70%) при схожем спектре белков. По-видимому, разные организмы систематически используют различные кодоны-синонимы.
4. Кодуниверсален. Генетический код был расшифрован в результате исследований в бесклеточных системах, полученных из бактерий. Поэтому следовало подтвердить, что результаты, полученные invitro, справедливы и invivo. Первые доказательства были получены при анализе мутаций. Было показано, что мутации, вызывающие замены оснований, соответствуют аминокислотным заменам в белке. Анализ мутаций, вызывающих сдвиг рамки, также выявил соответствие между измененным составом кодонов и последовательности аминокислот в «испорченном» участке белка.
Одинаков ли код у живых организмов? Были разработаны гетерологичные системы трансляции, которые позволяют использовать белоксинтезирующии аппарат одного вида для синтеза белка на мРНК другого вида. Успешное применение таких систем свидетельствует о постоянстве кода. Прямое доказательство универсальности было получено при сравнении нуклеотидных последовательностей ДНК и соответствующих аминокислотных последовательностей. Оказалось, что во всех бактериальных и эукариотических геномах для кодирования аминокислот используются одни и те же наборы триплетов нуклеотидов.
Однако недавно в митохондриях некоторых видов были обнаружены первые исключения. В митохондриальной ДНК кодон УГА читается так же, как УГГ и, следовательно, является не кодоном-терминатором, а кодоном для триптофана. Это справедливо для всех митохондриальных геномов. У некоторых видов обнаружены специфические изменения кода. У дрожжей кодон ЦУА кодирует трионин вместо лейцина. У млекопитающих АУА имеет то же значение, что и АУГ, и означает метионин вместо изолейцина. Кодоны АГА и АГЦ не кодируют аргинина, а являются терминаторами.
133
| С | ||
| Leu | T | |
| G G | Тгр | |
| Asp | A | |
| С T | Thr | |
| Phe | T | |
| T G T | Leu | |
| Val | T | |
| G G | Тгр | |
| Gly | G | |
| A T | Asp | |
| Туг | A | |
| С | Тгр | |
| С | ||
| Pro | C | |
| T | Leu | |
| C G | ||
| Arg | G | |
| С | Ala | |
| T | ||
| Phe | T | |
| T C | Phe |
Универсальность кода (за редким исключением) свидетельствует о его раннем происхождении в эволюции. Возможно, на ранних этапах только первые два основания служили для узнавания, а роль третьего основания определилась позднее. В некоторый момент код был «заморожен» в его современном виде. Всякая мутация, изменяющая код, изменит последовательность аминокислот у большинства белков. Многие из этих изменений могут быть летальными. Следовательно, должно существовать сильное давление отбора против таких мутаций.
Рамки считывания могут перекрывать ся. Концепция генетического кода предполагает, что аминокислотная последовательность записана в одной из трех рамок считывания на данном отрезке молекулы ДНК. Эта рамка называется открытой. Началом кодирующей области является стартовый кодон, а завершается она одним из кодонов-терминаторов. Две другие рамки считывания называются блокированными. Они не используются для синтеза белка, поскольку содержат много кодонов-терминаторов. Поэтому у мутантов со сдвигом рамки считывания синтез полипептидной цепи быстро прекращается.
Первым исключением из правила была ДНК бактериофага ФХ 174, которая содер-жит 5375 нуклеотидов и кодирует более2000аминокислот. Расшифровка нуклео-
| Рис. 2.12. Перекрываю- щиеся гены в ДНК фага 174. В двух рамках считывания закодированы две последовательности аминокислот |
тидной последовательности фаговой ДНК позволила разрешить эту парадоксальную ситуацию. Были обнаружены две перекры-
вающиеся рамки считывания, т. е. в одной и той же последовательности нуклеотидов достаточно протяженной длины (около 300 нуклеотидов) закодированы две различные аминокислотные последовательности. Таким образом различные белки могут кодироваться альтернативными рамками считывания, они могут начинаться и кончаться в разных местах и участок перекрытия может варьировать в широких пределах (рис. 2.12). У бактериофага G4 обнаружены короткие участки генома, которые коди-
134
руют части трех различных белков во всех трех рамках считывания.
Двойная спираль ДНК содержит шесть рамок считывания (по три в каждой цепи). Как правило, в любой данной точке только одна цепь является кодирующей. Сейчас обнаружены случаи перекрывания рамок считывания в комплементарных цепях ДНК.
Присутствие перекрывающихся рамок считывания увеличивает генетическую емкость генома. Это особенно важно для вирусов, размер генома которых ограничен размером белковой оболочки. При этом, однако, кодирующая гибкость ДНК строго ограничивается, так как мутации в перекрывающихся областях могут приводить к аминокислотным заменам сразу в одном или двух белках.
ТРАНСКРИПЦИЯ
Общие положения. В этой и последующей главах будут рассмотрены процессы, обеспечивающие выражение в фенотипе (экспрессию) генетической информации, содержащейся в ДНК. В генах закодирована информация о белках, синтезируемых в клетке. Однако сама ДНК не используется в качестве непосредственной матрицы для синтеза белка. Реализация генетической информации представляет собой двустадийный процесс. На первой стадии ген служит матрицей для синтеза молекул РНК, на которые совершенно точно транскрибируется (переписывается) последовательность нуклеотидов соответствующего гена и, следовательно, закодированная в нем информация о последовательности аминокислот. На второй стадии нуклеотидная последовательность РНК транслируется (переводится) в полипептидную цепь. Таким образом, поток генетической информации в клетке идет в следующем направлении: ДНК → транскрипция →РНК → трансляция → белок.
Клетки содержат три типа РНК: 1) информационная РНК (ее называют также матричная, отсюда мРНК) служит матрицей для синтеза белка. Каждому работающему гену (или группе генов) соответствует своя молекула мРНК- Следовательно, мРНК — крайне гетерогенный по размерам и нуклеотидной последовательности класс молекул. У Е. coliсредняя длина молекулы РНК составляет примерно 1,2 кб; 2) транспортная РНК (тРНК) переносит аминокислоты в активированной форме к рибосомам, где происходит синтез белковой молекулы (см. разд. 2.8); 3) рибосомная РНК (рРНК)— необходимый компонент рибосом. Существует несколько разновидностей рРНК (у прока-
135
|
|
риот — 3, у эукариот— 5). В каждой рибосоме содержится по одной молекуле каждого типа. На долю рРНК, в клетке Е. coliприходится 80%, количество тРНК составляет 15%, и меньше всего в клетке мРНК, на долю которой приходится всего лишь 5% всей РНК.
В основе механизма копирования при транскрипции лежит тот же структурный принцип комплементарного спаривания оснований, что и при репликации. Транскрипция осуществляется ферментами РНК-полимеразами, синтезирующими РНК на ДНК-матрице. В качестве предшественников используются рибонуклеозидтрифосфаты (рис. 2.13).
Транскрипция начинается после присоединения РНК-полимеразы к специфической нуклеотидной последовательности ДНҚ, к так называемому промотору. Завершается транскрипция при достижении РНК-полимеразы стоп-сигнала, или сигнала терминации транскрипции. Участок ДНК, ограниченный
промотором и терминатором, представляет собой единицу транскрипции — транскриптон.
В принципе обе комплементарные цепи ДНК могут служить матрицами для синтеза РНК. В действительности в пределах транскриптона копируется только одна из нитей ДНК, которая называется матричной, или значащей. В разных транскриптонах значащими могут быть разные цепи ДНК. Выбор транскрибируемой цепи определяется ориентацией промотора. Соседние транскриптоны могут быть отделены друг от друга нетранскрибируемыми участками ДНК, а могут и перекрываться, в частности так, что в пределах участка перекрывания матричными оказываются обе нити.
Разбиение ДНК на множество транскриптонов обеспечивает возможность независимого считывания разных генов, их индивидуального включения и выключения. У эукариот в состав транскриптонов входит, как правило, только один ген. Транскриптоны прокариот чаще называют оперонами: многие из них обычно содержат по нескольку генов, обычно функционально связанных. Существуют опероны, содержащие гены, не кодирующие белков (гены рРНК, тРНК и др.). Описаны смешанные опероны, включающие гены тРНК и белков.
РНК-полимераза — основной фермент, участвующий в транскрипции. Лучше всего этот фермент изучен у прокариот, у которых весь синтез РНК осуществляется одним-единственным ферментом этого типа (см. рис. 2.13). У бактерий молекула РНК-полимеразы состоит из двух компонентов: минимальной РНК-полимеразы, или «кор»-фермента (от англ. core — сердцевина), содержащего все каталитические центры, участвующие в синтезе РНК; σ-субъединицы, необходимой для правильного присоединения к промотору и отделяющейся от РНК-полимеразы после начала синтеза РНК- Минимальная РНК-полимераза состоит из четырех субъединиц: двух идентичных α-субъединиц и неидентичных β- и β'-субъединиц. Установлено, что α-субъединица участвует в связывании фермента с ДНК матрицей, а — β-субъединица — в связывании субстратов — рибонуклеозидтрифосфатов. Функция α-субъединицы не известна.
Транскрипция эукариотической ДНК в принципе не отличается от таковой у прокариот, но РНК-синтезирующий аппарат эукариотической клетки устроен гораздо сложнее. Он включает три различные РНК-полимеразы, каждая из которых считывает определенный тип генов и имеет гораздо более сложное строение, чем бактериальный фермент: в состав эукариотических РНК-полимераз входит от 9 до 11 полипептидных цепей.
137
Только одна из трех эукариотических РНК-полимераз, а именно РНҚ-полимераза II, транскрибирует гены, которые затем будут транслированы в белки. Две другие полимеразы катализируют образование различных типов РНК, которые составляют часть белок-синтезирующего аппарата: РНК-полимераза I синтезирует высокомолекулярную рибосомную РНК, а РНК-полимераза III — разнообразные низкомолекулярные стабильные РНК, в том числе тРНК и рибосомную 5S-PHK. Специфическим ингибитором РНК-полимеразы II является — аматин — высокотоксичное вещество, получаемое из бледной поганки. Вполне естественно, что эти три фермента узнают на ДНК различные сигнальные участки, в частности последовательности, инициирующие синтез РНК.
Клетки высших эукариот содержат около 40 000 молекул РНК-полимеразы II, примерно такое же число молекул РНК-полимеразы I и около 20 000 молекул РНК-полимеразы III, причем точное число этих ферментов варьирует в зависимости от скорости роста клеток.
Особые РНК-полимеразы обеспечивают транскрипцию ДНК клеточных органелл эукариот — хлоропластов и митохондрий. РНК-полимераза хлоропластов имеет сходство с бактериальным ферментом. РНК-полимеразы митохондрий состоят, повидимому, всего из одной субъединицы и сходны по аминокислотной последовательности с РНК-полимеразами некоторых бактериофагов. Ген, кодирующий митохондриальную РНК-полимеразу, располагается в ядре.
Цикл транскрипции можно разделить на четыре основных стадии, каждая из которых включает множество элементарных событий: 1) связывание с ДНК; 2) инициация цепи РНК; 3) рост (элонгация) цепи РНК; 4) терминация цепи РНК (см. рис. 2.13).
Этот цикл у бактерий осуществим в простой бесклеточной системе, состоящей из ДНК-матрицы и очищенной РНК-полимеразы, без каких бы то ни было вспомогательных факторов. В клетке в транскрипции участвуют разнообразные регуляторные белки, выполняющие вспомогательные функции, и изучение транскрипции в бесклеточной системе позволяет понять не только ферментативные механизмы синтеза РНК, но и дает ключ к пониманию механизмов транскрипции.
У эукариот транскрипция изучена хуже, и это, в частности, связано с тем, что эукариотические РНК-полимеразы не способны осуществить полный цикл транскрипции в бесклеточной системе. Однако в основных чертах цикл транскрипции у эукариот и бактерий сходен.
138
Цикл транскрипции начинается с присоединения РНК-полимеразы к промотору — строго определенному участку ДНК, определяющему место начала синтеза РНК- Оказавшись на промоторе, РНК-полимераза образует с ним так называемый закрытый промоторный комплекс, в котором ДНК сохраняет двуспиральную структуру. В закрытом комплексе РНК-полимераза не может начать транскрипцию, кроме того, он нестабилен и легко диссоциирует при повышении ионной силы.
Закрытый комплекс может обратимо превращаться в открытый. При этом РНК-полимераза расплетает примерно один виток двойной спирали ДНК в районе стартовой точки — нуклеотида, с которого начнется комплементарное копирование матрицы. В открытом комплексе связь РНК-полимеразы с ДНК существенно упрочняется.
Следующая стадия, инициация, осуществляется при наличии субстратов РНК-полимеразы, нуклеозидтрифосфатов и состоит в образовании первых нескольких звеньев цепи РНК. Первый нук-леотид входит в состав цепи, сохраняя свою трифосфатную группу, а последующие присоединяются к З'-ОН-группе предыдущего с освобождением пирофосфата. Таким образом, рост цепи РНК идет в направлении 5'→3', как при синтезе ДНК, а РНК-полимераза движется по матричной цепи в направлении 3'→5'. На стадии инициации продукт связан с матрицей и с РНК-полимеразой непрочно и с высокой вероятностью может высвобождаться из комплекса. В этом случае РНК-полимераза, не покидая промотора, снова инициирует РНК- Когда РНК-продукт достигает длины 3—9 нуклеотидов (в зависимости от промотора), транскрибирующий комплекс стабилизируется и уже не распадается до тех пор, пока синтез молекулы РНК не завершится. Примерно в этот момент σ-субъединица отделяется от фермента и начинается стадия элонгации.
Эффективность инициации на разных промоторах, их «сила», существенно различается: с некоторых промоторов за период деления клетки может инициироваться всего одна-две молекулы РНК, тогда как в других инициациях может происходить каждые одну-две секунды. Сила большинства промоторов увеличивается с ростом степени отрицательной сверхспирализации ДНК, поскольку при этом облегчается расплетение ДНК и, как следствие, переход из закрытого в открытый промоторный комплекс.
На стадии элонгации в ДНК расплетено около 18 н. п. Примерно 12 нуклеотидов матричной нити ДНК образует гибридную спираль с растущим концом цепи РНК. По мере движения
139
РНК-полимеразы по матрице впереди нее происходит расплетение, а позади — восстановление двойной спирали ДНК. Одновременно происходит освобождение синтезированной РНК из комплекса с матрицей и с РНК-полимеразой. Эти перемещения должны сопровождаться относительным вращением РНК-полимеразы и ДНК, и не исключено, что в транскрипционный комплекс входят топоизомеразы, предотвращающие такое вращение.
Максимальная скорость элонгации составляет примерно 50 нуклеотидов в секунду. Особенно хорошо это видно при низких концентрациях субстратов. В некоторых случаях даже при оптимальных концентрациях субстратов на определенных участках матрицы происходят длительные задержки в продвижении РНК-полимеразы, так называемые паузы.
В отличие от ДНК-полимеразы РНК-полимераза не обладает способностью к самокоррекции. В связи с этим надежность транскрипции гораздо ниже, чем надежность репликации. Частота ошибок при синтезе РНК составляет примерно одну ошибку на 10' нуклеотидов. Гораздо более низкую надежность синтеза РНК клетка обходит тем, что с одного гена синтезируется много копий РНК-транскриптов.
Терминация транскрипции регулируется так же тонко, как и инициация. В отсутствие специальных белковых факторов терминации РНК-полимераза способна терминировать синтез РНК на тех терминаторах, нуклеотидная последовательность в районе которых отличаются двумя характерными особенностями. В них по ходу транскрипции сначала идет участок, обогащенный ГЦ-назами и обладающий центральной симметрией, а затем участок из 4—8 расположенных подряд А в значащей цепи. Транскрипция заканчивается в конце олигоА последовательности или сразу за ней. Предполагается, что после прохождения РНК-полимеразой участка с центральной симметрией, обогащенного ГЦ, в РНК-продукте возникает «шпилька», приводящая к остановке фермента и разрушению части РНК — ДНК гибрида транскрибирующего комплекса. Оставшаяся часть РНК. — ДНК гибрида легко плавится в виду нестабильности рУ * рА пар, что приводит к освобождению РНК-продукта. Многие терминаторы узнаются РНК-полимеразой только с помощью фактора терминации, названного β. Конкретный механизм вытеснения РНК из транскрипционного комплекса под действием β-фактора пока не выяснен.
Процессинг первичных транскриптов. Молекулы предшественников зрелых клеточных РНК подвергаются расщеплению и химической модификации. Совокупность биохимических реак-
140
ций, в результате которых уменьшается молекулярная масса РНК-предшественника и осуществляются разные способы химической модификации с образованием зрелых молекул РНК, называют процессингом. Процессинг наблюдается в прокарио-тических клетках, но особенно сложны превращения предшественников клеточных РНК в ядрах эукариот. В клетках эукариот только незначительная часть, около 10% транскрибируемых в ядре последовательностей ДНК выявляются в составе цитоплазматических мРНК. Основная часть новообразованной РНК распадается в ядре и не обнаруживается в цитоплазме.
Процессингу прокариот. Молекулы мРНК у прокариот практически не подвергаются процессингу. У некоторых бактерий транскрипция и трансляция сопряжены, т. е. происходят одновременно. 5'-конец мРНК может транслироваться на рибосоме и затем подвергаться деградации еще до завершения ее синтеза на З'-конце (рис. 2.14).
Молекулы прокариотических транспортных рабосомных РНК образуются путем расщепления и химической модификации новосинтезированных цепей РНК- Например, у Е. coliтри вида молекул рибосомной РНК и одна молекула тРНК входят в состав первичного транскрипта. Другие транскрипты кроме молекул рРНК содержат по нескольку различных видов тРНК или несколько копий одной и той же тРНК. Кроме того, транскрипты содержат разграничивающие (спейсерные) последовательности, различные по длине и нуклеотидному составу. Эти транскрипты подвергаются атаке нуклеаз, действующих с исключительно высокой точностью. Нуклеазы расщепляют и укорачивают предшественники тРНК и рРНК. Например, нуклеаза Р образует правильные 5'-концы всех молекул тРНК в клетке Е. coli . Рибонуклеаза III вырезает в предшественнике 5S-, 16S- и 23S-pPHK из первичного транскрипта, расщепляя РНК в двуспиральных шпилечных областях.
Если З'-конец тРНК не несет концевой последовательности ЦЦА, то эти основания присоединяются по постсинтетической модификации. Необычные основания, которые встречаются во всех молекулах тРНК, образуются путем ферментативной модификации обычных рибонуклеотидов, входящих в состав предшественника тРНК.
Процессинг у эукариот. Процессинг тРНК у эукариот протекает примерно по такому же механизму, как и у прокариот. Функционально активные молекулы образуются из более длинного предшественника, который подвергается расщеплению и модификации с включением минорных оснований (см. рис. 2.14).
141
|
|
Процессинг рРНК также аналогичен соответствующему процессу у прокариот. Первичный транскрипт содержит участки, отвечающие 18S-, 5,8S- и 28S-pPHK, разделенные спенсерами. Как и у прокариот, эти три рРНК, образуются при расщеплении спейсерных последовательностей.
При изучении генов эукариот выяснилось, что они имеют мозаичную структуру. В таких «разорванных» генах кодирующие области — экзоны — чередуются с некодирующими — нитронами. Число интронов может сильно варьировать: от одного в гене актина дрожжей до нескольких десятков (17 в ге-
142
не — кристаллина птиц и 50 в гене проколлагена млекопитающих). Интроны могут составлять большую часть мозаичного гена. Суммарная нуклеотидная длина интронов во много раз может превышать длину экзонов. Экзонами называют районы гена, которые кодируют участки полипептидной цепи, также называют и районы транскриптов, входящих в состав зрелых мРНК, но не транслируются (например, лидерная область перед инициирующим кодоном).
Инициация транскрипции эукариотических генов сопровождается модификацией 5'-конца РНК с образованием специфической нуклеотидной структуры, в которой 7-метилированный остаток гуанозин-5'-трифосфата соединен 5'—5'-фосфодиэфирной связью с концевым нуклеотидом РНК- Это так называемый кэп (от англ. cap), который присоединяется сразу после инициации транскрипции к А или Г. Модифицированный 5'-конец обеспечивает эффективную трансляцию мРНК и удлиняет время ее жизни в клетке. Образование кэпа также способствует дальнейшему ходу процессинга.
Транскрипция экзонов и интронов сложного эукариотиче-ского гена осуществляется в порядке их расположения друг за другом (коллинеарная транскрипция), после чего вырезаются районы интронов, а экзоны сшиваются в результате процесса, называемого сплайсингом.
ТРАНСЛЯЦИЯ
Основные этапы. Трансляция — это процесс декодирования мРНК, в результате которого информация с языка последовательности оснований мРНК переводится на язык аминокислотной последовательности белка. Трансляция — процесс, хотя и матричный, но более сложный, чем репликация или транскрипция, которые происходят с использованием одного и того же языка спаривания оснований. В этом процессе согласованно взаимодействует более сотни видов макромолекул. Помимо рибосом необходимы молекулы тРНК, активирующие ферменты, растворимые факторы и мРНК.
Синтез белка осуществляется путем последовательной поликонденсации отдельных аминокислотных остатков, начиная с амино-(N)-конца полипептидной цепи в направлении к карбоксильному (С)-концу. Декодирование мРНК происходит соответственно в направлении 5'→3'. Транскрипции предшествует активация тРНК — присоединение аминокислоты к З'-концевому аденозину молекулы тРНК с образованием аминоацил-тРНК. Синтез белка осуществляется в три стадии: 1)
143
|
|
инициация, приводящая к связыванию инициаторной тРНК с сигналом начала трансляции в мРНК, при этом инициаторная тРНК занимает Р-участок рибосомы, один из двух участков связывания тРНК; 2) элонгация начинается со связывания аминоацил-тРНК с другим участком связывания на рибосоме (А-участком) с последующим образованием пептидной связи между аминогруппой второй аминоацил-тРНК и карбоксильной группой ф-метионина, связанного с инициаторной тРНК; образовавшаяся дипептидил-тРНК перемещается из А-участка в Р-участок, новая аминокислота связывается с освободившимся А-участком, и начинается новый цикл реакции элонгации; 3) терминация происходит тогда, когда стоп-кодон (сигнал терминации) в молекуле тРНК считывается фактором освобождения белка, что приводит к отделению завершенной полипептидной цепи от рибосомы. Ниже процесс трансляции будет описан более подробно на примере синтеза белка в клетках Е. coli , где он лучше всего изучен.
Активация тРНК. Каким образом молекула тРНК узнает «свою» аминокислоту? Существует специальный набор ферментов, так называемых аминоацил-тРНК-синтетаз, которые присоединяют аминокислоты к соответствующим молекулам тРНК-Для каждой из аминокислот имеется своя особая синтетаза: она присоединяет глицин к глициновой тРНК, валин — к валиновой и т. д. Реакция присоединения протекает в два этапа и приводит к образованию аминоацил-тРНК (рис. 2.15). Сначала аминокислота активируется путем связывания ее карбоксильной группы непосредственно с АМФ, т. е. образуется аденилированная аминокислота; источником энергии для реакции аденилирования, в обычных условиях невыгодной в термодинамическом смысле, служит гидролиз АТФ. Оставаясь связанной с аминоацил-тРНК-синтетазой, аденилированная карбоксильная группа аминокислоты переносится затем на гидроксильную группу остатка сахара, находящуюся на З'-конце молекулы тРНК. В результате аминокислота оказывается присоединенной к тРНК сложноэфирной связью.
Таким образом аминоацид-тРНК-синтетаза выполняет адапторную роль, осуществляя высокоспецифичную подгонку одной молекулярной поверхности к другой.
Структура тРНК. Молекулы тРНК играют роль конечных адапторов при переводе информации, заключенной в нуклеотидной последовательности, на язык белка. Таким образом, генетический код расшифровывается при помощи двух взаимосвязанных наборов адапторов.
Молекулы тРНК обладают многими общими структурными особенностями. Это вполне естественно, поскольку все молеку-
144
лы тРНК должны взаимодействовать примерно одинаковым образом с рибосомами и мРНК (должны укладываться в А- и Р-участки рибосомы и взаимодействовать с ферментом, катализирующим образование пептидной связи).
Все молекулы транспортных РНК обладают следующими общими свойствами (рис. 2.16).
1. Состоят из одной цепи длиной от 73 до 93 рибонуклеотидов.
2. Содержат много необычных оснований, как правило, от 7 до 15 на молекулу. Многие из этих оснований представляют собой метилированные или диметилированные производные А, У, Ц и Г, которые образуются путем ферментативной модификации тРНК-предшественника.
3. 5'-конец тРНК фосфорилирован. На 5'-конце обычно расположен остаток — гуанин.
4. На З'-конце всех тРНК находится последовательность ЦЦА. Активированная аминогруппа прикрепляется к З'-гидроксильной группе концевого аденозина.
145
|
|
|
|
5. Примерно половина нуклеотидов тРНК спарена и образует участки двойной спирали. Не спарены пять групп оснований.
6. Антикодоновая петля состоит из семи оснований, расположенных в следующей последовательности:
Пиримидин —Пиримидин —X — Y — Z — Модифициро- —Вариабель-
˅ ванный пурин ное основание
антикодоновое основание
146
В результате рентгеновских кристаллографических исследований установлена трехмерная структура молекулы тРНК. Она имеет L-образную форму и содержит два участка двойной спирали примерно по десять пар оснований в каждом. Спиральные участки расположены перпендикулярно друг другу, что и придает молекуле L-образную форму. ЦЦА-участок прикрепления аминокислоты расположен на одном из концов L. Другой конец L содержит антикодоновую петлю, и таким образом, аминокислота, связанная с тРНК, удалена от антикодона на расстоянии примерно 80А.
Кодон-антикодоновое взаимодействие. В каком месте будет присоединена к растущей полипептидной цепи данная аминокислота, зависит не от самой аминокислоты, а от присоединившей ее молекулы тРНК: Выяснить это удалось при помощи изящного эксперимента, в котором аминокислоту, присоединенную к специ-. фической тРНК, химическим путем превращали в другую аминокислоту (цистеин в аланин). Когда такие гибридные молекулы участвовали в синтезе белка в бесклеточной системе, «неправиль-
147
ная» аминокислота включалась в белковую цепь во всех тех положениях, где должна была быть «правильная» аминокислота. Успешное декодирование зависит, следовательно, от точности механизма, который в норме обеспечивает связь между каждой активированной аминокислотой и соответствующей молекулой тРНК, и от точности кодон-антикодонового взаимодействия.
Но генетический код вырожден (большей части аминокислот соответствует более одного кодона). Эту вырожденность можно истолковать двояко: 1) одна молекула тРНК может взаимодействовать более, чем с одним кодоном; 2) для каждой аминокислоты имеется более одной тРНК. В действительности справедливо и то и другое. Для некоторых аминокислот существует более одной тРНК. Кроме того, некоторые тРНК таковы, что требуют точного спаривания только по первым двум положениям кодона; в третьем положении допускается и неверное спаривание (так называемое неоднозначное соответствие), т. е. на спаривание третьего основания накладываются менее строгие стерические ограничения, чем на спаривание двух других.
С третьим нуклеотидом кодона взаимодействует первый нук-леотид антикодона (порядок нуклеотидов считается от 5'- к З'-концу). Часто первое положение в антикодоне тРНК занято необычным основанием инозином (I), которое может образовывать водородные связи с У, Ц или А, находящимися в кодоне в третьем положении. Кроме того, У в первом положении может взаимодействовать с А или Г, а А — с Ц или У. Таким образом в связи с механизмом «качания» клетке требуется меньше 64 различных тРНК- Каждая тРНК может узнавать до трех кодонов.
Структура рибосом. Все этапы белкового синтеза оказываются возможными вследствие того, что трансляция осуществляется крупным мультиферментным комплексом — рибосомой, состоящей из молекул белков и РНК. В течение всего процесса синтеза белка растущая полипептидная цепь, мРНК и очередная аминоацил-тРНК остаются прикрепленными к рибосоме.
Рибосомы эукариот и прокариот очень сходны по своей структуре и функции. Каждая из них состоит из двух субчастиц— большой и малой. В эукариотических рибосомах приблизительно половину массы составляет РНК; малая субчастица состоит из одной молекулы рибосомной РНК (рРНК), связант ной приблизительно с 33 различными рибосомными белками, а в большой субчастице свыше 40 различных рибосомных белков связано с тремя различными молекулами рРНК. Прокариоти-ческие рибосомы несколько мельче и содержат меньшее число компонентов. В рибосомах обоих типов имеется бороздка, удерживающая растущую полипептидную цепь, и бороздка, удер-
148
живающая молекулу мРНК- Длина бороздок такова, что в первой из них умещается примерно 30 аминокислот, а во второй — около 35 нуклеотидов РНК.
В рибосоме имеется два участка, связывающих молекулы тРНК. Один из них удерживает молекулу тРНК, присоединенную к растущему концу полипептидной цепи; поэтому его называют пептидил-тРНК-связывающим участком, или Р-участ-ком. Второй служит для удержания только что прибывшей молекулы тРНК, нагруженной аминокислотой; его называют аминоаци-тРНК-связывающим участком, или А-участком. К обоим участкам молекула тРНК прикрепляется лишь в том случае, если ее антикодон спаривается с комплементарным ему кодоном мРНК. А- и Р-участки располагаются очень близко друг к другу, так что две связанные с ними молекулы тРНК спариваются с двумя соседними кодонами в молекуле мРНК.
Удалось осуществить invitro самосборку целой функциональной рибосомы из составляющих ее белков. Это говорит о том, что сложная структура рибосомы обусловлена исключительно взаимодействиями входящих в ее состав молекул.
Направление синтеза белка. Основная реакция в синтезе белка—это реакция, приводящая к образованию пептидной связи между карбоксильной группой на конце растущей полипептидной цепи и свободной аминогруппой аминокислоты. Следовательно, белковая цепь синтезируется путем ее постепенного наращивания от аминного конца к карбоксильному. На протяжении всего процесса растущий карбоксильный конец полипептидной цепи остается в активированном состоянии, будучи связан ковалентной связью с тРНК. Эта энергия расходуется на образование пептидной связи. Таким образом, в процессе синтеза белка каждая добавляемая аминокислота несет с собой энергию активации, необходимую не для ее собственного присоединения, а для присоединения следующей аминокислоты. Такой рост называется «ростом с головы». В этом смысле трансляция отличается от репликации и транскрипции, где рост полимерной цепи идет «с хвоста».
Информационная РНК транслируется в направлении 5'→3'. Поскольку синтез РНК идет в том же направлении, то мРНК (прокариотическая) может транслироваться уже в то время, когда она синтезируется. Действительному Е. соіі 5'-конец мРНК взаимодействует с рибосомами вскоре после того, как он синтезировался, и трансляция оказывается тесно связанной с транскрипцией во времени и пространстве. У эукариот эти процессы разобщены.
149
|
|
Одну молекулу мРНК могут транслировать несколько рибосом. Это существенно увеличивает эффективность использования мРНК. Группа рибосом, связанных с одной молекулой мРНК, называется полирибосомой, или полисомой. Рибосомы, входящие в состав этой структуры, работают независимо. При максимальной плотности рибосом на мРНК одна рибосома приходится на 80 нуклеотидов.
Инициация трансляции. Трансляция начинается со сборки инициаторного комплекса в том самом месте на мРНК, с которого должен начаться синтез полипептидной цепи (рис. 2.17). Сборка комплекса состоит из ряда этапов, катализируемых белками — факторами инициации.
На 5'-конце молекулы мРНК находится участок инициации, включающий инициирующий кодон АУГ (или ГУГ) и богатую пуринами последовательность, центр которой находится на расстоянии примерно 10 нуклеотидов в 5'-сторону от инициирующего кодона. Эта последовательность комплементарна З'-конце-вой последовательности молекулы 16S рРНК, входящей в состав малой субъединицы рибосомы. Последовательности взаимодействуют с образованием дуплексов длиной 3—9 н. п., и малая субъединица рибосомы оказывается в комплексе с мРНК.
Еще до того, как эта малая субчастица присоединится к мРНК, она нагружается особой инициаторной тРНК (тРНКf), узнающей кодон АУГ и несущей модифицированный метионин — формилметионин (fMeT). Таким образом, синтез белка у бактерий начинается с формилметионина.
МРНК, рибосомная 30S-субчастица и fтРНК образуют 30S-комплекс инициации, в котором антикодон tPHKJсоединен со старт-кодоном. Таким образом, рамка считывания устанавливается специфическим взаимодействием рибосомы и fMet — TPHKf с мРНК. Для образования этого комплекса необходимы ГТФ и три белковых фактора IF-1,IF-2 и IF-3.
Затем бОБ-субчастица рибосомы присоединяется к инициа-торному ЗОБ-комплексу, образуя инициаторный 708-комплекс. На этом этапе происходит гидролиз связанного ГТФ. 70S-hhh-циаторный комплекс готов к стадии элонгации белкового синтеза. Молекула fMet — TPHKf занимает Р-участок рибосомы. А-участок еще пуст.
Элонгация трансляции. Процесс элонгации (наращивания) полипептидной цепи на рибосоме может рассматриваться как цикл, слагающийся из трех отдельных этапов (см. рис. 2.17).
Iэтап. Молекула аминоацил-тРНК связывается со свободным А-участком рибосомы, примыкающим к занятому
150
Р-участку; связывание осуществляется за счет спаривания нуклеотидов антикодона с тремя нуклеотидами мРНК, находящимися в А-участке. Комплементарная аминоацил-тРНК доставляется в А-участок белком, который называется фактором элонгации EF-Tu. Важно отметить, что TF—Тu не взаимодейст-
151
вует с fMet — TPHKf. Поэтому инициаторная тРНК не попадает в А-участок. В то же время обычный метионин, связанный с тРНКм (Met — тРНКм), связывается с EF—Тu подобно всем другим аминоацил-тРНК. Этим и объясняется тот факт, что внутренние кодоны АУГ не считываются инициаторной мРНК.
II этап. Карбоксильный конец полипептидной цепи отделяется в Р-участке от молекулы тРНК. и образует пептидную связь с аминокислотой, присоединенной к молекуле тРНК в А-участке. Эта реакция катализируется пептидилтрансферазой — ферментом, прочно связанным с рибосомой. После образования пептидной связи ненагруженная тРНК занимает Р-участок, а дипептидил-тРНК занимает А-участок.
III этап — процесс транслокации: ненагруженная тРНК покидает Р-участок, пептидил-тРНК переходит из А-участка в Р-участок и мРНК продвигается на три нуклеотида. В результате следующий кодон занимает нужное положение для считывания очередной мРНК. Для транслокации необходим третий фактор элонгации — EF—G.
После завершения III этапа незанятый А-участок может принять новую молекулу тРНК, нагруженную аминокислотой, т. е. цикл может начаться снова. В бактериальной клетке продолжительность одного цикла элонгации полипептидной цепи составляет при оптимальных условиях около 0,05 с, так что синтез среднего по размерам белка, состоящего из 400 аминокислот, занимает приблизительно 20 с.
Для большинства клеток синтез белка — наиболее энергоемкий из всех синтетических процессов. Для образования каждой новой связи требуется энергия, высвобождающаяся при расщеплении четырех высокоэнергетических фосфатных связей. Две из них расходуются на то, чтобы нагрузить аминокислотой молекулу тРНҚ, а две — на сам сиятез: при связывании ами-ноацил-тРНК на I этапе цикла и при транслокации рибосомы.
Терминация. Если А-участок рибосомы занят одним из стоп-кодонов, УАА, УГА или УАГ, то связывание аминоа-цил-тРНҚ обычно не происходит. Нормальные клетки не содержат тРНК с антикодонами, комплементарными сигналам тер-минации. Последние распознаются белковыми факторами освобождения, что свидетельствует о том, что белки способны узнавать тринуклеотидные последовательности с высокой степенью точности.
Связывание фактора освобождения изменяет активность пептидилтрансферазы. Фермент с такой измененной активностью присоединяет теперь к пептидил-тРНК не свободную аминогруппу аминокислоты, а молекулу воды. Вследствие этого
152
карбоксильный конец растущей полипептидной цепи отделяется от молекулы тРНК. А поскольку растущий полипептид удерживается на рибосоме только посредством его связи с молекулой тРНК, завершенная белковая цепь оказывается свободной и, отделившись от рибосомы, поступает в цитоплазму.
Посттрансляционная модификация. Многие полипептиды по окончании трансляции претерпевают ряд различных модификаций. 1. Формильная группа на N-конце бактериальных белков гидролизуется деформилазой. Под действием аминопеп-тидазы может произойти отщепление одного или нескольких концевых остатков. Концевой метионин иногда отщепляется до завершения синтеза полипептидной цепи. 2. При окислении двух цистеиновых остатков могут образоваться дисульфидные связи. 3. Боковые цепи некоторых белков могут быть специфически модифицированы. Остатки пролина и лизина гидроксилируются. В результате присоединения Сахаров к боковым цепям аспарагина, серина и треонина образуются гликопротеины. Некоторые белки фосфорилируются. К ферментам ковалентно присоединяются простетические группы, например, липоевая кислота. 4. Полипептидные цепи могут подвергаться специфическому расщеплению.
ГЛАВА 3
Дата добавления: 2021-01-20; просмотров: 293; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!