Школьник 12 лет пришел в травмпункт с жалобой на сильный зуд и отек руки после укуса осы. Врач назначил противоаллергический препарат эбастин. Правильна ли рекомендация врача?
А. основной медиатор воспаления, особенно реагинового типа – гистамин. Высвобождается из тучных клеток и базофилов при воздействии на них антигена (в данном случае яд осы). Оказывает влияние на другие клетки (тромбоциты, эозинофилы и тд), способствуя выработке 2ых медиаторов воспаления.
Б.

В. Способы инактивации аминов:
1. метилирование с участием SAM (для гистамина)
2. окисление МАО (дофамин, норадреналин и тд).
Г. Если данный препарат направлен на ингибирование SAM, что тогда приведет к накоплению гистамина в крови и, следовательно, усилит процесс аллергии, то нет. Если препарат содержит Метионин или его активную форму, то гистамин будет инактивироваться и симптоматическое лечение окажется удачным.
Структурный аналог тимина – препарат фторурацил обладает сильным цитостатическим действием и часто используется в химиотерапии опухолей. Синтез какой аминокислоты нарушается в присутствии этого препарата?
А. этот препарат ингибирует превращение дУМФ в дТМФ (ингибитор тимидилатсинтазы)
Б.

В. Ингибируется рост цепей РНК и, как считается, и ДНК, в результате чего опухолевые клетки не становятся способны к опухолевой прогрессии и размножению.
Подагра была известна еще в древнем мире и описана Гиппократом. Объясните причину развития подагры.
А.

Подагра вызвана: либо дефектом ФРДФ-синтетазы, либо частичной потерей активности гипоксантин-гуанинфосфорибозилтрансферазы.
|
|
|
Б. факторами риска подагры является пол (мужчины болеют в 20 раз чаще, чем женщины). Лечат подагру малобелковой диетой и аллопуринолом – структурным аналогом гипоксантина.
В. Мочевая ислота плохо растворима в воде и плазме крови, поэтому она осаждается в органах и тканях и формирует подагрические узелки, кристаллы. Больше всего таких кристаллов встречается в мышцах, связках. Суставах и сухожилиях.
БЕЛКИ
1. На рис. 1.1 представлена схема белка, состоящего из одной полипептидной цепи и имеющего активный центр, а также структуры четырех лигандов. Выберите из четырех представленных лигандов один, который с наибольшей вероятностью будет взаимодействовать с активным центром белка.
А.
Серин: Глутаминовая кислота: Валин:
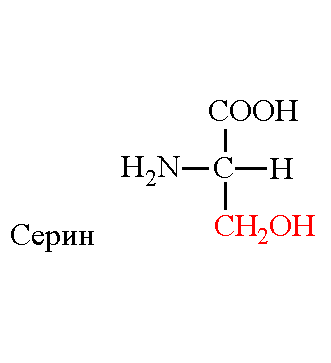


Б. Специфичность обусловлена комплементарным взаимодействием радикалов лиганда и радикалов активного центра белка.
В. Возникают водородные и ионные связи.
Г. активный центр белка – это специфический центр связывания белка с лигандом по правилу комплементарности. Он состоит из тех радикалов аминокислот, которые в первичной структуре находятся далеко друг от друга. Формируется при формировании третичной структуры белка. При взаимодействии центра с лигандом проявляются специфические функции белка.
|
|
|
Д. первичная структура белка дает возможность взаимодействовать тем радикалам АК, которые в ней далеко стоят друг от друга, но при формировании третичной структуры и активного центра, эти радикалы сближаются. Мутации в гене, кодирующего первичную структуру белка (минсенс мутация), может привести к формированию иного белка в процессе транскрипции и трансляции и, следовательно, появится другой белок с другим набором АК и с другим активным центром, что приведет к изменению его свойств и функций после взаимодействия с лигандом.
2. На рис 1.2 представлено схематическое изображение белка и структуры различных лигандов. Выберите из четырех представленных лигандов один, который с наибольшей вероятностью будет взаимодействовать с активным центром белка.
А. Изолейцин: Аргинин: Аспарагиновая к-та:



Б. Специфичность обусловлена комплементарным взаимодействием радикалов лиганда и радикалов активного центра белка.
В. Ионные.
Г. конформационная лабильность – это способность белков изменять свою конформацию, пока они не достигнут своей нативной (устойчивой) конформации или под влиянием различных факторов. Изменяя свою конформацию, белок способен изменять свои свойства и функции благодаря изменению конформации активного центра.
|
|
|
3. На рис 1.3 дана схема строения фермента, имеющего активный и регуляторный центры. Выберите из представленных лигандов один, который с наибольшей вероятностью будет взаимодействовать с регуляторным центром белка, и объясните роль олигомерных белков в функционировании клеток.
А. олигомерные белки – это белки, которые состоят из 2х и более протомеров, и которые имеют активный центр на одном потомере и аллостерический центр на другом. Активный центр белка определяет его специфическую функцию, а аллостерический центр белка определяет регуляцию активного центра и, следовательно, функции белка через изменение его конформации.
Б. Метионин: Цистеин: Серин:
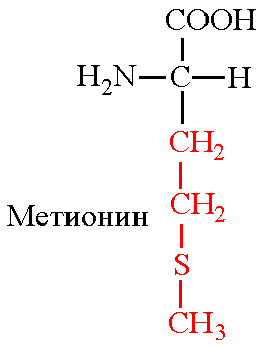


В. Специфичность обусловлена комплементарным взаимодействием радикалов лиганда и радикалов активного центра белка.
Г. ионные и водородные
Д. когда происходит взаимодействие регуляторного центра с его лигандом, то изменяется конформация одного протомера,что влечет изменение конформации других протомеров (в тч и протомера с активным центром), и таким образом, изменяется не только конформация активного центра, но и функции белка. Это аллостерический тип регуляции.
|
|
|
Желудочный сок содержит большое количество соляной кислоты, одна из функций которой- денатурация поступающих с пищей белков. Какое значение имеет денатурация пищевых и бактериальных белков в желудке для их переваривания и защиты организма от патогенных микроорганизмов, поступающих с пищей и водой?
А) белки проходят 3 (4) структуры:
Первичная структура белка – это последовательность аминокислот, которая закодирована в ДНК данной клетки и реализуется через процессы транскрипции и трансляции.
Вторичная структура белка – это взаимодействие между азотом аминогруппы и СООН карбоксильной группы в пептидном остове белка засчет водородных связей.
Третичная структура белка – это взаимодействие между радикалами аминокислот, которые не входят в состав остова.
Четвертичная структура белка – это образование слабых связей (водородных, ионных и тд) между протомерами белка (как у гемоглобина).
Нативный белок – это белок, который имеют свою стойкую конформацию.
Б) протеолитические ферменты разрывают петидные связи (самые крепкие в структуре белка).
В) рН желудочного сока вызывает дентурацию белков не только поступающих с пищей, но и белков в составе клеточных стенок и ЦПМ бактерий, поскольку оптимум существования белков (большинства) находится на уровне нейтрального или слабощелочного значения рН. Хотя некоторые микробы способны выдержать такое значение рН (Хеликобактеры, например), в их составе имеются белки, оптимум рН которых имеет кислую среду.
5. В реанимационное отделение больницы поступил пациент без сознания. Анализ крови показал повышенную концентрацию глюкозы и кетоновых тел, сниженную концентрацию инсулина…Почему введение инсулинадо восстановления рН крови не приводит к выходу пациента из комы?
А. белки проходят 3 (4) структуры:
· Первичная структура белка – это последовательность аминокислот, которая закодирована в ДНК данной клетки и реализуется через процессы транскрипции и трансляции.
· Вторичная структура белка – это взаимодействие между азотом аминогруппы и СООН карбоксильной группы в пептидном остове белка засчет водородных связей.
· Третичная структура белка – это взаимодействие между радикалами аминокислот, которые не входят в состав остова.
· Четвертичная структура белка – это образование слабых связей (водородных, ионных и тд) между протомерами белка (как у гемоглобина).
ü конформационная лабильность – это способность белков изменять свою конформацию, пока они не достигнут своей нативной (устойчивой) конформации или под влиянием различных факторов.
Б. на нативную конформацию белков могут влиять различные факторы: лекарственные препараты (конкурентные ингибиторы или активаторы), аллостерические ЛС, рН, отклоняющееся от оптимума существования белка, действие высоких или низких температур.
В. Инсулин – белок, который не может функционировать в рамках негазового некомпенсированного метаболического ацидоза, и, поэтому, такое значение рН приводит к его денатурации и он не может проявлять свои функции по снижению уровня глюкозы в крови, от чего и наступила гипегликемическая кома.
Взаимодействие нейромедиатора ацетилхолина с М-холинорецепторами вызывает сокращение гладких мыщц внутренних органов- кишечника, желудка, желчного и мочевого пузырей, бронхов, а также сужение зрачков. Кроме того, М-холинорецепторы имеются в ЦНС. Атропин- лекарственный препарат, используемый в клинической практике для снятия спазмов гладких мыщц. Каков механизм действия данного препарата?
А. При деполяризации пресинаптической терминали открываются потенциал-чувствительные кальциевые каналы, ионы кальция входят в пресинаптическую терминаль и запускают механизм слияния синаптических пузырьков с мембраной. В результате медиатор выходит в синаптическую щель и присоединяется к белкам-рецепторам постсинаптической мембраны, которые делятся на метаботропные и ионотропные. Первые связаны с G-белком и запускают каскад реакций внутриклеточной передачи сигнала. Вторые связаны с ионными каналами, которые открываются при связывании с ними нейромедиатора, что приводит к изменению мембранного потенциала. Медиатор действует в течение очень короткого времени, после чего разрушается специфическим ферментом. Например, в холинэргических синапсах фермент, разрушающий медиатор в синаптической щели — ацетилхолинэстераза. Одновременно часть медиатора может перемещаться с помощью белков-переносчиков через постсинаптическую мембрану (прямой захват) и в обратном направлении через пресинаптическую мембрану (обратный захват).
Б. Ацетилхолин: Атропин:


В. Атропин является конкурентным ингибитором ацетилхолина, отсюда он способен связываться с активным центром белка (на постсинаптической мембране синапса) и, вызывать релаксацию мышц.
Г. большие дозы атропина блокируют М-холинорецепторы, поэтому после распада данного вещества большие дозы ацетилхолина будут действовать на данные рецепторы и, следовательно, могут вызвать чрезмерное возбуждение и судороги.
Студент одной из африканских стран обратился в больницу с жалобами на одышку, головокружение, учащенное сердцебиение и боли в конечностях. В мазке крови были обнаружены эритроциты, имеющие форму серпа. Назовите наследственное заболевание, которым страдает данный студент, и причину развития его симптомов
А. Эритроциты имеют форму овала или круга, без ядра и митохондрий. Выполняют роль переноса О2 и СО2 в организме (участвуют в 3 этапе дыхания).
Б. основной белок эритроцитов – гемоглобин. Состоит из 4 протомеров, которые объединены в единый олигомерный белок. Имеет активный центр, который включает в себя гем и две АК (ГисF8 и ГисE7). Туда присоединяется кислород.
В. Когда изменяется структура белка, то это приводит к нарушению его нативной конформации и, следовательно, изменяется вид активного центра, белок либо перестает, либо снижает способность выполнять свои функции.
Мутации в гене В-цепи гемоглобина А, которые приводят к замене гидрофобной аминокислоты на гидрофильную, вызывают наследственную анемию. Почему замена всего одной аминокислоты в активном центре гемоглобина приводит к развитию тяжелого заболевания?
А. основной белок эритроцитов – гемоглобин. Состоит из 4 протомеров, которые объединены в единый олигомерный белок. Имеет активный центр, который включает в себя гем и две АК (ГисF8 и ГисE7). Туда присоединяется кислород.
Б. Активный центр белка
Активный центр Мв сформирован преимущественно гидрофобными радикалами аминокислот, далеко отстоящими друг от друга в первичной структуре.К активному центру присоединяется плохо растворимые в воде лиганды —гем и О2. Гем —специфический лиганд апоМв (рис. 1.20), основу которого составляют четыре пиррольных кольца, соединенных метенильными мостиками; в центре расположен атом Fe+2, соединенный с атомами азота пиррольных колец четырьмя координационными связями. В активном центре Мв кроме гидрофобных радикалов аминокислот имеются также остатки двух аминокислот с гидрофильными радикалами —Гис Е7 (Гис64) и Гис F8 (ГИС93) (рис. 1.21)

В. Гидрофобные АК формируют гидрофобный карман, где железо 2+ не может окислиться до 3+. При возникновении нарушения гидрофобности железо окислится и тогда белок не будет выполнять свою функцию.
У альпиниста при восхождении на высоту 3500 м проявились признаки гипоксии: головная боль, учащение дыхания, тошнота, усиление сердцебиения. Через два дня отдыха в лагере на той же высоте состояние значительно улучшилось. Объясните, как изменяется в этих условиях его концентрация в эритроцитах и как этот лиганд влияет на поступление кислорода в ткани при сниженном парциальном давлении кислорода в атмосфере.
А. основной белок эритроцитов – гемоглобин. Состоит из 4 протомеров, которые объединены в единый олигомерный белок. Имеет активный центр, который включает в себя гем и две АК (ГисF8 и ГисE7). Туда присоединяется кислород.
Б. 2,3-БФГ:
 суммарный заряд: -5
суммарный заряд: -5
В. 2,3-БФГ присоединяется в центральную полость гемоглобина, которая является аллостерическим центром этого белка. В тканях БФГ снижает таким образом сродство гемоглобина к кислороду и таким образом происходит газообмен. К легких наблюдается иная картина – БФГ отщепляется от аллостерического центра гемоглобина под давлением кислорода и тогда О2 легче присоединяется к гемоглобину.
Г. у альпинистов увеличивается содержание гемоглобина, активируется эритропоэз, открываются дополнительные капилляры снабжения головного мозга и сердца, увеличивается ОЦК, артериальное давление.
Энзимология
Дата добавления: 2020-04-25; просмотров: 1260; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
